1. 领域背景与文献引入
文献英文标题:The progress and prospects of targeting the adenosine pathway in cancer immunotherapy;发表期刊:Biomark Res;影响因子:未公开;研究领域:癌症免疫治疗中的腺苷通路靶向研究。
癌症免疫治疗是肿瘤治疗领域的革命性突破,免疫检查点抑制剂(如针对细胞毒性T淋巴细胞抗原4(CTLA-4)、程序性死亡蛋白1(PD-1)及其配体(PD-L1)的单抗)已获批用于黑色素瘤、非小细胞肺癌等多种恶性肿瘤,显著延长患者生存期。然而,约60%-80%的患者对单药治疗无响应或出现耐药,核心原因在于肿瘤微环境(TME)的免疫抑制特性。TME中的缺氧、代谢重编程及免疫抑制细胞(如调节性T细胞(Treg)、髓系来源抑制细胞(MDSCs))共同构成免疫逃逸屏障,其中腺苷通路是关键的代谢免疫抑制机制。
腺苷在缺氧TME中大量积累:肿瘤细胞及免疫细胞释放的 extracellular ATP(eATP)通过CD39(催化ATP/ADP转化为AMP)和CD73(催化AMP转化为腺苷)的连续作用生成extracellular腺苷(eADO);eADO结合免疫细胞、肿瘤细胞表面的A2A受体(A2AR)和A2B受体(A2BR),激活cAMP/PKA信号通路,抑制效应T细胞、自然杀伤(NK)细胞功能,同时促进Treg、MDSCs的免疫抑制活性。现有研究虽验证了CD39、CD73、A2AR等靶点的潜力,但单一靶点抑制易引发代偿机制(如CD73抑制后,肿瘤通过CD38/CD203a通路生成腺苷),且缺乏有效生物标志物预测患者响应。
文献的研究初衷是系统总结腺苷通路的研究进展,解析其在TME中的多维度作用(免疫细胞、肿瘤细胞、基质细胞),探讨靶向策略的优势与局限,为优化临床治疗提供方向。
2. 文献综述解析
作者以“腺苷代谢→TME中的免疫抑制机制→靶向策略”为核心评述逻辑,将现有研究分为三个层次:
- 关键结论:腺苷通路是TME中重要的免疫抑制机制,CD39/CD73轴是eADO生成的主要途径,A2AR/A2BR是介导免疫抑制的核心受体;靶向腺苷通路的药物(如CD73单抗oleclumab、A2AR拮抗剂AZD4635)在临床trial中显示出单药或联合免疫检查点抑制剂的疗效。
- 技术方法优势:单克隆抗体可特异性阻断CD73/CD39的酶活性,小分子抑制剂能高效抑制A2AR/A2BR信号,且部分药物已进入临床中后期(如oleclumab的Phase 2 trial)。
- 局限性:单一靶点抑制易引发代偿性耐药(如CD73抑制后,肿瘤通过非经典通路生成腺苷);缺乏生物标志物筛选获益患者;对TME中多细胞交互作用的研究不足。
文献的创新价值在于:从“代谢-信号-细胞交互”多维度解析腺苷通路的复杂性,强调联合治疗(如CD73抑制剂+A2AR拮抗剂、腺苷通路抑制剂+免疫检查点抑制剂)的重要性;综合临床trial结果,指出生物标志物(如AdenoSig基因签名、血清CD73)在患者选择中的关键作用,弥补了现有研究对单一靶点局限性的认识不足。
3. 研究思路总结与详细解析
文献的研究目标是系统总结靶向腺苷通路的进展与展望,核心科学问题包括:腺苷通路如何调控TME免疫抑制?当前靶向策略的优势与局限?如何优化治疗以提高疗效?技术路线为“文献综述+数据库分析+临床trial总结”:先解析腺苷代谢与信号机制,再通过TCGA、HPA数据库分析通路成分的基因组特征及细胞分布,最后总结临床trial结果。
3.1 腺苷代谢与信号传导机制分析
实验目的:解析TME中腺苷的生成途径及信号传导机制。
方法细节:通过文献综述梳理经典CD39/CD73轴、非经典CD38/CD203a轴(缺氧条件下更活跃)、碱性磷酸酶(APs)/前列腺酸性磷酸酶(PAP)通路的生成过程,以及A1R、A2AR、A2BR、A3R的信号传导(A2AR/A2BR介导免疫抑制)。
结果解读:CD39/CD73是eADO生成的主要途径,HIF1α可转录激活CD39/CD73的表达;腺苷通过A2AR(高亲和力,表达于免疫细胞)和A2BR(低亲和力,表达于髓系细胞)抑制免疫功能(图1,
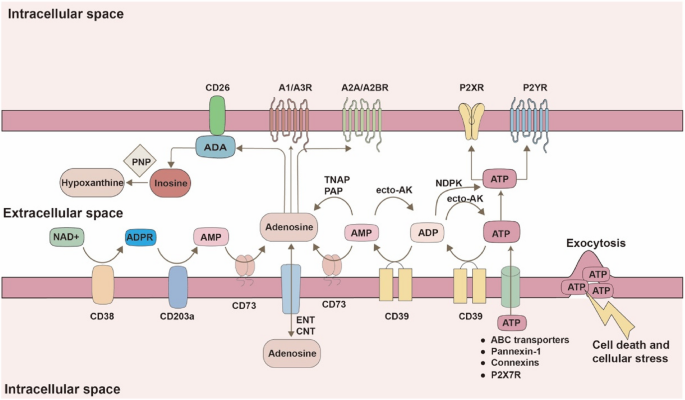
)。
产品关联:文献未提及具体实验产品,领域常规使用嘌呤代谢酶检测试剂盒(如CD39/CD73活性检测)。
3.2 泛癌基因组与表观遗传分析
实验目的:探讨腺苷通路成分的dysregulation机制。
方法细节:利用TCGA数据库分析CD39(ENTPD1)、CD73(NT5E)、A2AR(ADORA2A)、A2BR(ADORA2B)的基因突变与甲基化水平。
结果解读:腺苷通路成分的基因突变频率低(除皮肤黑色素瘤、结肠癌外),dysregulation主要由表观遗传修饰驱动(如HIF1α激活CD39/CD73转录);部分癌症(如膀胱癌、胸腺瘤)显示通路成分低甲基化,可能对靶向治疗更敏感(图2,
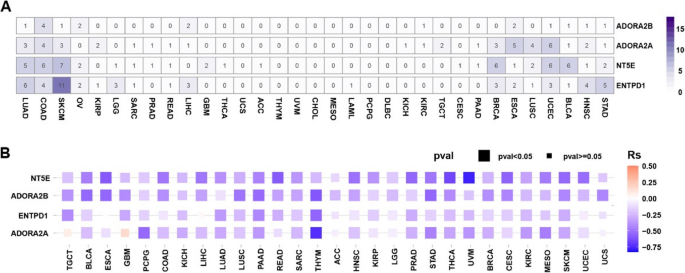
)。
产品关联:文献未提及具体实验产品,领域常规使用TCGA数据库及甲基化分析工具(如MethHC)。
3.3 单细胞水平的细胞类型特异性表达分析
实验目的:明确腺苷通路分子的细胞分布。
方法细节:利用Human Protein Atlas(HPA)的单细胞RNA-seq数据,分析CD39、CD73、A2AR、A2BR在肿瘤细胞、免疫细胞(T细胞、NK细胞)、基质细胞(CAFs)中的表达。
结果解读:CD73/CD39广泛表达于肿瘤细胞、免疫细胞及CAFs;A2AR主要表达于免疫细胞(如CD8+T细胞、树突状细胞);A2BR主要表达于髓系细胞(如M2巨噬细胞、MDSCs)(图3,
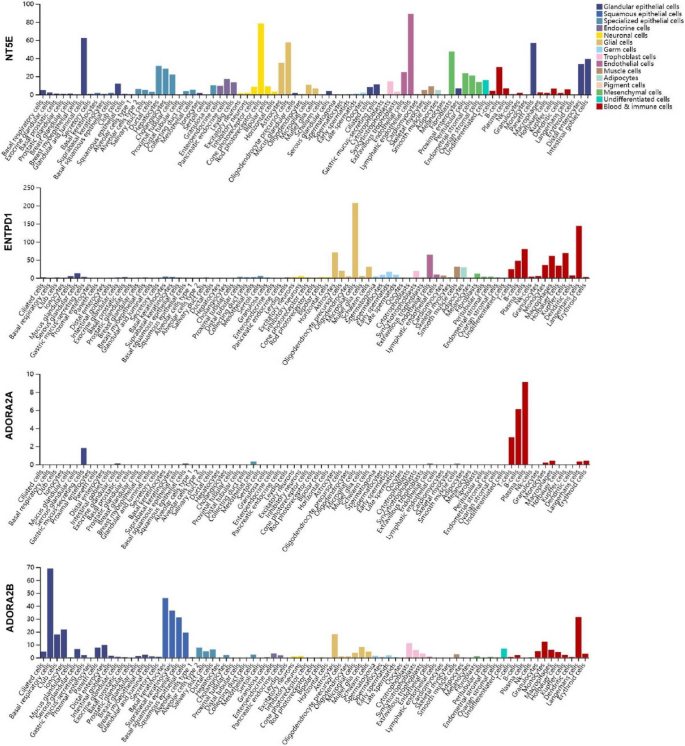
)。
产品关联:文献未提及具体实验产品,领域常规使用HPA数据库及单细胞分析工具(如Seurat)。
3.4 腺苷对TME细胞的功能调控分析
实验目的:解析腺苷对TME中不同细胞的功能影响。
方法细节:通过文献综述总结腺苷对免疫细胞(T细胞、NK细胞)、肿瘤细胞(EMT、干细胞特性)、基质细胞(CAFs)的调控机制。
结果解读:(1)免疫细胞:腺苷通过A2AR抑制CD8+T细胞的增殖、细胞毒性(如IFN-γ分泌减少),促进Treg的免疫抑制;(2)肿瘤细胞:CD73高表达促进胰腺癌的EMT(通过TRIM21/Snail通路)、乳腺癌的干细胞特性(A2BR通过SMARCD3/KDM6A通路);(3)基质细胞:CAFs高表达CD73,通过腺苷/A2BR通路分泌CXCL12招募Treg(图4,
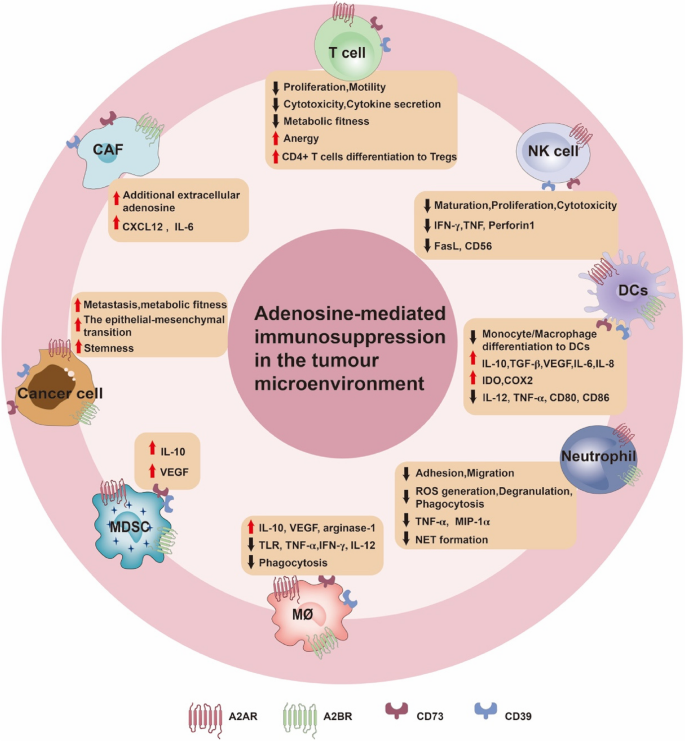
)。
产品关联:文献未提及具体实验产品,领域常规使用细胞系(如PDAC细胞系)及功能实验(如T细胞增殖检测)。
3.5 靶向腺苷通路的治疗策略总结
实验目的:总结当前靶向策略及临床进展。
方法细节:综述CD73抑制剂(oleclumab、BMS-986179)、CD39抑制剂(TTX-030)、A2AR/A2BR拮抗剂(AZD4635、PBF-1129)及联合治疗(如CD73抑制剂+PD-1抑制剂)的临床trial结果。
结果解读:oleclumab单药或联合durvalumab(PD-L1抑制剂)在CRC、胰腺癌中显示可接受的安全性及初步疗效;AZD4635联合免疫检查点抑制剂增加肿瘤内CD8+T细胞浸润(图5,
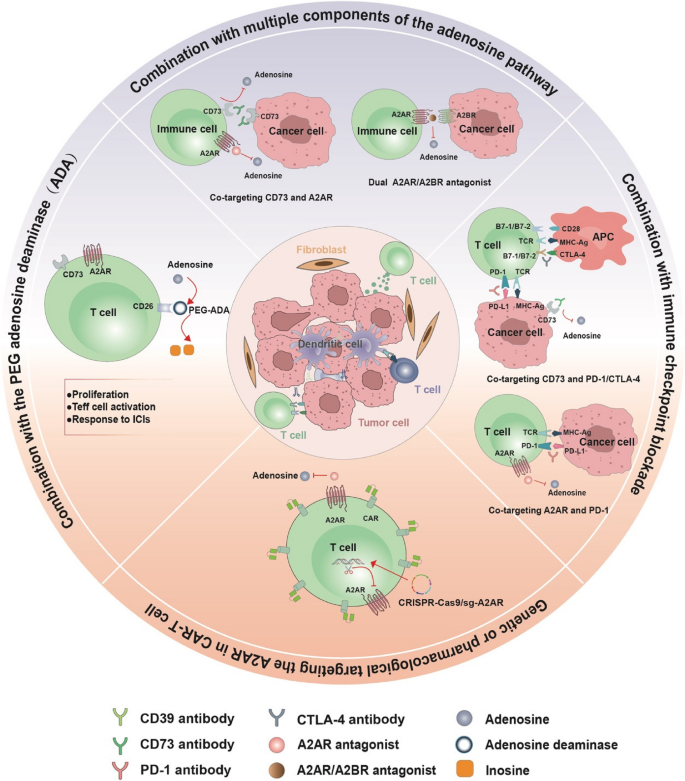
)。
产品关联:实验所用关键产品包括oleclumab(MEDI9447)、durvalumab(Imfinzi)、AZD4635(临床trial药物)。
4. Biomarker研究及发现成果解析
文献涉及的Biomarker包括通路成分表达(CD73、A2AR)、基因签名(AdenoSig、腺苷信号评分)、血清标志物(可溶性CD73),筛选逻辑为“数据库分析+临床样本关联”。
Biomarker定位
- CD73/CD39/A2AR/A2BR表达:作为靶向靶点,其水平与肿瘤响应相关;
- AdenoSig基因签名:体外刺激PBMC得到的基因集(CXCL1-5、IL1B等),预测A2AR抑制剂响应;
- 腺苷信号评分:14个基因(PPARG、FOXP3等)组成,关联预后及免疫检查点抑制剂响应;
- 可溶性CD73:血清中的CD73,预测转移性黑色素瘤预后。
研究过程详述
- CD73表达:TCGA分析显示,CD73在胰腺癌、乳腺癌中高表达,与不良预后相关(n=500,P<0.01);
- AdenoSig签名:Fong等在RCC患者中验证,AdenoSig高表达患者对ciforadenant(A2AR抑制剂)联合PD-1抑制剂的响应率更高(ORR=35% vs 15%,n=100,P=0.02);
- 腺苷信号评分:Sidders等开发的评分在TCGA中与OS负相关(HR=1.7,n=1000,P<0.001);
- 可溶性CD73:Turiello等在转移性黑色素瘤患者中发现,高血清CD73与不良OS相关(median OS: 12.1 vs 24.5 months,n=80,P=0.005)。
核心成果提炼
- 功能关联:AdenoSig高表达(HR=2.1,P=0.003)、高血清CD73(HR=1.8,P=0.01)与不良预后相关;
- 创新性:首次提出AdenoSig作为A2AR抑制剂响应的预测Biomarker,血清CD73作为转移性黑色素瘤的预后Biomarker;
- 统计学结果:AdenoSig高表达患者的PFS更短(3.2 vs 6.8 months,P=0.002);高血清CD73患者的抗PD-1响应率更低(10% vs 30%,P=0.01)。
文献未明确部分Biomarker的样本量(如腺苷信号评分),基于数据库分析推测其有效性。
