1. 领域背景与文献引入
文献英文标题:Harnessing natural killer cells for refractory/relapsed non-Hodgkin lymphoma: biological roles, clinical trials, and future prospective;发表期刊:Biomark Research;影响因子:未公开;研究领域:复发/难治性非霍奇金淋巴瘤(R/R NHL)的自然杀伤(NK)细胞免疫治疗。
非霍奇金淋巴瘤(NHL)是全球最常见的血液系统恶性肿瘤之一,约占淋巴瘤的90%,其中B细胞NHL(如弥漫大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL))占比最高。尽管化疗(如R-CHOP方案)、单克隆抗体(如利妥昔单抗)、自体造血干细胞移植(auto-HSCT)及CAR-T细胞治疗等手段显著改善了患者预后,但仍有30%~50%的患者会出现复发或对治疗耐药(即R/R NHL)。CAR-T细胞治疗虽对R/R NHL有较高的客观缓解率(ORR),但可能引发严重的细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)及移植物抗宿主病(GVHD),限制了其广泛应用。
NK细胞作为固有免疫系统的重要效应细胞,具有不依赖主要组织相容性复合体(MHC)的细胞毒性、可通过抗体依赖性细胞介导的细胞毒性(ADCC)清除肿瘤细胞,且安全性良好(不易引发严重炎症反应),因此成为R/R NHL免疫治疗的潜在替代方案。近年来,随着NK细胞工程化技术的发展(如CAR-NK)、联合治疗策略的优化(如与单抗、双特异性杀伤性衔接器(BiKEs)联合)及记忆样NK细胞(CIML NK)的发现,NK细胞治疗的疗效逐步提升,但仍面临诸多挑战:如NK细胞在肿瘤微环境(TME)中易出现数量减少、功能耗竭;NK细胞的来源(外周血、脐带血、诱导多能干细胞(iPSC))及体外扩增效率有限;体内存活时间短等。
本综述旨在系统总结NK细胞在R/R NHL中的生物学作用、临床研究进展及未来方向,为优化NK细胞治疗策略提供理论基础。
2. 文献综述解析
作者对现有研究的分类维度主要包括四个部分:1. NK细胞的生物学特性(受体表达、功能调控);2. NHL肿瘤微环境(TME)对NK细胞的抑制机制;3. NK细胞治疗R/R NHL的临床策略(单药治疗、联合治疗、CAR-NK细胞治疗);4. 细胞因子诱导的记忆样NK细胞(CIML NK)的研究进展。
现有研究关键结论
- NK细胞生物学特性:NK细胞通过激活受体(如NKG2C、自然细胞毒性受体(NCRs)、NKG2D、CD16)介导细胞毒性及ADCC,通过抑制受体(如NKG2A、杀伤细胞免疫球蛋白样受体(KIRs)、PD-1)维持免疫耐受。在R/R NHL中,NK细胞常出现数量减少(绝对NK细胞计数(A-NKC)降低)、激活受体(如NKG2D、CD16)表达下调、抑制受体(如TIGIT、PD-1)表达上调,导致功能耗竭。
- TME的抑制机制:NHL的TME中存在免疫抑制细胞(髓系来源的抑制细胞(MDSCs)、调节性T细胞(Tregs)、M2型肿瘤相关巨噬细胞(TAMs))及分子(TGF-β、IL-10、吲哚胺2,3-双加氧酶(IDO)),通过分泌细胞因子或直接接触抑制NK细胞的增殖、细胞毒性及细胞因子分泌(如IFN-γ)。
- 临床治疗策略:NK细胞单药治疗R/R NHL的疗效有限(ORR约27%~50%),但联合单克隆抗体(如利妥昔单抗)可通过增强ADCC提高疗效(ORR达67%);BiKEs(如AFM13,靶向CD30/CD16A)可桥接NK细胞与肿瘤细胞,提高局部激活;CAR-NK细胞(如CD19 CAR-NK)通过靶向肿瘤抗原,显著提高特异性细胞毒性,且安全性优于CAR-T细胞(无严重CRS或GVHD)。
- CIML NK细胞潜力:通过IL-12/15/18预激活的CIML NK细胞具有类似记忆细胞的持久力和增强的细胞毒性,在小鼠淋巴瘤模型中显示出比常规NK细胞更好的疗效,但临床研究仍处于早期阶段。
现有研究局限性
- NK细胞来源有限(如外周血NK细胞需大量扩增,脐带血NK细胞数量少),体外扩增效率低;
- 体内存活时间短(如NK-92细胞输注后15分钟内即无法检测到);
- CAR-NK细胞的转导效率(如慢病毒转导效率约8%~16%)及体内扩增能力仍需提高;
- CIML NK细胞的分子机制及临床疗效仍需深入研究。
本研究创新价值
作者系统整合了NK细胞的生物学基础、TME的抑制机制及临床治疗策略,重点强调了联合治疗(如NK细胞+单抗、NK细胞+BiKEs)及CIML NK细胞的潜力,为R/R NHL的NK细胞治疗提供了全面的理论框架,弥补了现有研究中对NK细胞治疗策略整合不足的空白。
3. 研究思路总结与详细解析
本综述的研究目标是“总结NK细胞在R/R NHL中的生物学作用及临床研究进展,探讨未来优化策略”,核心科学问题是“如何克服NK细胞在R/R NHL中的功能缺陷,提高治疗疗效”,技术路线逻辑是“NK细胞生物学特性→TME对NK细胞的抑制→临床治疗策略(单药/联合/CAR-NK)→CIML NK细胞的潜力”。
3.1 NK细胞的生物学特性解析
实验目的:明确NK细胞的受体表达及功能调控机制,为理解其在R/R NHL中的作用奠定基础。
方法细节:作者综合了大量基础研究,总结了NK细胞的激活受体(如NKG2C、NCRs(NKp46、NKp44、NKp30)、NKG2D、CD16)和抑制受体(如NKG2A、KIRs、PD-1),以及这些受体通过信号通路(如DAP-12、ITAM)调控NK细胞的细胞毒性(释放穿孔素/颗粒酶)、ADCC(通过CD16结合抗体Fc段)及细胞因子分泌(如IFN-γ、TNF-α)。
结果解读:NK细胞通过“丢失自我”(missing self)机制识别缺乏MHC I类分子的肿瘤细胞,通过激活受体介导细胞毒性;抑制受体则防止NK细胞攻击正常细胞。在R/R NHL中,肿瘤细胞通过下调MHC I类分子配体(如MICA/B)、上调抑制分子(如HLA-G)抑制NK细胞激活,导致NK细胞功能缺陷。
产品关联:文献未提及具体实验产品,领域常规使用NK细胞扩增试剂盒(如含有IL-2、IL-15的培养基)、流式抗体(如抗CD56、CD16、NKG2D抗体)。
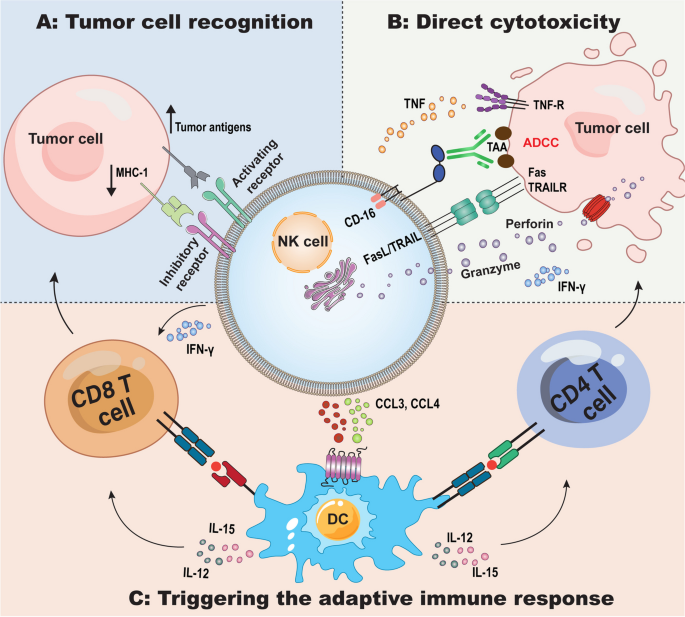
3.2 NHL肿瘤微环境对NK细胞的抑制机制解析
实验目的:探讨TME中免疫细胞及分子对NK细胞的抑制作用。
方法细节:作者总结了TME中的免疫抑制细胞(MDSCs、Tregs、M2巨噬细胞)及分子(TGF-β、IL-10、IDO)的研究,如MDSCs通过分泌IL-10、TGF-β抑制NK细胞的NKG2D表达及IFN-γ分泌;Tregs通过IDO消耗色氨酸,抑制NK细胞增殖;M2巨噬细胞通过表达ILT2受体抑制NK细胞功能。
结果解读:TME中的免疫抑制网络显著削弱了NK细胞的抗肿瘤活性,是NK细胞治疗的主要障碍之一。
产品关联:文献未提及具体实验产品,领域常规使用免疫细胞分离试剂盒(如MDSCs、Tregs分离磁珠)、细胞因子检测试剂盒(如ELISA检测TGF-β、IL-10)。
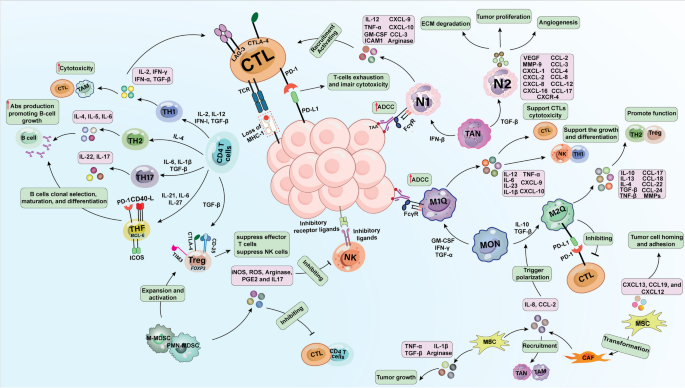
3.3 NK细胞治疗R/R NHL的临床策略解析
实验目的:评估NK细胞单药及联合治疗的临床疗效与安全性。
方法细节:作者总结了多项临床研究:① 单药NK细胞治疗(如NK-92细胞系、脐带血NK细胞),剂量范围1×10^6~3×10^7 cells/kg,结果显示稳定疾病(SD)率约47%;② 联合利妥昔单抗:如AB-101(脐带血NK细胞)联合利妥昔单抗,ORR达67%,完全缓解(CR)率33%;③ 联合BiKEs:如AFM13(CD30/CD16A BiKE)联合脐带血NK细胞,ORR达92.8%,CR率66.7%;④ CAR-NK细胞治疗:如CD19 CAR-NK,ORR达48.6%,1年总生存(OS)率68%,且无严重CRS或GVHD。
结果解读:联合治疗显著提高了NK细胞的疗效,其中BiKEs可桥接NK细胞与肿瘤细胞,增强局部激活;CAR-NK细胞通过靶向肿瘤抗原(如CD19)提高特异性,且安全性优于CAR-T细胞。
产品关联:文献提到的关键产品包括NK-92细胞系、AB-101(脐带血NK细胞产品)、AFM13(BiKEs)、CD19 CAR-NK细胞(如MD Anderson的产品)。
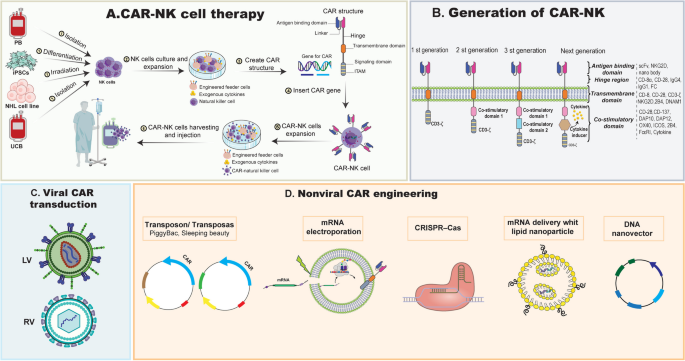
3.4 细胞因子诱导的记忆样NK细胞(CIML NK)解析
实验目的:探讨CIML NK细胞的生物学特性及临床潜力。
方法细节:作者总结了CIML NK细胞的诱导方法(IL-12/15/18预激活)及特性(如高增殖能力、持久的IFN-γ分泌、抵抗TGF-β抑制),并提到其在小鼠淋巴瘤模型中的疗效(如抑制RMA-S淋巴瘤生长)。
结果解读:CIML NK细胞具有更好的持久力和功能,可能克服常规NK细胞的局限性,但临床研究仍处于早期阶段。
产品关联:文献未提及具体实验产品,领域常规使用细胞因子(IL-12、IL-15、IL-18)诱导CIML NK细胞。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker主要包括三类:① NK细胞相关标志物(绝对NK细胞计数(A-NKC)、激活/抑制受体表达);② TME相关标志物(MDSCs、Tregs、IDO、TGF-β);③ CAR-NK细胞相关标志物(CAR表达效率、体内扩增水平)。
筛选/验证逻辑
- A-NKC:通过流式细胞术检测外周血NK细胞数量,验证其与预后的相关性(如低A-NKC与短无进展生存(PFS)、OS相关);
- 激活/抑制受体:通过流式细胞术检测NKG2D、CD16(激活受体)及TIGIT、PD-1(抑制受体)的表达,验证其与NK细胞功能的相关性;
- TME标志物:通过免疫组化或ELISA检测IDO、TGF-β的表达,验证其与免疫抑制的相关性;
- CAR-NK标志物:通过流式细胞术检测CAR表达效率,通过qPCR或流式检测体内扩增水平,验证其与疗效的相关性。
研究过程详述
- A-NKC:在DLBCL、FL、原发性中枢神经系统淋巴瘤(PCNSL)患者中,低A-NKC与不良预后相关(如DLBCL患者低A-NKC组5年OS率55%,高A-NKC组87%;PCNSL患者高A-NKC组OS更长);
- 激活/抑制受体:NKG2D表达降低与NK细胞功能耗竭相关,CD16表达降低影响ADCC;TIGIT高表达与NK细胞耗竭相关;
- TME标志物:IDO高表达与Tregs增加相关,抑制NK细胞增殖;TGF-β高表达抑制NK细胞的NKG2D表达及IFN-γ分泌;
- CAR-NK标志物:CAR表达效率(如慢病毒转导效率约43%~93%)与体内扩增水平(如CD19 CAR-NK输注后体内可检测2周)与疗效相关(OR患者的CAR-NK水平更高,持续时间更长)。
核心成果提炼
- A-NKC:是R/R NHL的预后Biomarker(风险比HR=2.1,P=0.003),低A-NKC与短PFS、OS相关;
- 激活/抑制受体:NKG2D、CD16的表达水平可预测NK细胞的ADCC功能,TIGIT高表达提示NK细胞耗竭;
- TME标志物:IDO、TGF-β是TME中抑制NK细胞的关键Biomarker,其高表达与免疫抑制相关;
- CAR-NK标志物:CAR-NK细胞的体内扩增水平与疗效正相关(OR患者的CAR-NK水平更高,持续时间更长)。
总结
本综述系统总结了NK细胞在R/R NHL中的生物学作用及临床研究进展,强调了联合治疗(如NK细胞+单抗、NK细胞+BiKEs)及CIML NK细胞的潜力,为R/R NHL的NK细胞治疗提供了全面的理论框架。未来研究需进一步优化NK细胞的来源、扩增方法及体内存活时间,深入探讨CIML NK细胞的分子机制,以提高治疗疗效。
