1. 领域背景与文献引入
文献英文标题:Co-enrichment of CD8-positive T cells and macrophages is associated with clinical benefit of tislelizumab in solid tumors;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(实体瘤免疫检查点抑制剂生物标志物研究)。
肿瘤免疫治疗的突破以PD-1/PD-L1抑制剂为代表,其通过解除T细胞免疫抑制、恢复抗肿瘤效应,已成为多种实体瘤的标准治疗方案。然而,仅约20%-40%的患者能从PD-1/PD-L1抑制剂中获益,传统生物标志物PD-L1的预测价值存在局限性——其表达受肿瘤细胞异质性、检测方法差异影响,难以全面反映肿瘤微环境(Tumor Microenvironment, TME)的免疫状态。TME中免疫细胞的相互作用是疗效差异的关键驱动因素:CD8+细胞毒性T细胞是直接杀伤肿瘤的核心效应细胞,而巨噬细胞作为TME中最丰富的固有免疫细胞,表型呈连续谱型(从促炎“M1样”到抑炎“M2样”),可通过分泌趋化因子招募T细胞、抗原呈递增强免疫应答,或通过分泌抑制性细胞因子(如TGF-β)削弱CD8+T细胞功能。但现有研究多关注单一免疫细胞的作用,对CD8+T细胞与巨噬细胞的“共富集”及空间相互作用缺乏深入探索。
替雷利珠单抗是一款经Fc段改造的PD-1抑制剂,通过突变Fc区域减少与巨噬细胞表面CD64(FcγRI)的结合,避免抗体依赖性细胞吞噬(Antibody-Dependent Cellular Phagocytosis, ADCP)介导的CD8+T细胞消耗。但CD64+巨噬细胞在替雷利珠单抗治疗中的功能及与CD8+T细胞的相互作用尚未阐明。本研究针对这一空白,探索CD8+T细胞与巨噬细胞的共富集及CD64+巨噬细胞对替雷利珠单抗临床获益的预测价值,为精准免疫治疗提供生物标志物支持。
2. 文献综述解析
作者对现有研究的分类维度涵盖三方面:免疫细胞功能(CD8+T细胞的效应机制、巨噬细胞的表型异质性)、生物标志物局限性(PD-L1的预测缺陷)、药物特异性机制(Fc段改造对免疫细胞相互作用的影响)。
现有研究的关键结论包括:(1)CD8+T细胞浸润是PD-1抑制剂疗效的核心预测因素,但单独检测CD8+T细胞无法区分“功能性”与“耗竭性”细胞,预测能力有限;(2)巨噬细胞异质性显著,促炎M1样巨噬细胞通过CXCL9/CXCL10趋化T细胞、抗原呈递增强免疫应答,而抑炎M2样巨噬细胞通过IL-10、TGF-β抑制CD8+T细胞功能,但传统M1/M2二分法无法覆盖巨噬细胞的动态变化;(3)PD-L1作为当前主要生物标志物,其表达在肿瘤细胞与免疫细胞间存在差异,约30%PD-L1阴性患者仍能从治疗中获益,提示需补充其他生物标志物。
现有研究的优势在于建立了PD-1抑制剂的疗效框架,明确了CD8+T细胞与巨噬细胞的核心地位;但局限性也同样明显:单一细胞视角无法反映TME的网络相互作用,巨噬细胞表型的复杂性导致其与疗效的关系存在争议,药物特异性研究不足(如Fc段改造对CD64+巨噬细胞功能的影响未被充分探索)。
本研究的创新价值在于:(1)首次提出“细胞共富集”生物标志物,将CD8+T细胞与巨噬细胞的联合状态作为替雷利珠单抗的疗效预测指标,突破单一细胞的局限性;(2)结合药物机制,解析CD64+促炎巨噬细胞在替雷利珠单抗治疗中的正向作用(Fc段改造避免ADCP,保留其促炎功能);(3)引入空间维度,验证CD8+T细胞与CD64+巨噬细胞的近距关系与疗效的关联,为TME的“空间免疫”研究提供证据。
3. 研究思路总结与详细解析
3.1 整体框架概括
研究目标:探索CD8+T细胞与巨噬细胞的共富集、CD64+巨噬细胞密度及空间关系对替雷利珠单抗治疗实体瘤临床获益的影响;核心科学问题:CD8+T细胞与巨噬细胞的相互作用如何调控TME免疫状态,进而影响替雷利珠单抗疗效?CD64+巨噬细胞的功能及空间关系的意义是什么?技术路线:回顾性纳入3项替雷利珠单抗单药试验(NCT02407990、NCT04068519、NCT04004221)的实体瘤患者,通过多重免疫组化(mIHC)检测小样本(n=67)的细胞密度,基因表达谱(GEP)验证大人群(n=629)的基因签名,结合生存分析、TME功能签名及空间 proximity 分析,最终解析生物标志物的机制与价值。
3.2 临床队列与样本收集
实验目的:建立替雷利珠单抗治疗的生物标志物可评估人群(Biomarker-Evaluable Population, BEP),获取基线样本与临床数据。
方法细节:回顾性纳入3项Ⅰ/Ⅱ期临床试验的患者,收集基线福尔马林固定石蜡包埋(FFPE)样本,筛选出mIHC BEP(n=67,可进行细胞密度分析)与GEP BEP(n=629,可进行基因表达分析),其中65例患者同时纳入两个BEP。临床数据包括总生存期(Overall Survival, OS),采用Kaplan-Meier法估算中位OS,log-rank检验比较组间差异。
结果解读:mIHC BEP与GEP BEP的基线特征(如肿瘤类型、ECOG评分)可比,GEP BEP涵盖更广泛的肿瘤类型(如非小细胞肺癌、尿路上皮癌、胃癌),为后续分析提供了多样化人群基础。
产品关联:文献未提及具体样本收集产品,领域常规使用FFPE样本存储系统及电子数据捕获(EDC)系统管理临床数据。
3.3 多重免疫组化(mIHC)与细胞密度分析
实验目的:定量检测TME中CD8+T细胞、CD68+巨噬细胞、CD64+巨噬细胞的密度,分析其与OS的关系。
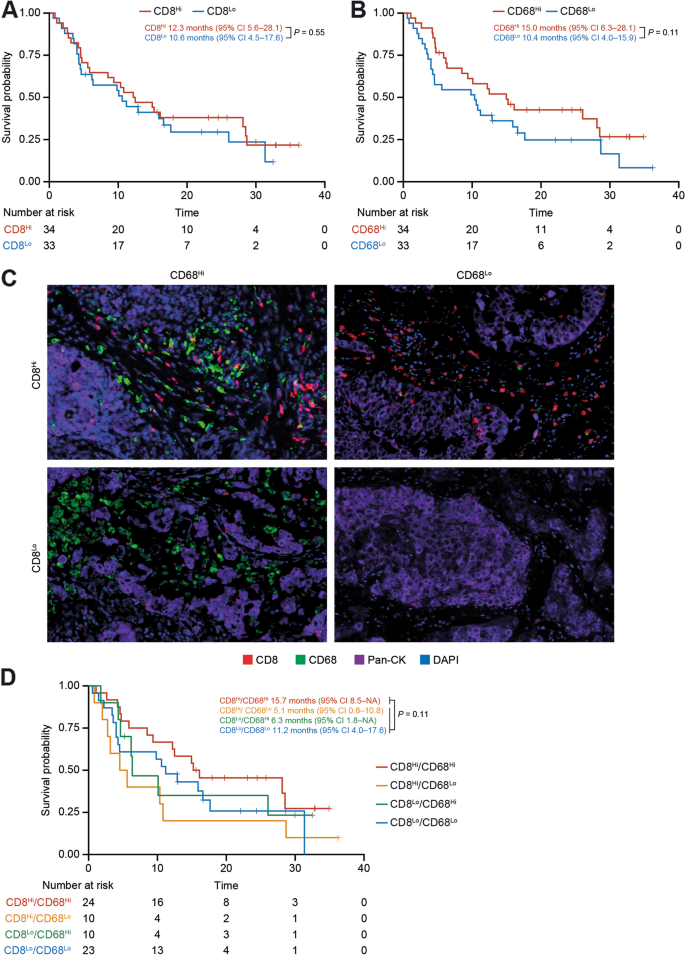
方法细节:使用Opal自动化mIHC试剂盒(PerkinElmer)在Leica BOND Rx平台进行染色,抗体包括CD64(Abcam ab140779)、CD68(VENTANA 790–2931,巨噬细胞泛标志物)、CD8(VENTANA 790–4460,T细胞标志物)、PD-L1(VENTANA 790–4905)及Pan-Keratin(VENTANA 760–2135,肿瘤细胞标志物)。通过Leica Aperio VERSA 8显微镜获取全片图像,HALO软件(Indica Labs)分析细胞密度,以中位数为cutoff将患者分为“高密度”与“低密度”组。
结果解读:mIHC分析显示,CD8+T细胞与CD68+巨噬细胞共富集(CD8Hi/CD68Hi)的患者中位OS最长(15.7个月),显著长于其他三组(CD8Hi/CD68Lo:5.1个月、CD8Lo/CD68Hi:6.3个月、CD8Lo/CD68Lo:11.2个月),但因样本量小(n=67),统计学显著性不足(P=0.11)。
插入图片:
3.4 基因表达谱(GEP)与基因签名分析
实验目的:在大人群中验证mIHC的趋势,明确CD8+T细胞与巨噬细胞共富集与OS的显著关联。
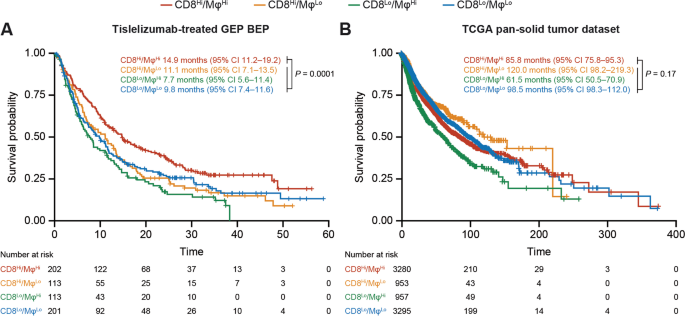
方法细节:使用HTG EdgeSeq Precision Immuno-Oncology Panel(HTG Molecular Diagnostics)对GEP BEP(n=629)的样本进行基因表达分析,Illumina Nextseq 500测序,通过limma-voom流程归一化数据。采用Jerby-Arnon等的CD8+T细胞基因签名(如CD8A、GZMB)与Tirosh等的巨噬细胞基因签名(如CD68、CSF1R),以中位数为cutoff分为“高表达”(Hi)与“低表达”(Lo)组。
结果解读:GEP分析验证了mIHC的趋势——CD8Hi/MφHi组患者的中位OS显著长于其他三组(14.9个月 vs CD8Hi/MφLo:11.1个月、CD8Lo/MφHi:7.7个月、CD8Lo/MφLo:9.8个月),统计学差异显著(P=0.0001)。Cox比例风险模型调整肿瘤类型后,CD8Hi/MφHi组仍具有OS优势(HR=0.71,95%CI 0.57-0.87,P<0.0001)。
插入图片:
3.5 TME功能签名与差异基因分析
实验目的:解析CD8Hi/MφHi组的TME免疫特征,探索共富集的机制。
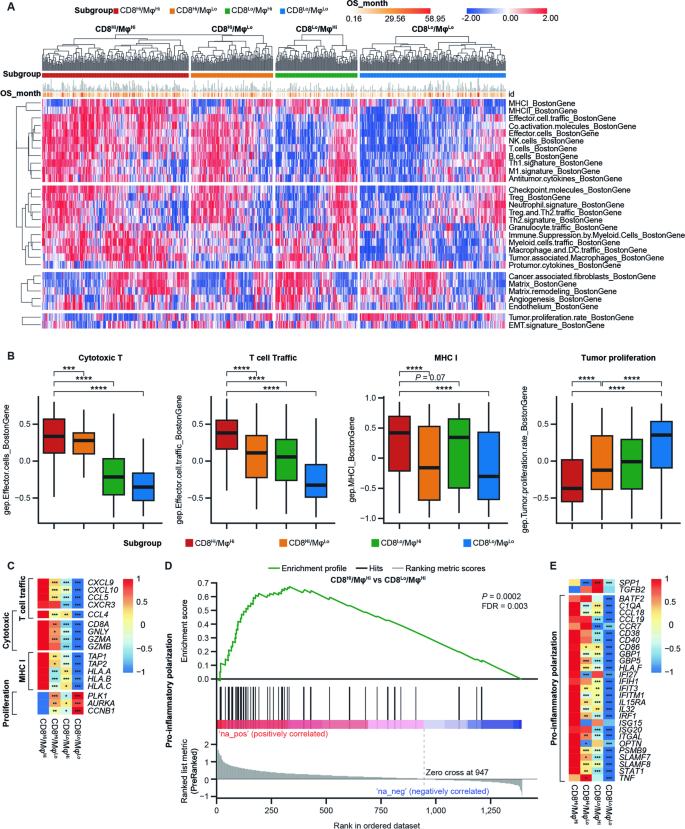
方法细节:使用Bagaev等的29个功能基因签名(涵盖免疫细胞浸润、血管生成、肿瘤增殖等)分析TME状态,通过limma-voom分析差异基因,基因集富集分析(GSEA)探索巨噬细胞极化通路。
结果解读:CD8Hi亚组(无论巨噬细胞表达)均表现为“免疫激活型”TME,富集T细胞、细胞毒性细胞、自然杀伤细胞等签名;CD8Hi/MφHi组进一步上调T细胞功能基因(如细胞毒性相关的GZMB、GNLY,趋化相关的CXCL9、CXCL10,MHC I抗原呈递相关的TAP1、HLA-A),下调肿瘤增殖基因(如PLK1、AURKA)。GSEA显示,CD8Hi/MφHi组的巨噬细胞呈“促炎极化”——高表达STAT1、ISG15等M1样基因,低表达SPP1、TGFB2等M2样/促血管生成基因,提示巨噬细胞通过增强T细胞招募与抗原呈递,协同CD8+T细胞发挥抗肿瘤作用。
插入图片:
3.6 CD64+巨噬细胞分析与空间 proximity 研究
实验目的:探索CD64+巨噬细胞的功能及与CD8+T细胞的空间关系对疗效的影响。
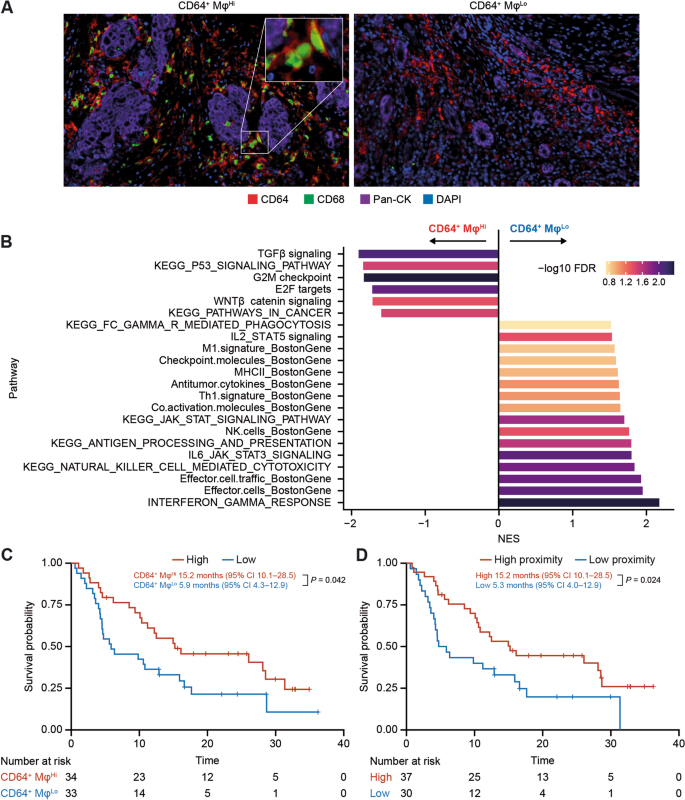
方法细节:通过mIHC检测CD64+巨噬细胞(CD64+CD68+)的密度,HALO空间分析模块计算CD8+T细胞与CD64+巨噬细胞的平均 proximity(≤30μm内的细胞数),以中位数为cutoff分为“高proximity”与“低proximity”组。
结果解读:CD64+巨噬细胞高密度组患者的中位OS显著长于低密度组(15.2个月 vs 5.9个月,P=0.042);高proximity组患者的中位OS显著长于低proximity组(15.2个月 vs 5.3个月,P=0.024)。GSEA显示,CD64+巨噬细胞密度与免疫激活通路(如IFNγ响应、细胞毒性)正相关,与促肿瘤通路(如TGFβ、Wnt)负相关,提示替雷利珠单抗的Fc段改造避免了CD64+巨噬细胞的ADCP效应,保留了其促炎功能。
插入图片:
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位与筛选逻辑
本研究的Biomarker分为三类:(1)细胞共富集状态:CD8+T细胞与巨噬细胞的共富集(CD8Hi/MφHi);(2)细胞表型:CD64+促炎巨噬细胞密度;(3)空间关系:CD8+T细胞与CD64+巨噬细胞的proximity。筛选与验证逻辑遵循“小样本探索→大人群验证→机制解析→空间验证”的闭环:先通过mIHC小样本发现共富集的趋势,再通过GEP大人群验证其与OS的显著关联,随后通过TME功能分析解析机制,最后通过mIHC空间分析验证CD64+巨噬细胞的作用。
4.2 研究过程与数据
Biomarker来源:实体瘤患者的基线FFPE样本;验证方法:mIHC(细胞密度定量)、GEP(基因签名评分)、空间分析(细胞间距离计算);关键数据:
- CD8Hi/MφHi组在GEP中的OS HR=0.71(95%CI 0.57-0.87,P<0.0001),提示共富集患者的死亡风险降低29%;
- CD64+巨噬细胞高密度组OS HR=0.47(95%CI 0.23-0.96,P=0.042),死亡风险降低53%;
- 高proximity组OS HR=0.45(95%CI 0.21-0.96,P=0.024),死亡风险降低55%。
4.3 核心成果与创新性
(1)CD8+T细胞与巨噬细胞的共富集是替雷利珠单抗的有效预测生物标志物:其机制与“免疫激活型TME”相关——共富集的巨噬细胞通过分泌趋化因子招募T细胞、增强抗原呈递,协同CD8+T细胞发挥抗肿瘤作用;
(2)CD64+促炎巨噬细胞是替雷利珠单抗的正向生物标志物:替雷利珠单抗的Fc段改造避免了CD64+巨噬细胞的ADCP效应,保留了其促炎功能,因此高密度CD64+巨噬细胞与OS获益相关;
(3)空间 proximity 是疗效的关键补充:CD8+T细胞与CD64+巨噬细胞的近距提示两者存在直接相互作用(如抗原呈递),进一步增强免疫应答。
本研究的创新性在于突破单一细胞的局限性,将“细胞共富集”与“空间关系”纳入生物标志物体系,为替雷利珠单抗的精准应用提供了多维度证据,也为免疫治疗生物标志物的发展(从“单一分子”到“细胞网络”)提供了新思路。
结论:CD8+T细胞与巨噬细胞的共富集、CD64+促炎巨噬细胞密度及空间近距是替雷利珠单抗治疗实体瘤的有效生物标志物,可帮助筛选潜在获益患者,为精准免疫治疗提供支持。
