1. 领域背景与文献引入
文献英文标题:Unraveling the protein kinase C/NDRG1 signaling network in breast cancer;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:乳腺癌(三阴性乳腺癌)信号通路与生物标志物研究。
乳腺癌是全球女性最常见的恶性肿瘤,其中三阴性乳腺癌(TNBC)因缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her2)表达,临床治疗选择有限,5年生存率仅约77%(领域共识)。N-myc下游调节基因1(NDRG1)是一个多功能胞内蛋白,在不同癌症中表现出“双面性”:在结直肠癌、胰腺癌中低表达与不良预后相关(抑癌),但在肝癌、非小细胞肺癌中高表达提示预后差(促癌)。然而,NDRG1在乳腺癌尤其是TNBC中的表达模式、调控机制及功能仍不明确。蛋白激酶C(PKC)是细胞响应外界应激(如血清剥夺、内质网应激)的关键信号分子,可调节细胞存活和侵袭,但PKC与NDRG1在乳腺癌中的相互作用尚未见报道。当前研究空白包括:NDRG1在乳腺癌亚型中的表达差异不明确,调控机制尤其是PKC的作用未阐明,临床预后价值缺乏大样本验证。
针对上述空白,本研究旨在系统解析NDRG1在乳腺癌中的表达谱、预后意义,以及PKC调控NDRG1的分子机制,同时探索NDRG1对乳腺癌细胞侵袭的影响,为TNBC的精准治疗提供新的生物标志物和靶点。
2. 文献综述解析
作者对现有研究的分类维度主要分为三部分:1)NDRG1在不同癌症中的功能异质性(抑癌vs促癌);2)NDRG1的调控机制(转录水平:Myc、缺氧诱导因子1(HIF-1)、p53等;翻译后水平:丝氨酸330磷酸化、亚细胞定位);3)PKC在细胞应激响应中的作用及与癌症的关联。现有研究表明,NDRG1的功能依赖于组织类型和细胞微环境,例如在缺氧条件下NDRG1核定位增加,促进肿瘤耐药;但乳腺癌中NDRG1的亚型特异性表达(如TNBC vs Luminal)尚未明确。此外,PKC可通过激活丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3激酶(PI3K)等通路调控细胞侵袭,但与NDRG1的直接关联缺乏实验证据。
现有研究的局限性包括:NDRG1在乳腺癌中的预后价值多基于小样本,调控机制的体内验证不足,且未涉及PKC-NDRG1通路在TNBC侵袭中的作用。本研究的创新价值在于:1)首次在大样本乳腺癌队列中明确NDRG1在TNBC中的高表达及独立预后价值;2)揭示PKC通过调控NDRG1表达影响Rho相关卷曲螺旋形成蛋白激酶1(ROCK1)/丝切蛋白(cofilin)通路,进而促进乳腺癌细胞侵袭的新机制;3)通过空间蛋白质组学和CRISPR/Cas9技术,将NDRG1的表达模式与功能机制相结合,为TNBC的靶向治疗提供了理论基础。
3. 研究思路总结与详细解析
本研究以“临床样本-细胞模型-机制验证-功能实验”为闭环,首先通过临床样本分析NDRG1的表达模式与预后价值;接着利用乳腺癌细胞系验证应激和PKC对NDRG1的调控机制;最后通过CRISPR/Cas9敲除NDRG1,阐明其促进细胞侵袭的分子通路。
3.1 临床样本中NDRG1的表达模式与预后分析
实验目的:明确NDRG1在乳腺癌组织中的表达分布、亚型差异及预后价值。
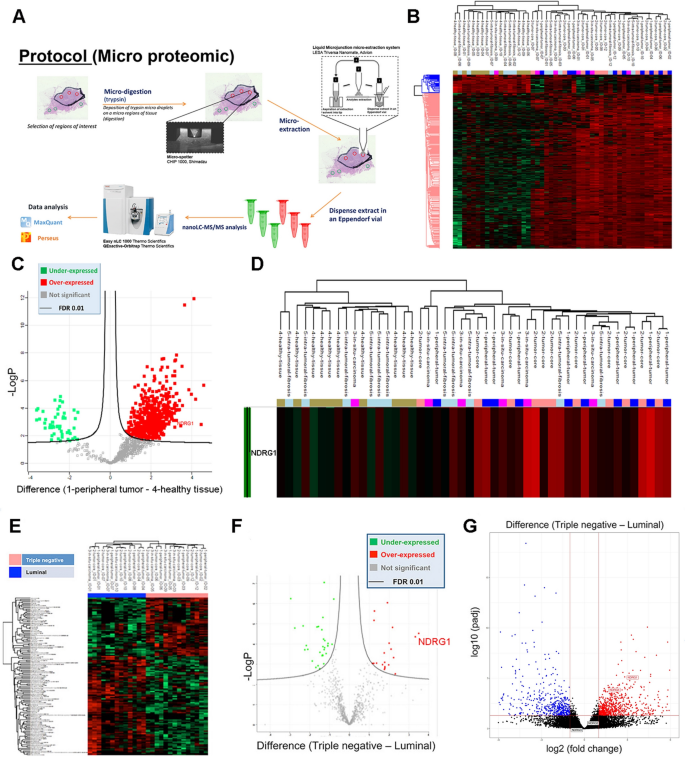
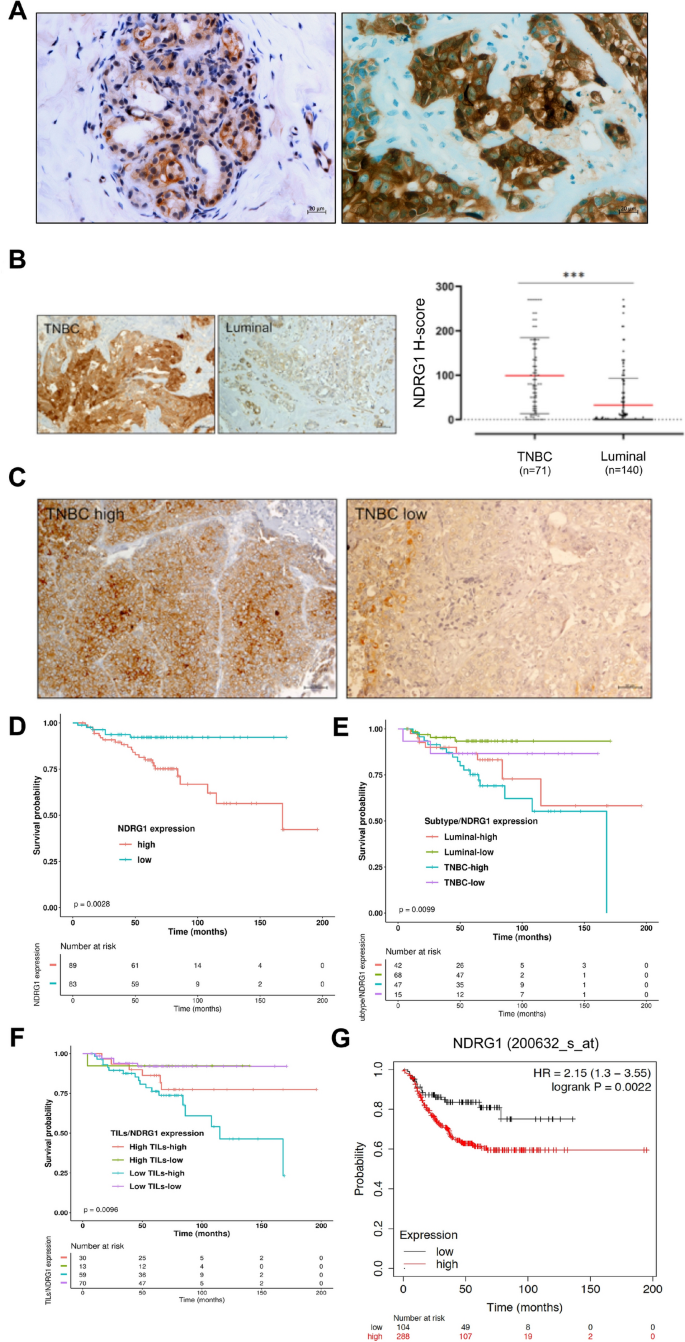
方法细节:收集12例乳腺癌患者的新鲜福尔马林固定石蜡包埋(FFPE)组织(6例TNBC,6例Luminal),采用空间微蛋白质组学技术(胰蛋白酶微消化、液相色谱-串联质谱(LC-MS/MS))分析蛋白表达;对211例回顾性乳腺癌样本(71例TNBC,140例Luminal)进行免疫组化(IHC),检测NDRG1的表达水平及亚细胞定位;利用癌症基因组图谱(TCGA)数据库分析NDRG1的mRNA表达与预后的关联。
结果解读:空间蛋白质组学显示,NDRG1在肿瘤组织(尤其是肿瘤核心、外周区域)中的表达显著高于正常组织(图1C、D);TNBC样本中NDRG1的蛋白表达量是Luminal样本的10倍(p=4.35E-05,图1F),RNA测序(RNA-seq)验证了这一结果(log₂折叠变化=3.36,假发现率(FDR)=1.25E-08,图1G)。IHC结果显示,63.5%(134/211)的乳腺癌患者NDRG1阳性,主要定位于细胞质(44%)和细胞膜(29%),核定位仅见于高表达样本(3+)。生存分析表明,NDRG1高表达患者的无病生存期(DFS)显著缩短(风险比(HR)=2.59,95%置信区间(CI)1.20-5.59,p=0.016,图3D),且是独立预后因素(多因素Cox分析HR=0.45,p=0.05)。
产品关联:IHC实验使用Ventana BenchMark XT自动化染色仪;空间蛋白质组学采用Thermo Scientific的Acclaim PepMap色谱柱和Q-Exactive Orbitrap质谱仪;TCGA数据来自UCSC Xena数据库。
3.2 细胞模型中NDRG1的表达调控机制研究
实验目的:验证外界应激和PKC对NDRG1表达的影响。
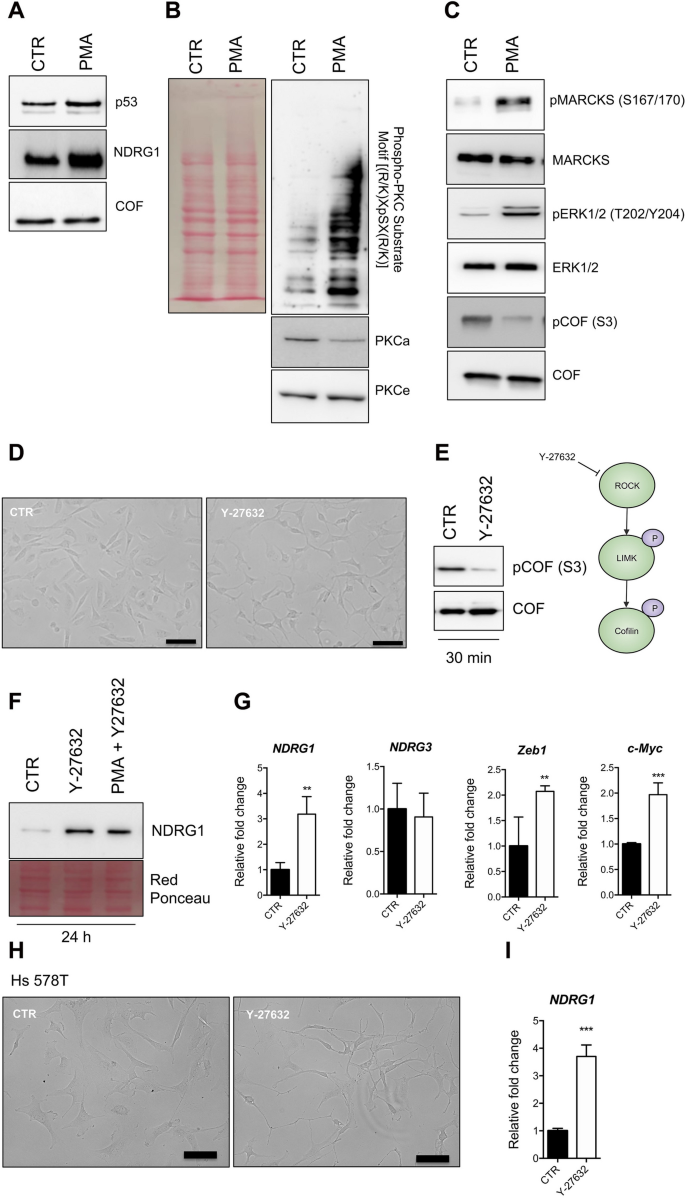
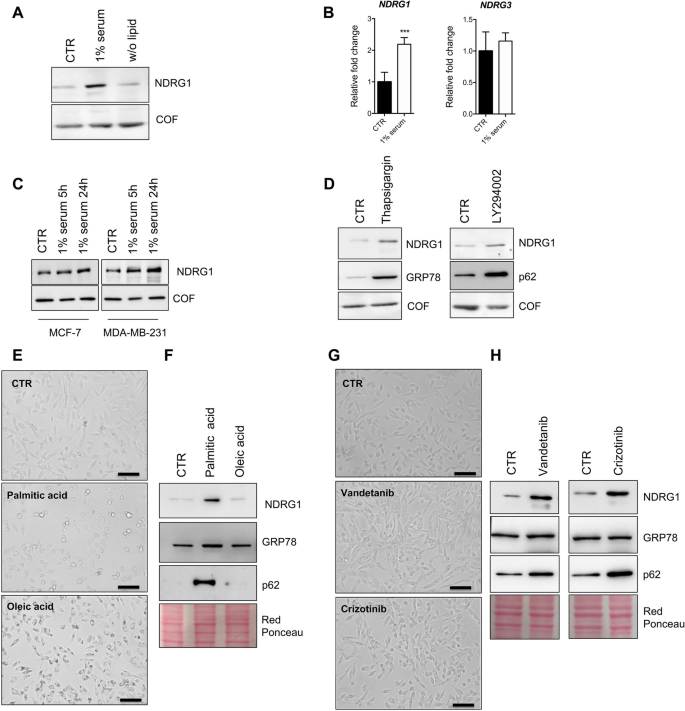
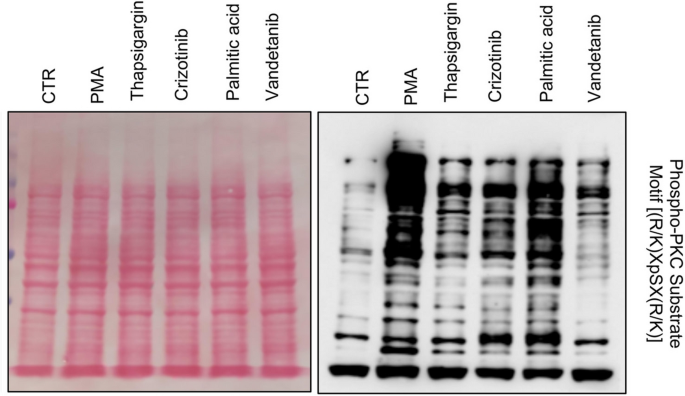
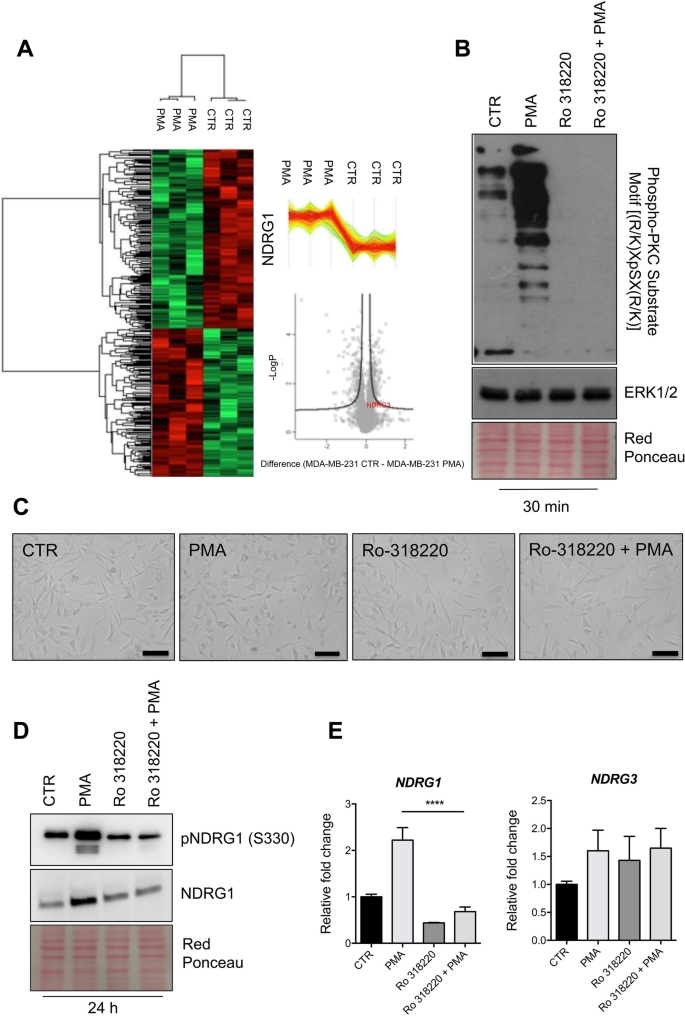
方法细节:选取乳腺癌细胞系MDA-MB-231(TNBC)和MCF-7(Luminal),分别处理血清剥夺(1%血清,24小时)、内质网应激(毒胡萝卜素,1μM,24小时)、自噬抑制(LY2949002,10μM,24小时)、PKC激活剂(佛波醇-12-肉豆蔻酸-13-乙酸酯(PMA),100nM,24小时)及抑制剂(Ro-318220,1μM,24小时)。通过蛋白质免疫印迹(Western blot)检测NDRG1、磷酸化NDRG1(S330)及PKC底物的表达,实时荧光定量PCR(qPCR)检测NDRG1的mRNA水平。
结果解读:血清剥夺、毒胡萝卜素和LY2949002处理均显著上调MDA-MB-231细胞中NDRG1的蛋白表达(图4A、D),且这种上调在5小时内即可检测到(图4C)。PMA处理后,MDA-MB-231和MCF-7细胞的NDRG1蛋白及mRNA水平均显著升高(图7D、E),而Ro-318220可阻断PMA的作用(图7B、D)。此外,PMA处理还增加了PKC底物的磷酸化水平(图6),提示PKC激活直接调控NDRG1的表达。
产品关联:Western blot使用了Cell Signaling的RIPA裂解液、Bio-RAD的Bradford定量试剂盒;qPCR使用Thermo的逆转录试剂盒;PKC激活剂PMA和抑制剂Ro-318220购自Sigma。
3.3 CRISPR/Cas9介导NDRG1敲除的功能验证
实验目的:明确NDRG1对乳腺癌细胞侵袭的影响及分子机制。
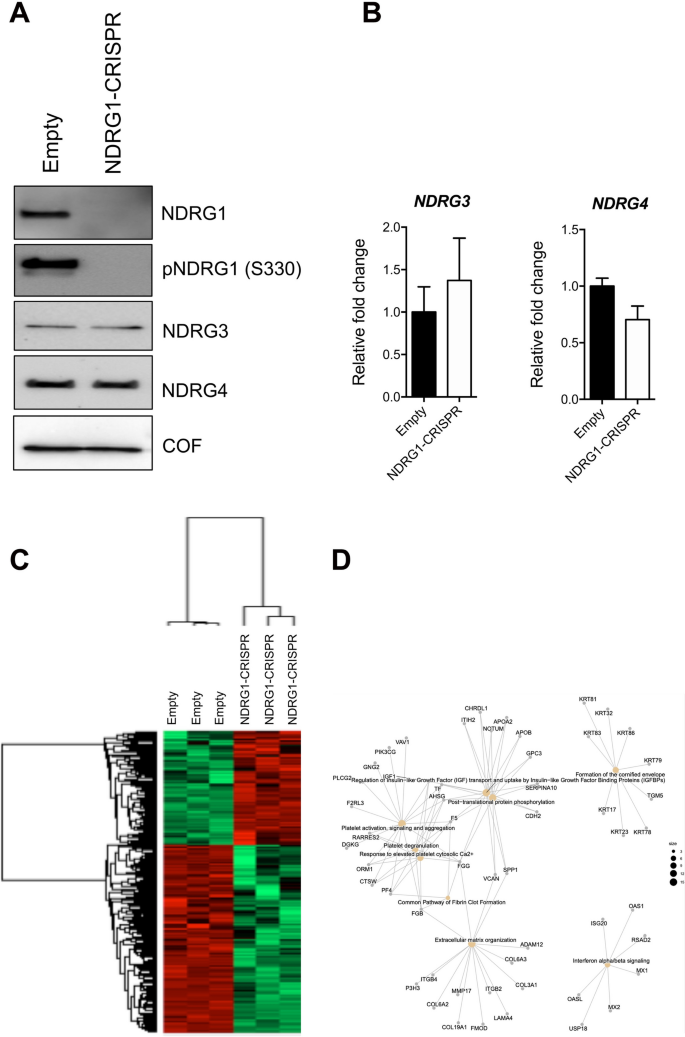
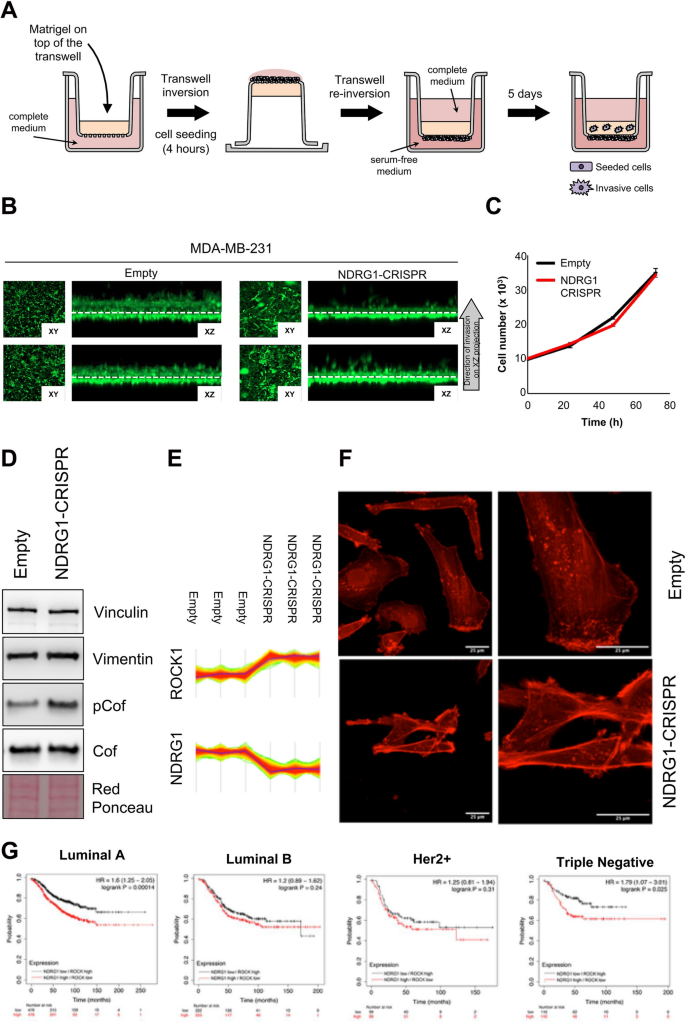
方法细节:设计针对NDRG1的单向导RNA(sgRNA,#2:5′-GCAGGATGTAGACCTCGCTG-3′),克隆到LentiCRISPRv2质粒(Addgene #52961),包装慢病毒感染MDA-MB-231细胞,嘌呤霉素(3μg/mL)筛选获得稳定敲除株(NDRG1-CRISPR)。通过Western blot验证敲除效率,然后进行以下实验:1)LC-MS/MS和RNA-seq分析差异表达基因;2)倒置Matrigel侵袭实验检测细胞侵袭能力;3)鬼笔环肽染色观察肌动蛋白(actin)细胞骨架重组。
结果解读:Western blot显示NDRG1-CRISPR细胞中NDRG1蛋白几乎完全敲除(图9A)。Proteomics分析发现,敲除NDRG1后,与细胞外基质(ECM)组织(如整合素β4(ITGB4)、ADAM金属肽酶结构域12(ADAM12))和actin骨架调控(如ROCK1)相关的基因表达显著改变(图9D)。RNA-seq结果显示,NDRG1-CRISPR细胞中ECM组织通路的基因显著下调(p=0.0004)。侵袭实验表明,NDRG1敲除后细胞侵袭能力下降约50%(图10B),且细胞增殖无差异(图10C),提示侵袭能力的降低并非由于增殖抑制。鬼笔环肽染色显示,NDRG1-CRISPR细胞的actin纤维更密集,片足形成减少(图10F),同时ROCK1表达升高,cofilin磷酸化增加(图10D、E),提示NDRG1通过抑制ROCK/cofilin通路促进actin重组和细胞侵袭。
产品关联:CRISPR实验使用Addgene的LentiCRISPRv2、pVSVg(#8454)和psPAX2(#12260)质粒;慢病毒包装使用HEK293T细胞;侵袭实验使用Corning的Matrigel基质胶;鬼笔环肽染色使用Thermo的Alexa Fluor 488标记鬼笔环肽。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker是NDRG1,类型为细胞内蛋白(主要定位于细胞质和细胞膜)及mRNA。筛选逻辑遵循“数据库挖掘-临床样本验证-细胞模型确认”的链条:首先通过TCGA-BRCA数据库发现NDRG1 mRNA在TNBC中高表达;接着通过12例新鲜组织的proteomics和RNA-seq验证蛋白及mRNA水平的一致性;最后通过211例回顾性队列的IHC确认NDRG1的临床表达模式及预后价值。
研究过程详述
NDRG1的来源包括乳腺癌患者的新鲜肿瘤组织、FFPE样本及细胞系(MDA-MB-231、MCF-7)。验证方法包括:1)空间proteomics(Q-Exactive Orbitrap质谱)检测蛋白表达;2)RNA-seq(Illumina平台)检测mRNA水平;3)IHC(Ventana BenchMark XT)检测临床样本的蛋白定位;4)Western blot和qPCR验证细胞模型的表达调控。特异性方面,NDRG1在TNBC中的表达显著高于Luminal亚型(折叠变化=10,p=4.35E-05),且与ER、PR、Her2表达负相关(p<0.0001)。敏感性方面,IHC显示63.5%的乳腺癌患者NDRG1阳性,其中TNBC患者的阳性率(82%)显著高于Luminal患者(51%,p<0.0001)。
核心成果提炼
1)预后价值:NDRG1是TNBC的独立预后生物标志物,高表达患者的DFS显著缩短(HR=2.59,95% CI 1.20-5.59,p=0.016);联合检测NDRG1/ROCK比值可更精准预测预后(NDRG1高/ROCK低患者的DFS更短,图10G)。
2)调控机制:NDRG1的表达受PKC调控,PKC激活可上调NDRG1的mRNA及蛋白水平,进而抑制ROCK/cofilin通路(图8)。
3)功能意义:NDRG1通过促进actin重组增强乳腺癌细胞侵袭能力,敲除NDRG1后细胞侵袭能力下降约50%(图10B)。
本研究首次揭示NDRG1在TNBC中的促癌功能,其机制与PKC介导的应激响应有关,为TNBC的靶向治疗提供了新的潜在靶点。