1. 领域背景与文献引入
文献英文标题:Rapid and robust derivation of mesenchymal stem cells from human pluripotent stem cells via temporal induction of neuralized ectoderm;发表期刊:Cell & Bioscience;影响因子:5.168(2022年);研究领域:干细胞生物学、再生医学、间充质干细胞诱导。
间充质干细胞(MSCs)是一类具有成纤维细胞形态、三系分化能力(成骨、成脂、成软骨)和低免疫原性的多能祖细胞,自1968年从骨髓分离以来,因强大的再生能力和免疫调节特性,已被应用于缺血性心脏病、神经退行性疾病等2000余项临床试验。然而,原发性MSCs(如骨髓来源)存在数量有限、体外增殖能力弱、长期培养后功能改变等缺陷,难以满足临床大规模应用需求。人多能干细胞(包括胚胎干细胞ESCs和诱导多能干细胞iPSCs)因无限增殖能力和多向分化潜能,成为MSCs的理想来源,但现有诱导方法仍存在瓶颈:传统胚胎体法耗时且效率低;直接诱导法对iPSC分化效率差;神经嵴细胞介导法需长期培养(约20天)或流式分选,限制了大规模生产。因此,开发快速、高效、无需分选的MSCs诱导方法,是多能干细胞来源MSCs走向临床的关键。
本研究旨在建立一种通过短暂诱导神经外胚层、快速生成MSCs的方法,解决现有技术的效率与规模化问题,并通过Hutchinson-Gilford早老综合征(HGPS)患者iPSC模型验证其疾病建模价值,为再生医学提供高效的MSCs来源。
2. 文献综述解析
现有MSCs诱导方法主要分为三类:1. 胚胎体介导法:将多能干细胞形成胚胎体(EB)后分化为MSCs,但耗时(约4周)且效率低;2. 直接诱导法:如添加PDGF-AB和bFGF直接诱导ESCs分化,但对iPSC效率差(<30%);3. 神经嵴细胞介导法:通过TGF-β抑制和WNT激活诱导多能干细胞为神经嵴细胞(NCCs),再分化为MSCs,但需分选NCCs或长期培养(约20天),不适合大规模生产。现有方法的核心局限性在于“耗时”或“需分选”,难以平衡效率与规模化需求。
本研究的创新点在于:通过“短暂神经外胚层诱导(5-7天)+ MSCs直接分化(4天)”的两步法,无需分选,快速得到高纯度MSCs;且该方法适用于ESCs和iPSCs,诱导的MSCs转录组与原发性骨髓MSCs相似度高达90%以上,解决了现有方法的效率与规模化问题。
3. 研究思路总结与详细解析
本研究采用“多能干细胞生成→神经外胚层诱导→MSCs分化→疾病模型验证”的闭环思路,分五部分展开:
3.1 无整合人iPSC的生成与多能性验证
实验目的:构建临床兼容的无整合iPSC,避免病毒整合的致癌风险。
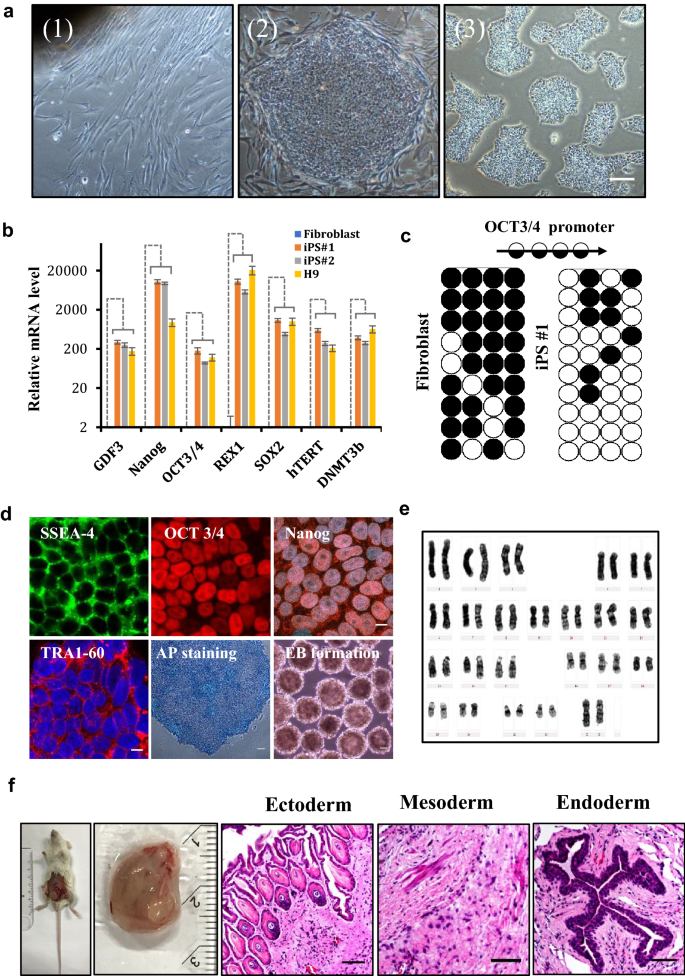
方法细节:采用无整合的minicircle载体(携带Yamanaka因子Oct4、Sox2、Klf4、c-Myc),通过核转染法将健康人真皮成纤维细胞重编程为iPSC;通过qPCR检测多能性基因(OCT3/4、NANOG、SOX2)表达,免疫染色验证SSEA4、TRA1-60等表面标记,畸胎瘤形成实验验证三胚层分化能力,核型分析验证基因组完整性。
结果解读:重编程得到的iPSC表达OCT3/4、NANOG等多能性基因,水平与H9 ESCs相当;免疫染色显示SSEA4、TRA1-60阳性;畸胎瘤切片显示内胚层肠上皮、中胚层软骨、外胚层神经组织等三胚层结构;核型分析为正常46,XX。证明iPSC无整合且具有完整多能性。
实验所用关键产品:无整合minicircle载体(Addgene #63726)、核转染试剂盒(Lonza, Cat. No. VPD-1001)。
3.2 神经外胚层的短暂诱导与鉴定
实验目的:将多能干细胞诱导为具有MSCs分化潜能的神经外胚层。
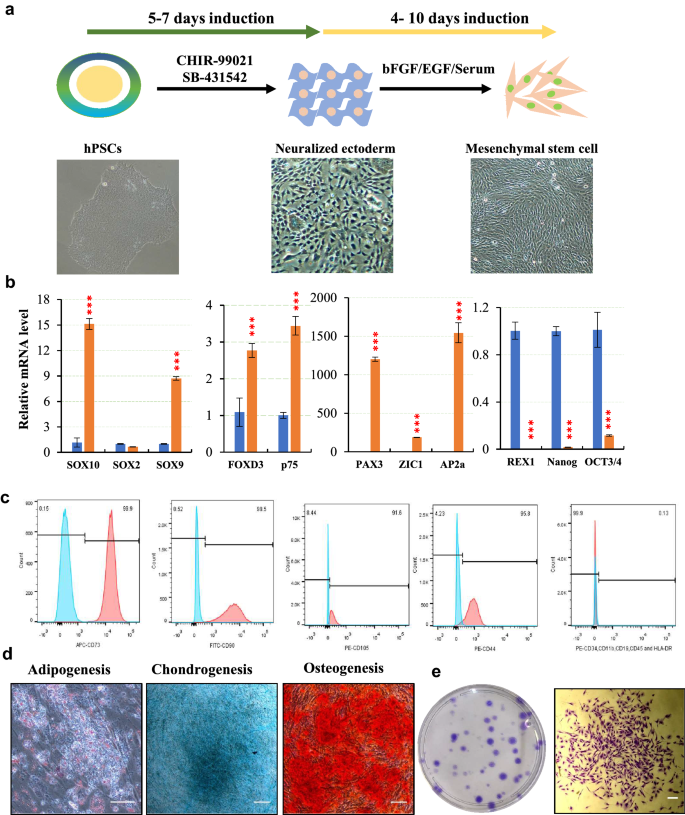
方法细节:将iPSC/ESCs置于含10μM SB431542(TGF-β抑制剂)、3μM ChIR99021(WNT激活剂)的神经外胚层培养基(48.5% Neurobasal + 48.5% DMEM/F12 + 1% N2 + 2% B27)中培养5-7天;通过qPCR检测多能性基因(OCT3/4、NANOG)和神经外胚层基因(PAX3、ZIC1、SOX10)表达,免疫染色验证NESTIN(神经祖细胞标记)和PAX7(神经外胚层标记),流式检测p75(神经外胚层标记)阳性率。
结果解读:诱导后多能性基因OCT3/4、NANOG显著下降(P<0.001),神经外胚层基因PAX3、ZIC1、SOX10上调10-100倍;免疫染色显示NESTIN和PAX7阳性,p75阳性率达99%;神经外胚层细胞能在悬浮培养中形成神经球,并分化为脂肪、软骨、骨细胞(对应染色阳性)。证明短暂诱导得到的神经外胚层具有MSCs分化潜能。
实验所用关键产品:SB431542(Sigma)、ChIR99021(Sigma)。
3.3 间充质干细胞的诱导与特性分析
实验目的:从神经外胚层快速分化为符合国际标准的MSCs。
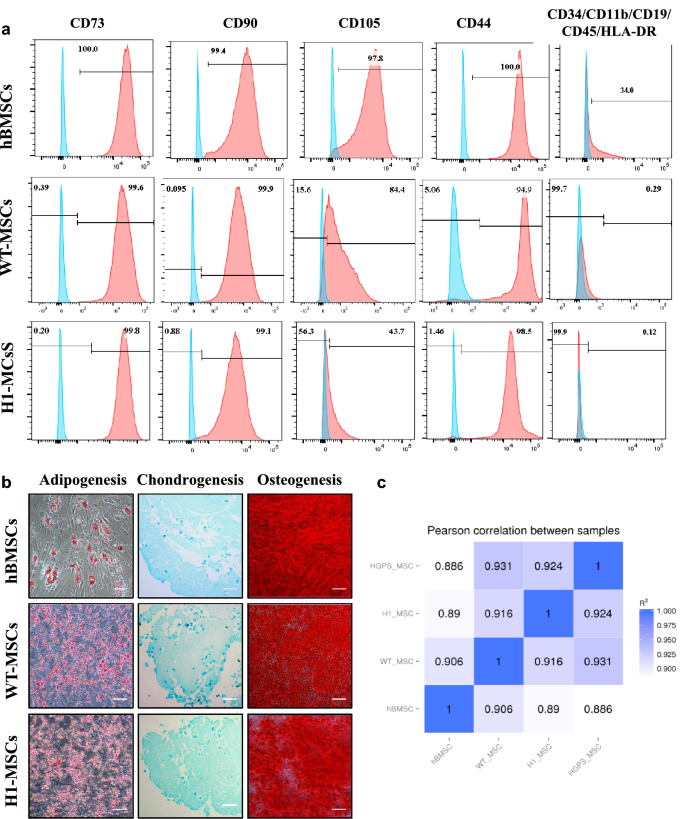
方法细节:将神经外胚层细胞换为含10%人脐带血清、2ng/ml bFGF和2ng/ml EGF的MSCs培养基,培养4天后观察形态,3代后通过流式检测MSCs表面标记(CD73、CD90、CD105、CD44阳性,CD11b、CD34、CD45阴性),三系分化实验验证成骨(Alizarin Red S染色)、成脂(Oil Red O染色)、成软骨(Alcian Blue染色)能力,RNA-seq比较与骨髓MSCs的转录组相似度。
结果解读:换培养基后4天出现成纤维细胞样形态,3代后细胞均一;流式显示CD73(99.9%)、CD90(99.5%)、CD105(91.6%)、CD44(95.8%)阳性,造血标记阴性(<1%);三系分化染色均阳性;转录组与骨髓MSCs相似度达90.6%(iPSC来源)和89.0%(ESC来源)。证明诱导的MSCs符合国际标准且与原发性MSCs高度相似。
实验所用关键产品:人脐带血清(自制)、bFGF(PeproTech)、EGF(PeproTech)。
3.4 HGPS患者iPSC的生成与疾病模型建立
实验目的:用HGPS患者iPSC诱导MSCs,建立早老综合征细胞模型。
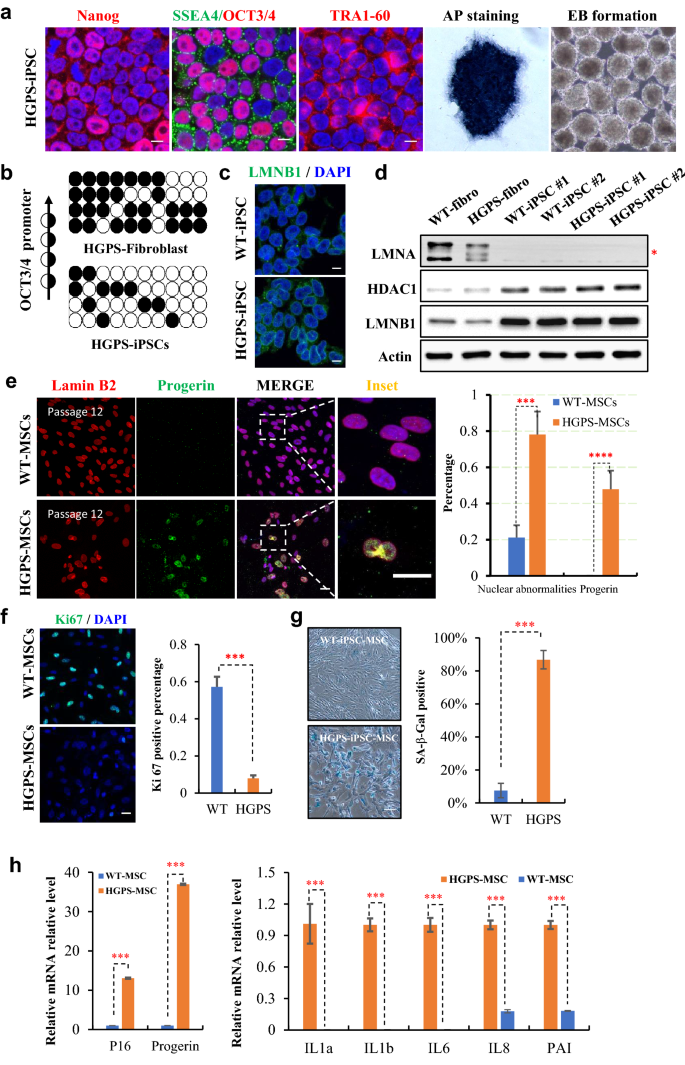
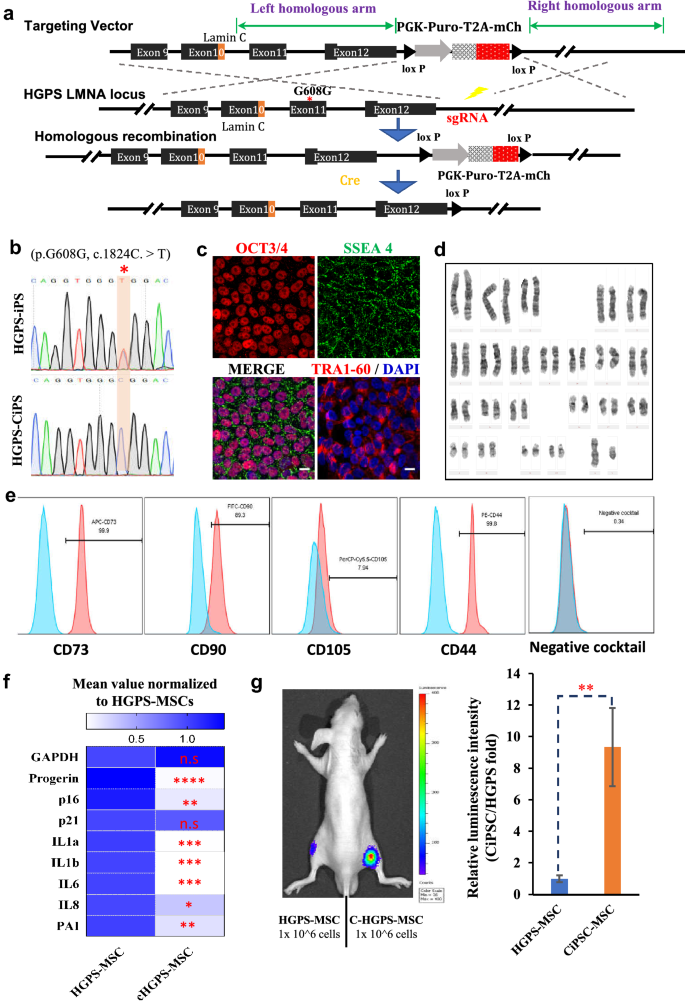
方法细节:收集HGPS患者(携带LMNA基因c.1824C>T突变,导致progerin表达)真皮成纤维细胞,用minicircle载体重编程为iPSC;诱导为MSCs后,通过免疫染色检测progerin表达,核型分析观察核形态,Ki67免疫染色检测增殖,SA-β-gal染色检测衰老,qPCR检测p16、p21及SASP因子(IL1a、IL1b、IL6)表达。
结果解读:HGPS-iPSC表达多能性标记,诱导的HGPS-MSCs中47.8%表达progerin,78.1%出现核畸形(野生型仅21.1%);Ki67阳性率(7.9%)显著低于野生型(57.3%,P<0.001);SA-β-gal阳性率(86.7%)显著高于野生型(7.5%,P<0.001);p16上调2倍(P<0.01),SASP因子上调3-5倍(P<0.001)。证明HGPS-MSCs recapitulated早老表型。
实验所用关键产品:HGPS患者成纤维细胞(临床样本)、progerin抗体(Abcam)。
3.5 HGPS突变纠正后的MSCs功能恢复
实验目的:验证LMNA突变纠正对HGPS-MSCs衰老表型的恢复作用。
方法细节:用CRISPR/Cas9系统(sgRNA靶向LMNA基因非编码区)纠正HGPS-iPSC的c.1824C>T突变,得到纠正后iPSC(HGPS-CiPSC);诱导为MSCs后,通过Sanger测序验证突变纠正,免疫染色检测progerin,qPCR检测p16、SASP因子,体内生物发光实验(标记luciferase)比较纠正前后MSCs的存活时间。
结果解读:Sanger测序显示突变纠正(仅C峰);纠正后的MSCs progerin表达消失,核形态正常;p16、SASP因子表达下降至野生型水平;体内生物发光显示纠正后的MSCs存活时间显著延长(P<0.01)。证明突变纠正可恢复HGPS-MSCs的衰老表型。
实验所用关键产品:CRISPR/Cas9载体(Addgene)、luciferase慢病毒(自制)。
4. Biomarker研究及发现成果解析
本研究涉及两类Biomarker:MSCs身份 Biomarker(验证细胞身份)和HGPS疾病 Biomarker(关联疾病表型)。
4.1 Biomarker 定位与筛选逻辑
- MSCs身份 Biomarker:基于国际细胞治疗协会(ISCT)标准,筛选CD73+CD90+CD105+CD44-造血标记(CD11b/CD34/CD45)的组合,通过流式验证纯度。
- HGPS疾病 Biomarker:基于HGPS发病机制(LMNA突变→progerin表达→衰老),筛选progerin(特异性标记)、p16(衰老调控因子)、SASP因子(衰老相关分泌表型)的组合,通过免疫染色和qPCR验证。
4.2 研究过程与结果
- MSCs身份 Biomarker:来源为诱导的MSCs,验证方法为流式细胞术;结果显示>90%细胞表达阳性标记,阴性标记<1%,符合ISCT标准(敏感性>90%,特异性>99%)。
- HGPS疾病 Biomarker:progerin来源于LMNA突变,通过免疫染色验证(HGPS-MSCs中47.8%阳性);p16和SASP因子为衰老表型标记,通过qPCR验证(HGPS-MSCs中p16上调2倍,SASP因子上调3-5倍,P<0.01)。
4.3 核心成果
- MSCs身份标准化 Biomarker:建立了“CD73+CD90+CD105+CD44-造血标记”的组合,可快速鉴定多能干细胞来源MSCs的身份。
- HGPS疾病特异性 Biomarker:progerin是HGPS-MSCs的特异性标记(仅突变细胞表达),p16和SASP因子是功能性标记(关联衰老表型);突变纠正后,这些Biomarker恢复至野生型水平,证明其与疾病表型的因果关系。
结论
本研究通过短暂神经外胚层诱导,建立了快速、高效的MSCs诱导方法(总耗时约2-3周),解决了现有技术的效率与规模化问题;诱导的MSCs符合国际标准,与原发性骨髓MSCs高度相似。同时,通过HGPS患者iPSC模型,验证了该方法的疾病建模价值,为HGPS等早老综合征的研究提供了可靠的细胞模型。本研究为再生医学提供了高效、标准化的MSCs来源,推动了多能干细胞技术向临床转化。
