1. 领域背景与文献引入
文献英文标题:CXCL11 reprograms M2-biased macrophage polarization to alleviate pulmonary fibrosis in mice;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:肺纤维化与巨噬细胞极化调控。
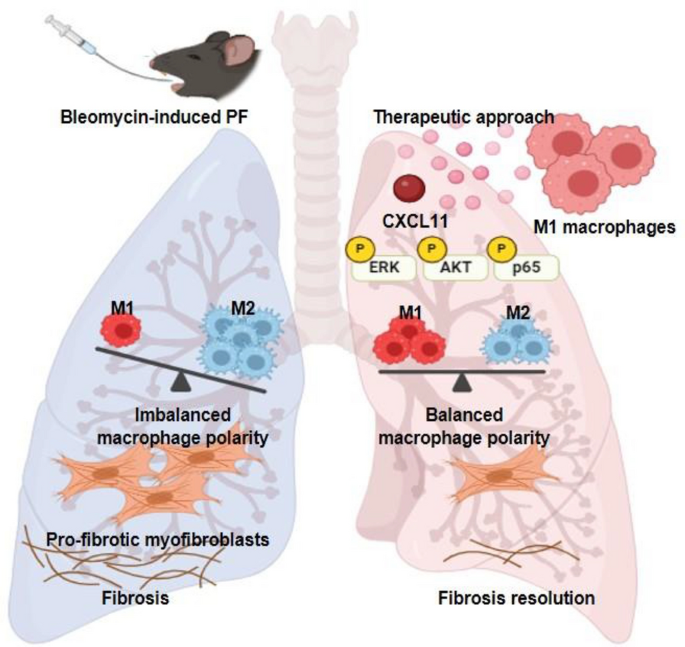
肺纤维化是一种以肺组织进行性瘢痕化为特征的慢性致死性疾病,其核心病理机制涉及免疫细胞与基质细胞的异常交互——巨噬细胞作为肺内最丰富的免疫细胞,其表型可塑性(M1促炎/抗纤维化、M2抗炎/促纤维化转换)是疾病进展的关键驱动因素。现有研究证实,M2巨噬细胞的异常积累会通过分泌转化生长因子β1(TGF-β1)、白细胞介素-10(IL-10)等因子促进胶原沉积,而M1巨噬细胞的减少则导致损伤组织清除障碍。然而,当前肺纤维化治疗仍面临两大瓶颈:一是缺乏针对M2巨噬细胞的特异性靶向疗法,二是M1巨噬细胞分泌因子的抗纤维化机制尚未完全阐明。在此背景下,本研究聚焦于M1巨噬细胞的分泌组,旨在揭示其对M2巨噬细胞的重编程作用及关键效应分子,为肺纤维化的精准治疗提供新靶点。
2. 文献综述解析
作者围绕“巨噬细胞极化平衡与肺纤维化”“趋化因子对巨噬细胞极化的调控”两大逻辑展开综述。现有研究的核心结论包括:(1)巨噬细胞表型动态变化直接影响肺纤维化进程——炎症早期M1巨噬细胞主导促炎反应,纤维化期M2巨噬细胞占优并驱动瘢痕形成;(2)趋化因子家族对巨噬细胞极化具有双向调控作用:CCL1、CCL2等通过结合CCR8、CCR2受体促进M2极化,加重纤维化;而C-X-C趋化因子受体3(CXCR3)及其配体CXCL9、CXCL11则通过抑制上皮间质转化、血管重构发挥抗纤维化作用。现有研究的局限性在于:缺乏针对M2巨噬细胞重编程的临床适用策略,且M1分泌因子的具体功能机制不明确。本研究的创新价值在于:首次证实M1巨噬细胞分泌的CXCL11可通过激活pERK、pAKT、p65信号通路,将M2偏向性巨噬细胞重编程为M1表型,恢复肺内免疫平衡并缓解纤维化,为肺纤维化的靶向治疗提供了新的分子靶点。
3. 研究思路总结与详细解析
本研究采用“体内模型验证疗效→分泌组筛选关键因子→体外实验解析机制→体内验证因子功能”的闭环路线,核心目标是明确CXCL11通过调控巨噬细胞极化缓解肺纤维化的作用及机制。
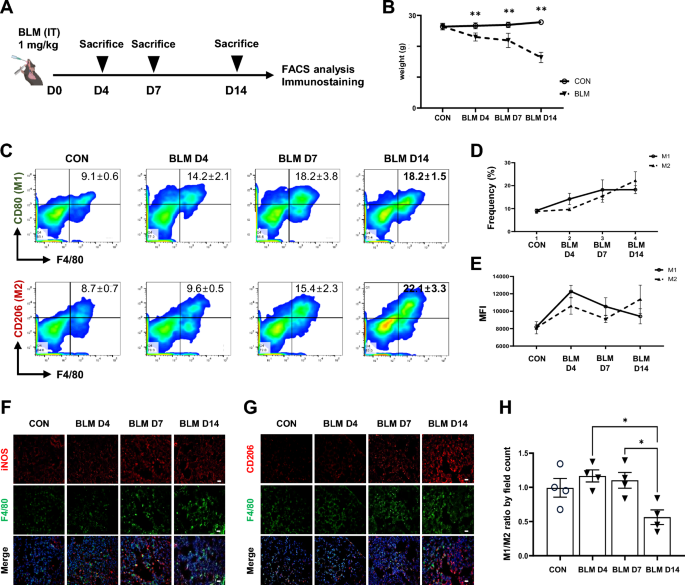
3.1 BLM诱导肺纤维化模型中巨噬细胞极化动力学分析
实验目的是明确肺纤维化进程中巨噬细胞表型的动态变化。方法细节:通过气管内注射博来霉素(BLM)诱导C57BL/6J小鼠肺纤维化,分别在造模后第4、7、14天收集肺组织,采用流式细胞术(检测F4/80+CD80+(M1)、F4/80+CD206+(M2)细胞比例)、免疫染色(检测iNOS(M1)、CD206(M2)表达)及平均荧光强度(MFI)分析巨噬细胞极化状态。结果解读:炎症期(第7天)M1巨噬细胞比例(14.2±2.1%)高于M2(9.6±0.5%),纤维化期(第14天)M2比例(22.4±3.3%)反超M1(18.2±1.5%),提示肺纤维化进程中巨噬细胞从M1向M2表型转换。产品关联:文献未提及具体流式抗体品牌,领域常规使用BioLegend或eBioscience的F4/80、CD80、CD206抗体。
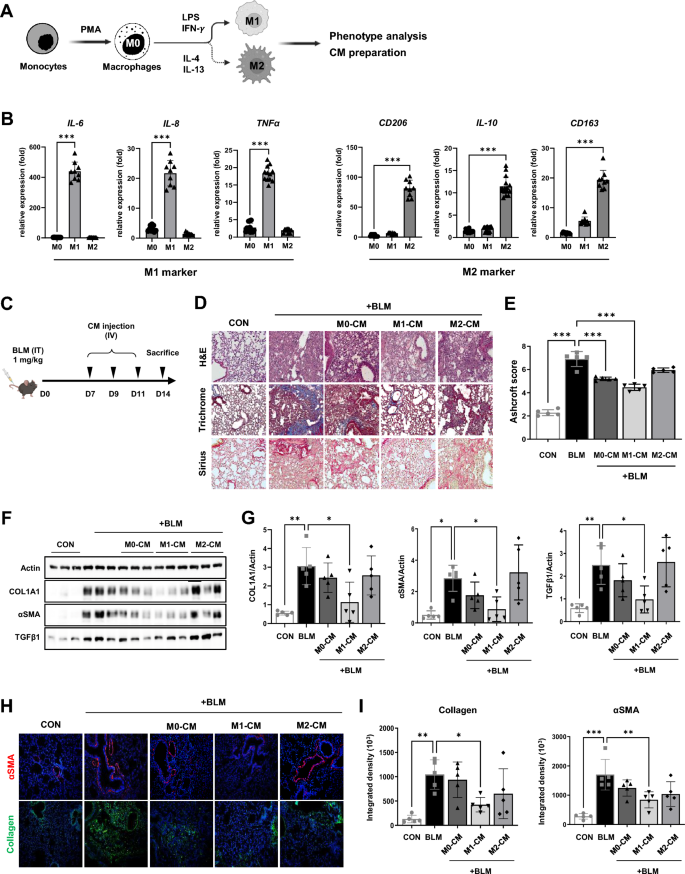
3.2 M1巨噬细胞条件培养基的体内抗纤维化作用验证
实验目的是评估M1分泌因子对肺纤维化的缓解效果。方法细节:将人单核细胞系诱导为M0(静息态)、M1(LPS+IFN-γ刺激)、M2(IL-4+IL-13刺激)巨噬细胞,收集各型细胞的无血清条件培养基(CM),并在BLM造模后第7、9、11天静脉注射给小鼠(50μg/kg),造模后第14天通过HE染色(肺损伤)、Masson三色染色(胶原沉积)、Ashcroft评分(纤维化程度)及Western blot(COL1A1、αSMA、TGF-β1蛋白)分析纤维化指标。结果解读:BLM组小鼠肺组织出现肺泡间隔增厚、单核细胞浸润及大量胶原沉积,而M1-CM处理组上述损伤显著减轻——Ashcroft评分较BLM组降低(P<0.05),COL1A1、αSMA、TGF-β1蛋白表达下调(P<0.01)。产品关联:条件培养基制备使用RPMI 1640培养基(Thermo)、3-kDa超滤膜(MilliporeSigma);纤维化抗体领域常规使用Cell Signaling或Abcam产品。
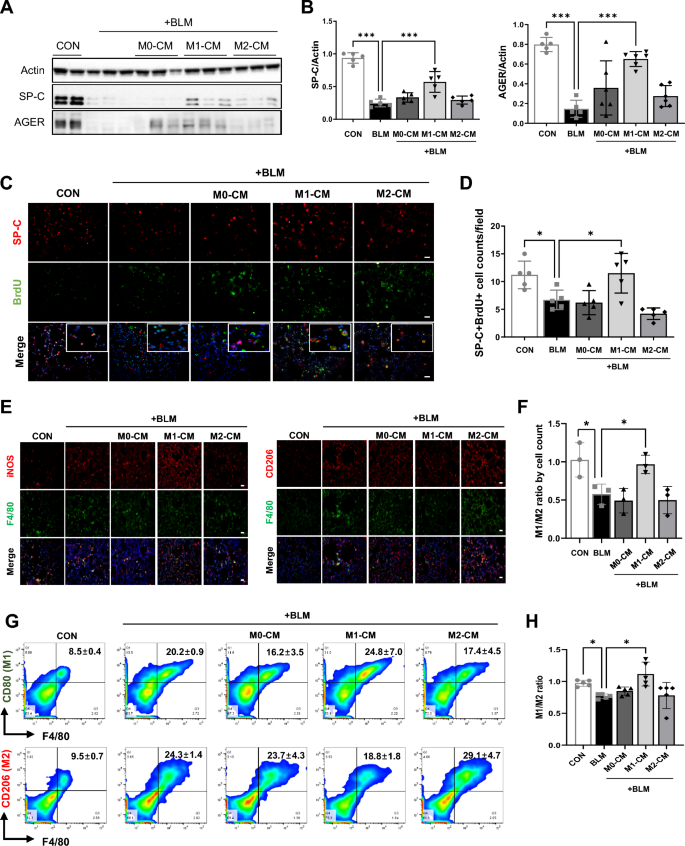
3.3 M1-CM对肺泡上皮细胞再生及巨噬细胞极化的影响
实验目的是探讨M1-CM的抗纤维化机制。方法细节:通过Western blot检测肺泡上皮细胞(AEC)标志物SP-C(II型)、AGER(I型)的表达;通过BrdU标记结合免疫荧光,检测SP-C+II型AEC的增殖能力;通过免疫染色和流式细胞术分析M1/M2比例。结果解读:M1-CM处理组SP-C、AGER表达恢复至接近对照组水平,SP-C+BrdU+细胞比例较BLM组升高(P<0.05),且M1/M2比例恢复平衡(P<0.001)。产品关联:BrdU试剂盒(Sigma-Aldrich);AEC标志物抗体领域常规使用Abcam产品。
3.4 M1分泌组分析鉴定CXCL11
实验目的是筛选M1特异性分泌的关键因子。方法细节:使用Proteome Profiler Human XL细胞因子阵列,检测M0、M1、M2-CM中的细胞因子表达谱,通过Image Lab软件定量信号强度。结果解读:CXCL11是M1-CM中特异性高表达的趋化因子——其信号强度显著高于M0和M2-CM(P<0.01),提示CXCL11可能是M1的核心效应分子。产品关联:细胞因子阵列试剂盒(R&D SYSTEMS)。
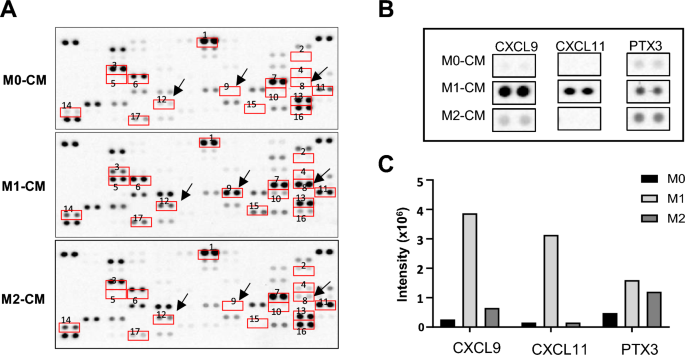
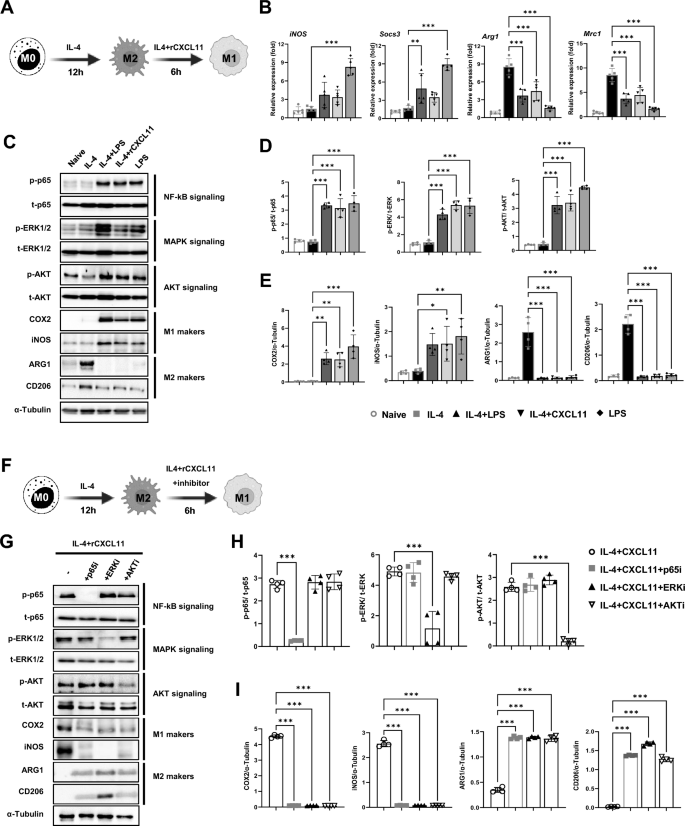
3.5 CXCL11重编程M2巨噬细胞的体外机制研究
实验目的是明确CXCL11的重编程作用及分子机制。方法细节:从小鼠骨髓分离骨髓来源巨噬细胞(BMDM),用M-CSF+IL-4诱导为M2表型,加入重组CXCL11(rCXCL11,100ng/ml)处理6小时;通过qRT-PCR检测M1(iNOS、Socs3)、M2(Arg1、Mrc1)标志物的mRNA表达,Western blot检测pERK、pAKT、p65及M1/M2蛋白标志物(COX2、iNOS、ARG1、CD206);预处理U0126(MEK1/2抑制剂)、Wortmannin(AKT抑制剂)或JSH-23(NF-κB抑制剂)验证通路必要性。结果解读:rCXCL11处理后,M1标志物表达升高、M2标志物降低(与LPS组一致),且激活pERK、pAKT、p65信号通路(磷酸化水平较IL-4组升高2-3倍,P<0.01);抑制这些通路后,重编程作用被阻断。产品关联:重组CXCL11(R&D SYSTEMS);抑制剂购自Cell Signaling、MedChemExpress。
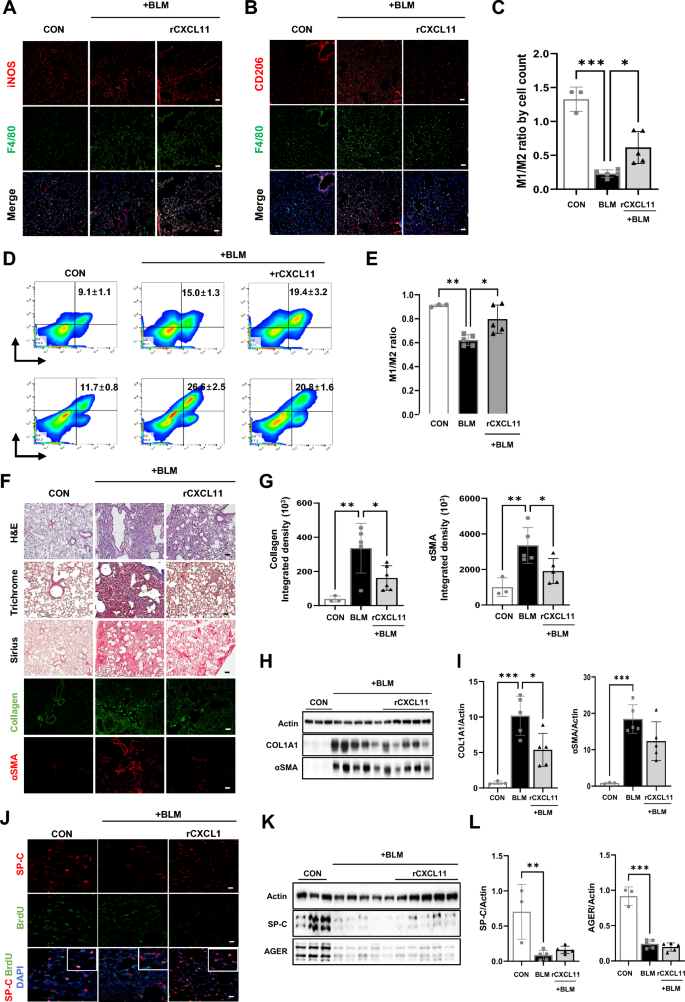
3.6 CXCL11体内抗纤维化作用验证
实验目的是验证CXCL11的体内功能。方法细节:BLM造模后第10、12、13、15天给小鼠静脉注射rCXCL11(2μg/只),造模后第17天通过免疫染色、流式细胞术分析M1/M2比例,组织染色、Western blot检测纤维化指标(COL1A1、αSMA)及AEC标志物(SP-C、AGER)。结果解读:rCXCL11处理显著恢复M1/M2比例(BLM组为0.8±0.1,CXCL11组为1.2±0.2,P<0.05),减轻肺损伤和胶原沉积(COL1A1、αSMA表达降低,P<0.01);但对AEC再生无显著作用。产品关联:重组CXCL11(R&D SYSTEMS)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的核心Biomarker为M1巨噬细胞分泌的趋化因子CXCL11,属于分泌型功能Biomarker。其筛选与验证逻辑为“细胞因子阵列筛选M1特异性因子→体外BMDM模型验证重编程作用→体内BLM模型验证抗纤维化效果”的三级体系。
研究过程详述
CXCL11来源于M1巨噬细胞的条件培养基,筛选方法为Proteome Profiler Human XL细胞因子阵列(信号强度量化);体外验证采用qRT-PCR(mRNA表达)、Western blot(蛋白与信号通路),结果显示CXCL11显著上调M1标志物、下调M2标志物;体内验证采用免疫染色、流式细胞术(巨噬细胞极化)及组织染色(纤维化指标),结果显示CXCL11恢复M1/M2比例(P<0.05),降低Ashcroft评分(BLM组5.2±0.5,CXCL11组3.1±0.4,P<0.01),减少胶原沉积(Sirius Red阳性面积减少30%,P<0.05)。
核心成果提炼
CXCL11作为M1巨噬细胞的特异性分泌因子,通过激活pERK、pAKT、p65信号通路,将M2偏向性巨噬细胞重编程为M1表型,从而缓解小鼠肺纤维化。其创新性在于首次揭示了CXCL11在肺纤维化中的免疫调控作用,为肺纤维化的靶向治疗提供了新的分子靶点。此外,CXCL11的体内抗纤维化效果明确,但对肺泡上皮细胞再生无显著作用,提示其主要通过调控巨噬细胞极化发挥疗效。