1. 领域背景与文献引入
文献英文标题:Hippocampal CA1 neuron, a crucial regulator for chronic stress exacerbating Alzheimer’s disease progression;发表期刊:Cell & Bioscience;影响因子:7.1;研究领域:阿尔茨海默病(AD)与慢性应激的神经机制。
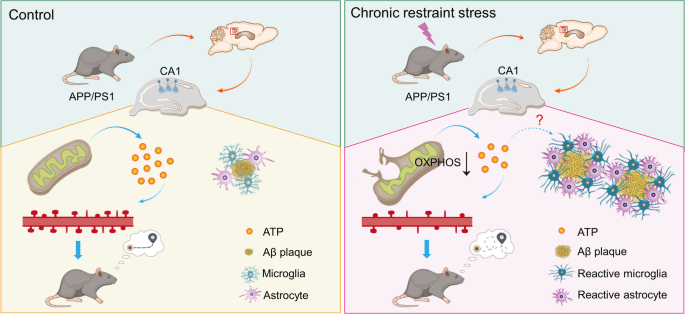
阿尔茨海默病是全球最常见的神经退行性疾病,以β-淀粉样蛋白(Aβ)斑块沉积、神经原纤维缠结形成和突触丢失为核心病理特征,临床表现为进行性记忆衰退和认知障碍。尽管已有乙酰胆碱酯酶抑制剂等药物用于缓解症状,但尚无疗法能阻遏疾病进展,其核心原因在于对AD病因和病理机制的理解仍不充分。慢性应激作为AD的重要风险因素,已被流行病学证实:长期暴露于应激的人群患AD风险升高2-3倍,且AD患者常先出现抑郁、焦虑等应激相关精神症状。现有研究聚焦于慢性应激通过激活下丘脑-垂体-肾上腺(HPA)轴、增加糖皮质激素分泌加重AD病理,但HPA轴抑制剂(如糖皮质激素受体拮抗剂)的临床试验效果有限,提示存在未被发现的非HPA轴机制。
海马作为调节情绪(抑郁、焦虑)和认知(空间记忆)的核心脑区,其萎缩、炎症反应和突触功能障碍是AD和慢性应激的共同病理特征。然而,现有研究未明确海马中具体哪种细胞类型(如CA1神经元、齿状回颗粒细胞)介导了应激对AD的影响,也未深入探讨能量代谢等细胞内机制。针对这一空白,本研究以慢性束缚应激(CRS)小鼠模型为基础,结合行为学、病理分析、单细胞核RNA测序(snRNA-seq)和功能拯救实验,揭示海马CA1神经元在慢性应激加重AD进展中的关键作用,并探讨ATP等能量代谢分子的潜在治疗价值。
2. 文献综述解析
文献综述围绕“AD病理与治疗困境→慢性应激与AD的关联及现有机制的局限→海马在应激和AD中的作用及细胞类型特异性机制的缺失”展开核心评述。作者首先总结AD的核心病理特征(Aβ斑块、神经原纤维缠结、突触丢失)及现有治疗的局限性(仅缓解症状,无法阻遏疾病进展);接着讨论慢性应激作为AD风险因素的流行病学证据,以及现有机制研究的焦点——HPA轴激活,但指出HPA轴抑制剂临床试验效果不佳,提示存在未被发现的非HPA轴机制;然后强调海马在情绪和认知中的关键作用,以及海马病理(如萎缩、炎症)在AD和慢性应激中的共同表现,但现有研究未明确海马中具体哪种细胞类型介导了应激对AD的影响,也未深入探讨能量代谢等细胞内过程。
现有研究的关键结论包括:①慢性应激通过HPA轴激活增加糖皮质激素分泌,进而加重AD病理;②海马参与应激反应和AD病理,但细胞类型特异性机制不明;③突触丢失是AD认知障碍的核心原因,但应激如何影响AD小鼠的突触结构仍不清楚。现有研究的局限性主要有两点:一是缺乏对海马特定细胞类型(尤其是CA1神经元)的深入研究,无法解析应激对AD影响的细胞特异性机制;二是对能量代谢等细胞内过程关注不足,未探讨ATP等分子在应激与AD交互中的作用。
本研究的创新价值在于:①首次揭示海马CA1神经元通过氧化磷酸化(OXPHOS)通路和ATP水平调控CRS诱导的AD病理;②首次证实补充ATP可逆转CRS诱导的AD病理(认知障碍、突触丢失、胶质激活),为AD治疗提供新靶点;③通过snRNA-seq解析了海马细胞类型的转录组变化,明确了CA1神经元在应激与AD交互中的关键地位。
3. 研究思路总结与详细解析
本研究的核心目标是探究海马CA1神经元在慢性应激加重AD进展中的作用及分子机制,核心科学问题包括:①CRS如何影响WT和APP/PS1小鼠的情绪与认知?②CRS通过何种海马细胞类型加重AD病理?③CA1神经元介导CRS影响AD的分子机制是什么?④补充ATP能否逆转CRS诱导的AD病理?技术路线遵循“模型建立→表型观察→机制解析→功能验证”闭环:CRS模型建立→行为学检测→病理分析→snRNA-seq揭示细胞类型变化→OXPHOS/ATP机制验证→ATP输注功能拯救。
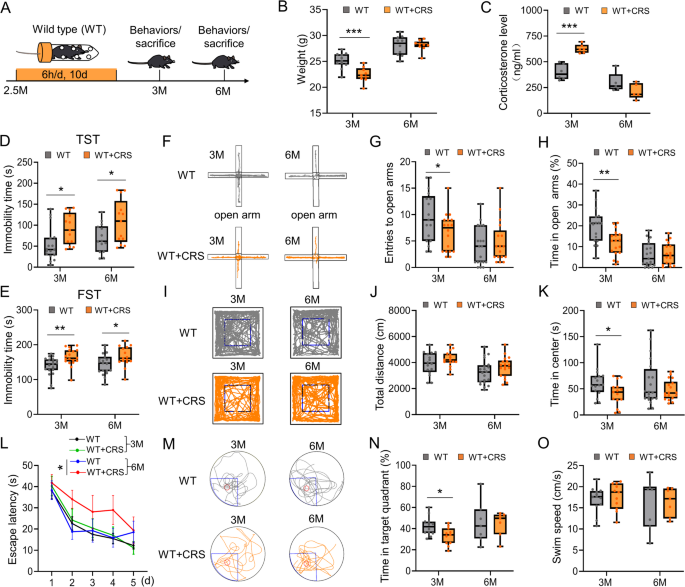
3.1 慢性束缚应激模型建立与行为学评估
实验目的:验证CRS对WT小鼠情绪和认知的长期影响,及对APP/PS1小鼠认知的加重作用。
方法细节:选取2.5月龄WT小鼠和2月龄APP/PS1小鼠(雄性),进行10天CRS(每天10:00-16:00束缚于50mL透气塑料管);对照组正常饲养。在3月龄(应激后0.5个月)和6月龄(应激后3.5个月)进行行为学检测:开放场试验(OFT)评估活动量与焦虑、高架十字迷宫试验(EPMT)评估焦虑、尾悬挂试验(TST)/强迫游泳试验(FST)评估抑郁、Morris水迷宫(MWM)评估空间学习与记忆。数据通过Smart 3.0跟踪软件(Panlab Harvard Apparatus)分析。
结果解读:①WT小鼠:CRS组3月龄体重降低(n=11 vs n=9,p<0.001)、皮质酮升高(n=6 vs n=6,p<0.001),TST/FST不动时间增加(TST:n=17 vs n=13,p<0.05;FST:n=19 vs n=18,p<0.05),且抑郁样行为持续至6月龄;MWM显示3月龄空间记忆受损(目标象限停留时间减少,n=12 vs n=11,p<0.05),6月龄空间学习受损(逃避潜伏期增加,n=7 vs n=7,p<0.05)。②APP/PS1小鼠:CRS组3月龄体重与皮质酮无差异,但MWM显示空间学习(逃避潜伏期增加,n=19 vs n=18,p<0.001)和记忆(目标象限停留时间减少,n=19 vs n=18,p<0.05)显著受损。
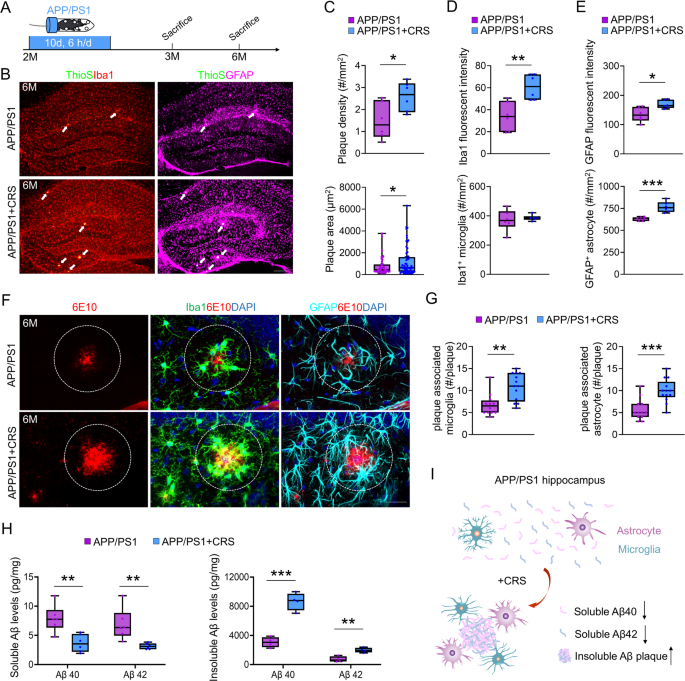
3.2 海马AD病理特征分析
实验目的:检测CRS对APP/PS1小鼠海马Aβ斑块、胶质激活和突触结构的影响。
方法细节:①Aβ斑块:ThioS染色标记,ImageJ定量数量与面积;②胶质激活:免疫组化染色GFAP(星形胶质细胞)、Iba1(小胶质细胞),定量荧光强度与细胞密度;③Aβ水平:ELISA检测可溶性/不可溶性Aβ40/42;④突触结构:电子显微镜观察CA1神经元突触后致密物(PSD)与突触前囊泡。
结果解读:①Aβ斑块:6月龄APP/PS1+CRS组ThioS+斑块数量(n=6 vs n=6,p<0.05)和面积(n=45 vs n=58,p<0.05)增加;②胶质激活:GFAP+细胞(荧光强度p<0.05、密度p<0.001)和Iba1+细胞(荧光强度p<0.01、密度p<0.01)显著激活;③Aβ水平:不可溶性Aβ40/42增加(n=4 vs n=4,p<0.001),可溶性Aβ40/42减少(n=6 vs n=6,p<0.01);④突触结构:CA1神经元PSD长度、厚度、面积减少(n=23 vs n=23,p<0.05/p<0.01),突触前囊泡无差异。
产品关联:免疫组化抗体用anti-GFAP(Dako Z0334)、anti-Iba1(abcam ab5076);ELISA试剂盒用DAB140B/DAB142(Aβ40/42)。
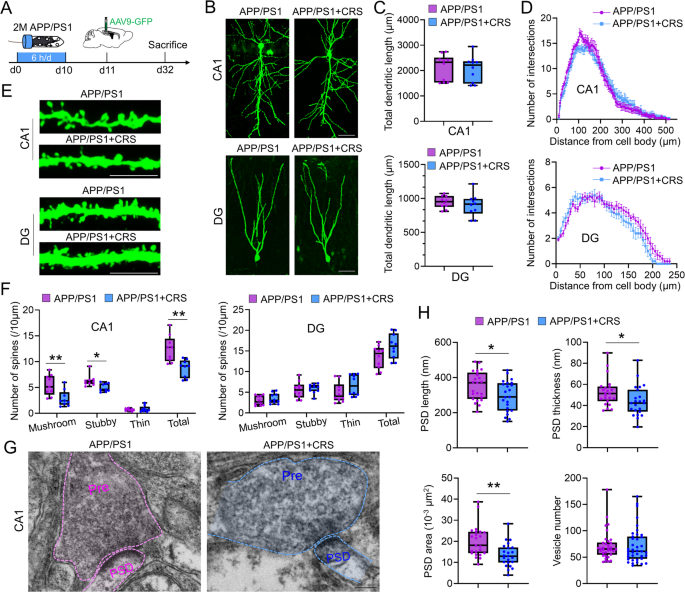
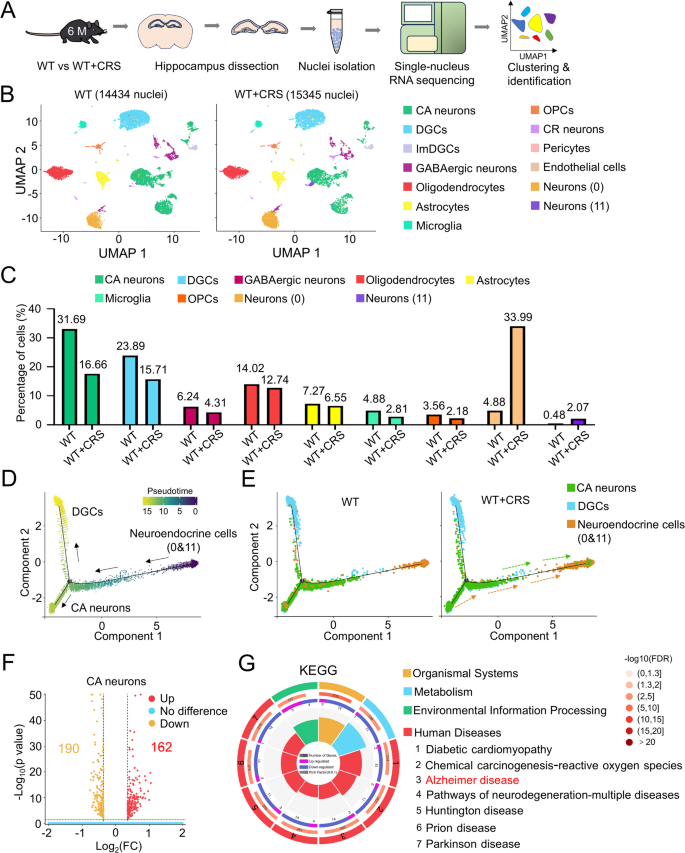
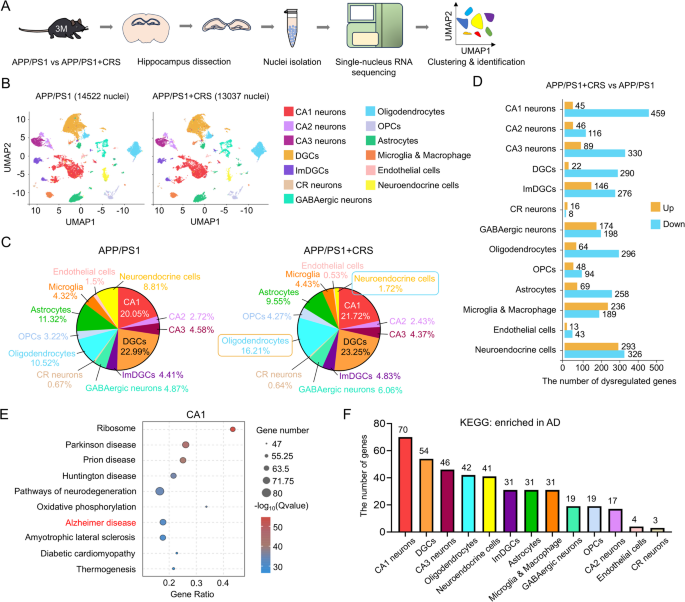
3.3 单细胞核RNA测序分析海马细胞类型
实验目的:解析CRS对海马细胞类型与转录组的影响。
方法细节:取6月龄WT/WT+CRS、3月龄APP/PS1/APP/PS1+CRS小鼠海马,制备单细胞核悬液(每样本混合2只海马);通过10× Chromium平台测序,Cell Ranger对齐基因组,Seurat进行质量控制(基因数440-4800、UMI<16000、线粒体基因<10%)、聚类(基于Zfp462/Prox1/Gad1标记CA神经元/齿状回颗粒细胞/γ-氨基丁酸能神经元);DESeq2鉴定差异基因,KEGG分析通路。
结果解读:①WT小鼠:CRS组CA神经元比例减少(~30%→~25%),神经内分泌细胞比例增加(~10%→~15%);CA神经元差异基因富集于AD通路。②APP/PS1小鼠:CRS组CA1神经元OXPHOS通路基因(mt-Co3、mt-Atp6)显著下调(p<0.001)。
产品关联:测序平台用10× Genomics;分析软件用Cell Ranger(v5.0.0)、Seurat(v4.0)。
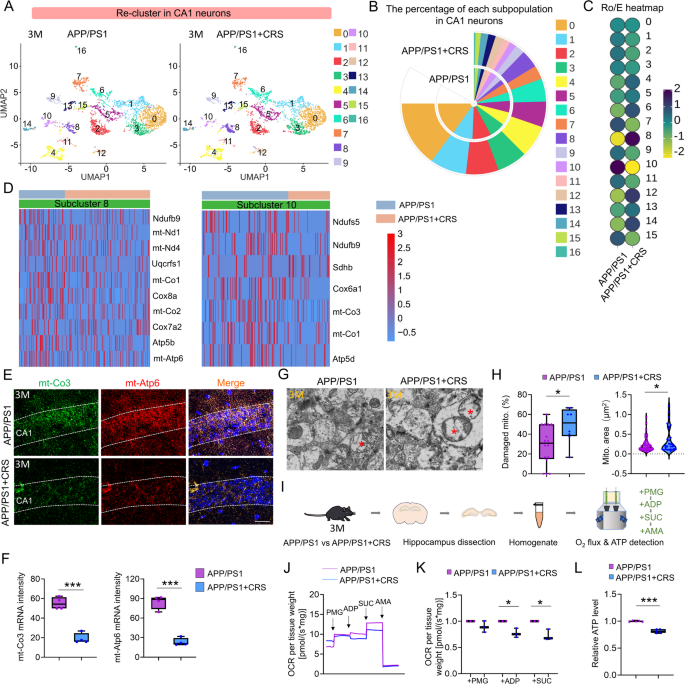
3.4 线粒体功能与ATP水平检测
实验目的:验证CRS对CA1神经元OXPHOS和ATP的影响。
方法细节:①RNA scope:取3月龄APP/PS1/APP/PS1+CRS小鼠脑切片,用RNAscope试剂盒(PN323110)和mt-Co3(复合物IV)、mt-Atp6(复合物V)探针检测OXPHOS基因;②线粒体呼吸:用Oxygraph-2k仪检测海马氧消耗率(OCR),依次加入丙酮酸/谷氨酸/苹果酸(激活OXPHOS)、ADP(最大呼吸)、琥珀酸(复合物II)、抗霉素A(抑制复合物III);③ATP水平:用Promega ATP assay试剂盒(FF2000)检测海马ATP,归一化总蛋白。
结果解读:①RNA scope:APP/PS1+CRS组CA1神经元mt-Co3/mt-Atp6荧光强度降低(n=4 vs n=4,p<0.001);②线粒体呼吸:OCR显著降低(n=3 vs n=3,p<0.05);③ATP水平:APP/PS1+CRS组ATP减少(n=5 vs n=5,p<0.001)。
产品关联:RNAscope试剂盒用ACD Bio(PN323110);ATP试剂盒用Promega(FF2000)。
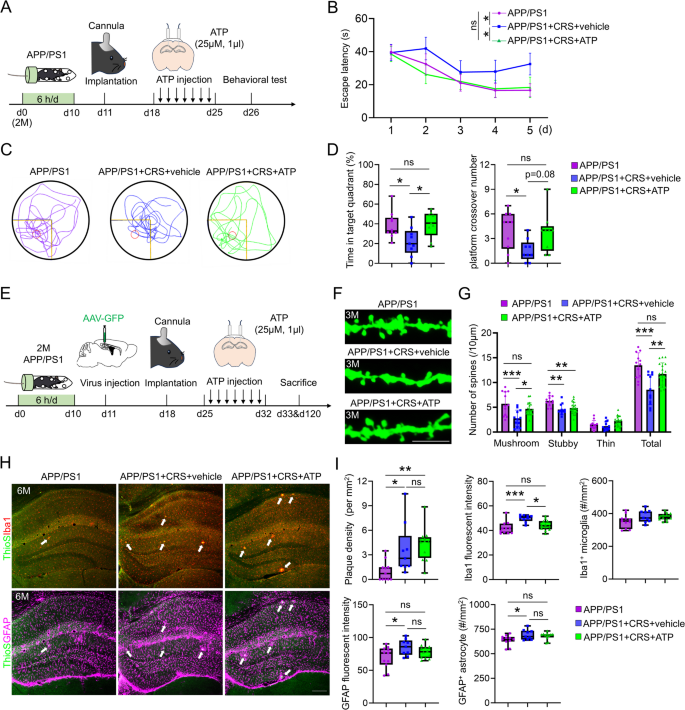
3.5 ATP输注的功能拯救实验
实验目的:验证CA1区输注ATP能否逆转CRS诱导的AD病理。
方法细节:取APP/PS1+CRS小鼠,立体定位注射套管至CA1区(坐标:尾侧-2.00mm、侧方±1.1mm、腹侧-1.3mm);7天后输注ATP(25μM,1μL/天)或PBS,连续7天;输注后24小时进行MWM检测,或注射AAV9-GFP标记神经元检测突触密度,或免疫组化检测胶质激活。
结果解读:①行为学:ATP组MWM逃避潜伏期缩短(n=9 vs n=9,p<0.05),目标象限停留时间增加(n=9 vs n=9,p<0.05);②突触密度:蘑菇状突触和总突触密度恢复(n=19 vs n=12,p<0.01/p<0.001);③胶质激活:GFAP/Iba1荧光强度与密度降低(GFAP:n=6 vs n=6,p<0.05),但Aβ斑块无差异。
产品关联:脑套管用RWD;AAV9-GFP病毒用Brain Case(BC-SL014)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为海马CA1神经元中的OXPHOS关键基因(mt-Co3、mt-Atp6)和ATP水平,属于功能型Biomarker(与疾病进展、治疗反应相关)。筛选逻辑:snRNA-seq发现CA1神经元OXPHOS下调→RNA scope/线粒体呼吸验证OXPHOS功能→ATP assay验证ATP水平→ATP输注验证功能相关性。
研究过程详述
①Biomarker来源:海马CA1神经元(来自APP/PS1和WT小鼠海马);②验证方法:snRNA-seq(转录水平)、RNA scope(原位mRNA)、Oxygraph-2k(线粒体呼吸)、ATP assay(ATP含量);③特异性与敏感性:mt-Co3/mt-Atp6在CA1神经元中特异性表达,APP/PS1+CRS组较APP/PS1组表达显著降低(荧光强度:mt-Co3,n=4 vs n=4,p<0.001;mt-Atp6,n=4 vs n=4,p<0.001);ATP水平在APP/PS1+CRS组显著降低(n=5 vs n=5,p<0.001)。
核心成果提炼
①功能关联:mt-Co3/mt-Atp6表达降低、ATP水平下降与CRS诱导的AD病理(认知障碍、突触丢失、胶质激活)显著相关;②创新性:首次发现CA1神经元OXPHOS-ATP轴是慢性应激加重AD的关键机制,ATP可作为潜在治疗靶点;③统计学结果:ATP输注显著逆转认知障碍(MWM目标象限停留时间:APP/PS1+CRS+ATP vs APP/PS1+CRS+PBS,n=9 vs n=9,p<0.05)、突触丢失(蘑菇状突触密度:n=19 vs n=12,p<0.01)和胶质激活(GFAP荧光强度:n=6 vs n=6,p<0.05)。
5. 结论
本研究揭示海马CA1神经元通过OXPHOS通路和ATP水平调控慢性应激加重AD的进展:CRS抑制CA1神经元OXPHOS功能、降低ATP水平,导致认知障碍、突触丢失和胶质激活;补充ATP可逆转这些病理变化。研究为AD治疗提供了新靶点(ATP),也为理解应激与AD的交互机制提供了细胞层面的证据。