1. 领域背景与文献引入
文献英文标题:Metabolic reprogramming and metabolic sensors in KSHV-induced cancers and KSHV infection;发表期刊:Cell & Bioscience;影响因子:未公开(2021年该期刊影响因子约5.2);研究领域:病毒致癌与代谢重编程。
Kaposi肉瘤相关疱疹病毒(KSHV)是唯一明确与人类癌症相关的γ疱疹病毒,主要关联卡波西肉瘤(KS)、原发性渗出性淋巴瘤(PEL)、多中心Castleman病(MCD)等恶性疾病。KSHV的生命周期分为潜伏(latent)和裂解(lytic)两个阶段:潜伏感染时仅表达LANA、vCyclin、vFLIP及miRNA簇,维持病毒基因组稳定并驱动细胞转化;裂解感染时表达RTA等大量基因,促进病毒传播。代谢重编程是癌症的核心特征(如Warburg效应、谷氨酰胺分解增强),也是病毒感染的关键策略——病毒通过劫持宿主代谢途径获取能量和生物合成原料,同时维持感染细胞的存活与增殖。
现有研究已证实KSHV感染可重编程宿主代谢,但仍存在多个关键空白:(1)KSHV如何直接调控代谢酶(而非仅信号通路);(2)潜伏与裂解感染阶段的代谢差异及机制;(3)代谢传感器(如mTOR、AMPK)如何介导代谢重编程;(4)体内代谢动态及临床相关性研究不足。本文作为综述,系统总结了KSHV劫持代谢途径与传感器的最新进展,为KSHV相关癌症的治疗提供了潜在靶点。
2. 文献综述解析
作者将现有研究按“代谢途径重编程”“感染阶段代谢差异”“代谢传感器劫持”三大维度分类,全面覆盖糖酵解、谷氨酰胺分解、脂肪酸合成等核心代谢通路,以及mTOR、AMPK、sirtuins等关键传感器。
现有研究的核心结论与局限性
现有研究证实:(1)糖酵解:短期KSHV感染(48小时)诱导Warburg效应(葡萄糖摄取↑、乳酸分泌↑、氧消耗↓),长期潜伏感染则通过NF-κB通路下调GLUT1/3抑制糖酵解;(2)谷氨酰胺分解:潜伏感染增强谷氨酰胺摄取(SLC1A5上调)、GLS表达(LANA诱导c-Myc)及ASS1介导的NO循环(激活STAT3),是感染细胞存活的必需;(3)脂肪酸合成:短期感染诱导脂肪酸从头合成,长期感染增强过氧化物酶体β氧化,维持细胞能量平衡;(4)裂解期代谢:需要糖酵解(早期基因转录)、谷氨酰胺分解(蛋白翻译)、脂肪酸合成(病毒释放)协同参与;(5)代谢传感器:mTOR被miR-K1/K4靶向CASTOR1激活,AMPK在应激下被K1蛋白激活维持存活,SIRT1调控代谢并抑制病毒再激活。
现有研究的优势在于结合了细胞模型(TIME、hDMVEC、KMM)、多组学分析(代谢组、转录组、蛋白组)及临床数据(如rapamycin治疗KS);局限性则包括:多为体外研究、缺乏体内代谢动态数据、病毒基因直接调控代谢酶的证据不足、不同细胞类型结果存在异质性(如BJAB细胞对糖酵解抑制剂不敏感)。
本文的创新价值
本文的核心创新在于:(1)系统整合感染阶段的代谢差异,明确短期感染与长期潜伏感染的代谢表型对立性;(2)强调代谢传感器的枢纽作用,将mTOR、AMPK、sirtuins与代谢途径直接关联;(3)提出治疗靶点的临床潜力,如GLS抑制剂、mTOR抑制剂等,为转化研究提供了方向。
3. 研究思路总结与详细解析
本文作为综述,以“代谢通路-感染阶段-传感器”为主线,逐一解析KSHV对代谢的调控机制,以下为关键实验环节的详细梳理:
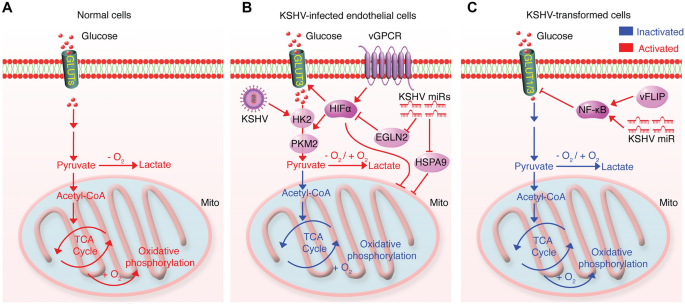
3.1 糖酵解重编程的双向调控
实验目的:明确KSHV对糖酵解的阶段特异性调控。
方法细节:(1)短期感染:用TIME、hDMVEC细胞感染KSHV 48小时,检测葡萄糖摄取、乳酸分泌及HK2表达;(2)长期潜伏感染:用KMM细胞(KSHV转化的大鼠间充质细胞),检测GLUT1/3表达及NF-κB活性。
结果解读:短期感染通过miRNA簇和vGPCR上调HIF1α、抑制线粒体,诱导Warburg效应(葡萄糖摄取↑2倍、乳酸分泌↑1.5倍);长期潜伏感染则通过miRNA和vFLIP激活NF-κB,下调GLUT1/3(蛋白水平↓50%),抑制糖酵解以适应肿瘤微环境的葡萄糖匮乏。
图片插入:
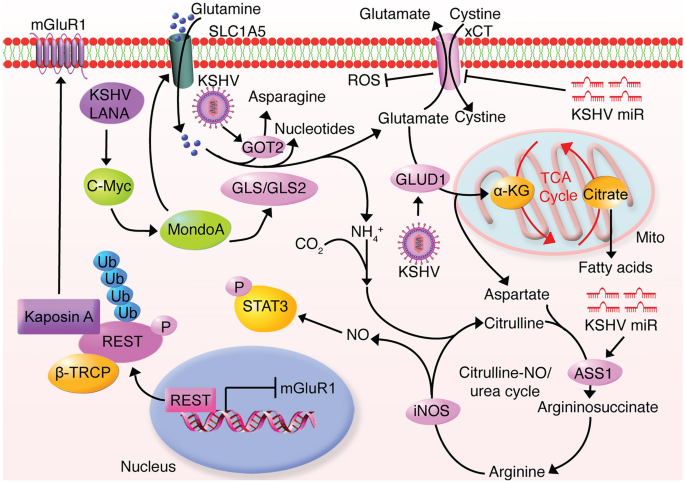
3.2 谷氨酰胺分解的必需性
实验目的:解析谷氨酰胺代谢在KSHV感染中的作用。
方法细节:(1)用latent感染细胞检测谷氨酰胺摄取(SLC1A5)、GLS表达(c-Myc调控);(2)通过α-KG拯救实验验证谷氨酰胺分解的必要性;(3)检测ASS1、iNOS水平及STAT3激活。
结果解读:latent感染增强谷氨酰胺摄取(↑2倍),GLS(↑1.8倍)、GLUD1(↑1.5倍)、GOT2(↑1.5倍)等关键酶上调,促进谷氨酸分泌(mGluR1上调);α-KG拯救实验显示,谷氨酰胺分解为TCA循环提供α-KG,是感染细胞存活的必需;ASS1上调(miRNA介导)促进NO循环,激活STAT3(磷酸化↑2倍),驱动细胞增殖。
图片插入:
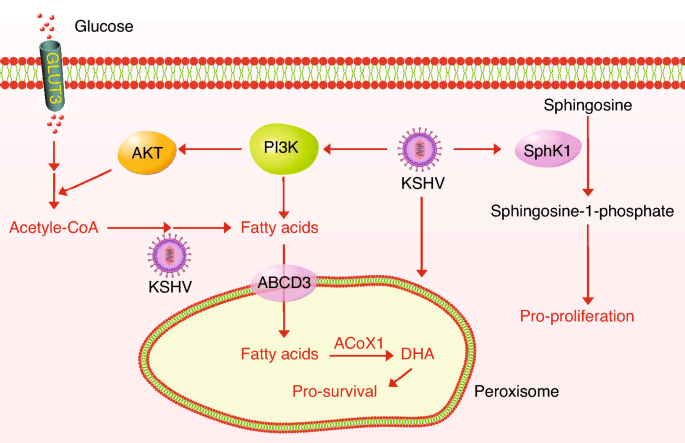
3.3 脂肪酸合成与过氧化物酶体β氧化的协同
实验目的:研究KSHV对脂肪酸代谢的调控。
方法细节:(1)代谢组分析短期感染细胞的脂肪酸合成中间产物;(2)多组学分析长期感染细胞的过氧化物酶体生物发生;(3)抑制剂阻断脂肪酸合成或过氧化物酶体功能。
结果解读:短期感染诱导脂肪酸从头合成(所有中间产物↑1.5-3倍),是感染细胞存活的必需;长期感染增强过氧化物酶体生物发生(ABCD3、ACOX1↑2倍),促进脂肪酸β氧化,维持能量平衡;抑制剂阻断脂肪酸合成或过氧化物酶体功能,可特异性诱导感染细胞凋亡。
图片插入:
3.4 裂解复制期的代谢依赖
实验目的:明确裂解期的代谢需求。
方法细节:用2-DG(糖酵解抑制剂)、BPTES(谷氨酰胺分解抑制剂)、C75(脂肪酸合成抑制剂)处理KSHV感染细胞,检测病毒基因表达、基因组复制及病毒释放。
结果解读:糖酵解抑制剂抑制早期基因转录(ORF50 mRNA↓60%),谷氨酰胺分解抑制剂抑制蛋白翻译(ORF50蛋白↓50%),脂肪酸合成抑制剂抑制病毒释放(感染性病毒↓70%);三者均不影响病毒基因组复制,提示不同代谢通路参与裂解期的不同阶段。
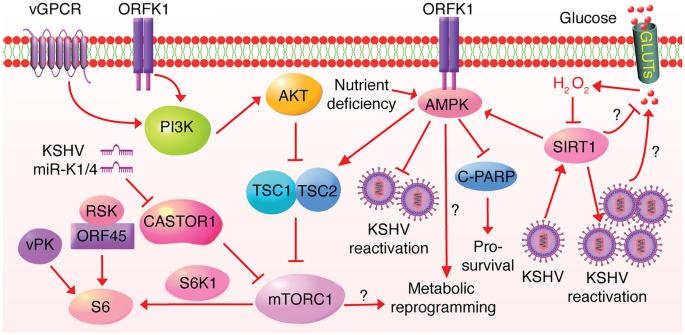
3.5 代谢传感器的劫持机制
实验目的:解析mTOR、AMPK、sirtuins等传感器在KSHV感染中的作用。
方法细节:(1)miRNA敲低(miR-K1/K4)检测CASTOR1与mTOR活性;(2)K1蛋白互作分析检测AMPK活性;(3)SIRT1抑制剂检测细胞存活与病毒再激活。
结果解读:(1)mTOR:miR-K1/K4靶向下调CASTOR1(mRNA↓50%),解除其对mTORC1的抑制,促进细胞增殖;(2)AMPK:K1蛋白与AMPK互作,在代谢应激下增强AMPK活性(磷酸化↑2倍),维持细胞存活;(3)SIRT1:latent感染上调SIRT1(蛋白↑1.5倍),激活AMPK,抑制糖酵解并促进脂肪酸氧化,同时抑制病毒再激活。
图片插入:
4. Biomarker研究及发现成果解析
本文未明确报道新的Biomarker,但系统总结了代谢酶与传感器作为潜在Biomarker的可能性,为KSHV相关癌症的诊断与治疗提供了方向:
潜在Biomarker的定位与验证
- 代谢酶类:
- GLUT1/3:长期潜伏感染下调50%,是糖酵解抑制的标志,可通过^{18}F-FDG PET/CT检测KS患者的糖酵解水平(临床相关性);
- GLS:latent感染上调1.8倍,是谷氨酰胺分解的核心酶,其抑制剂CB-839在preclinical研究中诱导KSHV感染细胞凋亡;
ASS1:miRNA上调2倍,介导NO循环激活STAT3,是latent感染的潜在标志。
代谢传感器:
- CASTOR1:miR-K1/K4下调50%,是mTORC1的关键调控因子,可作为mTOR抑制剂的响应标志物;
- mTOR:磷酸化水平↑2倍,是KSHV感染的激活标志,临床研究已证实mTOR抑制剂rapamycin治疗KS有效(Stallone等,2005);
- SIRT1:latent感染上调1.5倍,是代谢调控的核心传感器,其表达水平与病毒再激活负相关。
创新性与局限性
创新性:提出代谢酶与传感器作为KSHV相关癌症的潜在Biomarker,将代谢重编程与临床诊断/治疗关联;局限性:缺乏大样本临床验证,未考虑患者代谢异质性,需进一步研究确认其特异性与敏感性。
总结
本文全面梳理了KSHV感染对代谢途径的重编程及对代谢传感器的劫持,为理解KSHV致癌机制提供了新视角。未来研究需聚焦:(1)KSHV直接调控代谢酶的分子机制;(2)体内代谢动态的临床监测;(3)代谢靶点的联合治疗策略,以推动KSHV相关癌症的精准治疗。
