1. 领域背景与文献引入
文献英文标题:A case of B-cell acute lymphoblastic leukemia in a child with Down syndrome bearing a t(2;12)(p12;p13) involving ETV6 and biallelic IGH@ rearrangements;发表期刊:Biomarker Research;影响因子:未公开;研究领域:儿科B细胞急性淋巴细胞白血病(B-ALL)细胞遗传学与分子机制。
儿科B细胞急性淋巴细胞白血病(B-ALL)是儿童最常见的恶性血液病,常伴随特征性细胞遗传学异常,其中t(12;21)(p13;q22)[ETV6/RUNX1]、超二倍体等异常的分子机制已被广泛研究(如ETV6/RUNX1融合蛋白干扰RUNX1转录调控)。唐氏综合征相关ALL(DS-ALL)是一类特殊亚型,其t(8;14)(q11.2;q32)易位频率显著高于普通儿科人群,该易位将8q11.2的CEBPD基因置于14q32的IGH@基因调控区附近,驱动CEBPD过表达,患者多表现为B细胞前体免疫表型,预后中等。ETV6(12p13)基因重排是儿科B-ALL最常见的结构异常之一,除经典t(12;21)易位外,ETV6还可与20余个伙伴基因形成融合,但t(2;12)(p12;p13)涉及ETV6的易位在B-ALL中极为罕见,尤其是与t(8;14)共存的情况,此前仅1例DS-ALL病例报道。现有研究对这类罕见易位的分子机制、与其他易位的协同作用及克隆演化过程知之甚少。
针对上述研究空白,本文通过常规细胞遗传学与荧光原位杂交(FISH)技术,系统解析了1例唐氏综合征儿童B-ALL的罕见异常(t(2;12)(p12;p13)涉及ETV6、t(8;14)及双等位基因IGH@重排),填补了该领域对复杂细胞遗传学异常解析的不足,为理解罕见异常在B-ALL中的作用提供了新临床证据。
2. 文献综述解析
作者以“儿科B-ALL常见细胞遗传学异常→DS-ALL特征性易位→ETV6重排的多样性”为分类维度,总结现有研究的关键结论、技术优势及局限性,并通过对比罕见易位的研究空白,凸显本文创新价值。
现有研究关键结论:儿科B-ALL的常见细胞遗传学异常(如t(12;21)、超二倍体)通过融合蛋白或染色体数目改变驱动白血病发生,其机制已明确;DS-ALL中t(8;14)易位的临床特征(B细胞前体表型)与预后(中等风险)已被验证;ETV6重排作为高频异常,除经典t(12;21)外,还存在20余种伙伴基因,但t(2;12)(p12;p13)涉及ETV6的易位在B-ALL中罕见,且与t(8;14)共存的情况仅有1例报道。现有研究的技术优势在于通过细胞遗传学与FISH精准定位染色体异常,但其局限性在于对罕见易位的分子机制、克隆演化过程研究不足。
本文创新价值:通过对比现有研究中“ETV6易位的罕见性”与“t(8;14)在DS-ALL中的特殊性”,首次报道了DS-ALL中t(2;12)(p12;p13)(涉及ETV6)与双等位基因IGH@重排共存的病例,利用FISH明确了ETV6在t(2;12)中的参与,补充了罕见异常的临床数据;同时,通过分析克隆演化模式,为理解B-ALL中多步骤异常的发生过程提供了新视角。
3. 研究思路总结与详细解析
本文研究目标是解析1例唐氏综合征儿童B-ALL的罕见细胞遗传学异常,核心科学问题是“t(2;12)是否涉及ETV6”“异常的克隆演化关系”,技术路线为“临床病例呈现→常规细胞遗传学分析→荧光原位杂交验证→克隆演化推测”,形成完整的“发现-验证-解析”闭环。
3.1 病例呈现与初步诊断
实验目的:明确患者临床特征与B-ALL诊断。方法细节:收集9岁唐氏综合征男性患者的临床资料(持续发热、乏力)、血常规(全血细胞减少,淋巴母细胞占32%)、骨髓活检(95%淋巴母细胞浸润)及流式细胞术(CD34、CD10、CD19、CD22、HLA-DR阳性)结果,依据形态学与免疫表型诊断B-ALL。结果解读:患者符合B-ALL诊断标准,且具有唐氏综合征背景(核型+21),为后续细胞遗传学分析提供基础。产品关联:文献未提及具体实验产品,领域常规使用血常规分析仪(如Sysmex XN系列)、流式细胞仪(如BD FACSCanto)及CD34、CD10等免疫表型抗体。
3.2 常规细胞遗传学分析
实验目的:检测染色体数目与结构异常。方法细节:取骨髓和外周血样本制备30个中期分裂相,经G显带(Giemsa显带)处理后,用Applied Imaging CytoVision软件进行核型分析,按ISCN 2013标准命名。结果解读:25个分裂相为47,XY,+21c(唐氏综合征核型),5个分裂相为47,XY,+21c,t(2;12)(p12;p13),t(8;14)(q11.2;q32),提示存在额外易位。对应图1(异常核型)。产品关联:实验所用关键产品:Applied Imaging CytoVision软件(核型分析)。
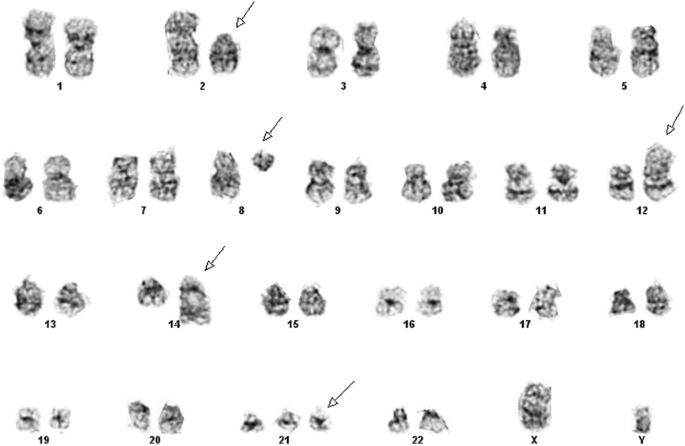
3.3 荧光原位杂交验证易位与重排
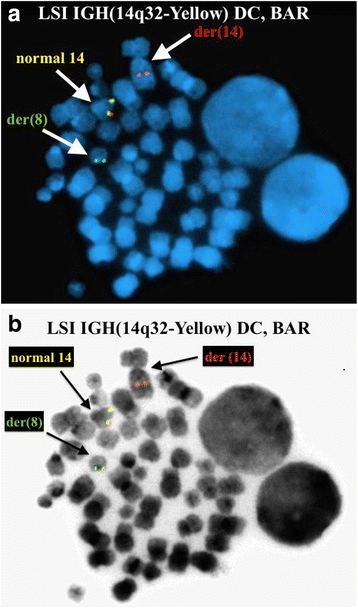
实验目的:确认ETV6和IGH@基因的重排情况。方法细节:使用Abbott Molecular的荧光原位杂交探针(ETV6/RUNX1双color易位探针、ETV6 break apart探针、IGH@ break apart探针等),检测300个间期核和中期分裂相的信号模式。结果解读:ETV6/RUNX1探针显示50.7%(152/300)间期核有3个ETV6信号,提示ETV6重排;ETV6 break apart探针在中期分裂相显示,正常12号染色体有ETV6融合信号(F),der(2)有ETV6 5′端(红色),der(12)有ETV6 3′端(绿色),确认t(2;12)涉及ETV6;IGH@ break apart探针显示89.7%(269/300)间期核有1个融合信号(正常IGH@)和1个分裂信号(t(8;14)导致的重排),6.7%(20/300)间期核有2个分裂信号(双等位基因IGH@重排);中期分裂相确认t(8;14)中der(8)携带IGH@ 3′端(红色),der(14)携带IGH@ 5′端(绿色)。对应图2(ETV6间期信号)、图3(ETV6中期信号)、图4(IGH@间期信号)、图5(IGH@中期信号)。产品关联:实验所用关键产品:Abbott Molecular的Vysis LSI ETV6/RUNX1 ES Dual Color Translocation Probe Set、Vysis LSI ETV6 Dual Color Break Apart Probe Kit、Vysis LSI IGH Dual Color Break Apart Rearrangement Probe。
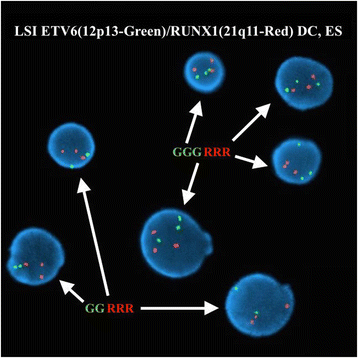
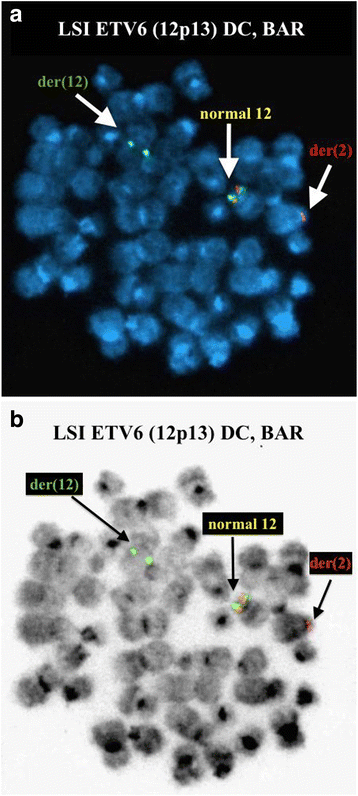
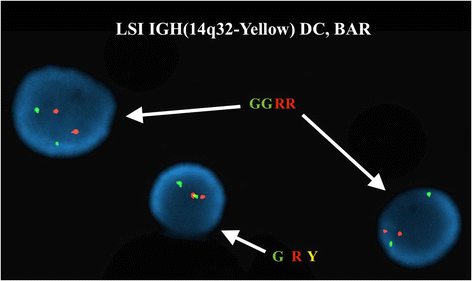
3.4 克隆演化分析
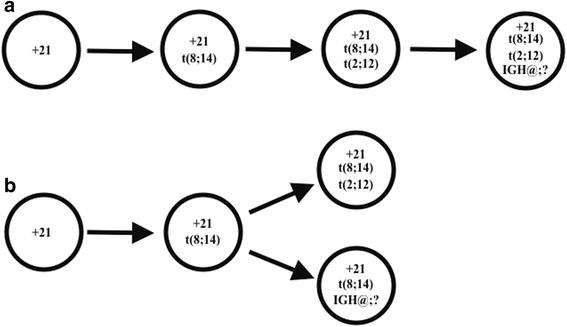
实验目的:解析异常的克隆演化关系。方法细节:结合常规细胞遗传学(中期分裂相异常比例)与荧光原位杂交(间期核异常比例)结果,推测克隆演化模式。结果解读:t(8;14)的间期核阳性率(89.7%)远高于t(2;12)(50.7%)与双等位基因IGH@重排(6.7%),提示t(8;14)是primary异常;t(2;12)与t(8;14)在同一中期分裂相出现,提示其为secondary异常;双等位基因IGH@重排仅在间期核中少量存在,提示为更晚的演化事件。克隆演化可能为两种模式:(1)线性演化:t(8;14)→t(2;12)→双等位基因IGH@重排;(2)发散演化:t(8;14)分别演化出t(2;12)克隆与双等位基因IGH@重排克隆。对应图6(克隆演化模式图)。产品关联:文献未提及具体实验产品,领域常规使用荧光原位杂交图像分析软件(如MetaSystems ISIS)。
4. Biomarker研究及发现成果解析
本文的Biomarker为“细胞遗传学异常(t(2;12)(p12;p13)涉及ETV6、t(8;14)(q11.2;q32)涉及IGH@、双等位基因IGH@重排)”,筛选逻辑为“临床病例发现→常规细胞遗传学筛选→荧光原位杂交验证”,确保了Biomarker的精准性。
Biomarker定位与研究过程
Biomarker来源为患者骨髓样本(中期分裂相与间期核);验证方法包括常规细胞遗传学(G显带)与荧光原位杂交(ETV6、IGH@探针);特异性与敏感性:t(2;12)中期分裂相阳性率16.7%(5/30),荧光原位杂交间期核ETV6重排阳性率50.7%(152/300);t(8;14)中期分裂相阳性率16.7%(5/30),荧光原位杂交间期核IGH@单等位基因重排阳性率89.7%(269/300),双等位基因重排阳性率6.7%(20/300)。
核心成果提炼
该病例是首篇报道的B-ALL中t(2;12)(p12;p13)涉及ETV6且与t(8;14)共存的案例,明确了ETV6在t(2;12)中的参与,补充了罕见易位的临床数据;双等位基因IGH@重排的发现提示克隆演化的复杂性,为理解B-ALL中多步骤异常的发生过程提供了实例;此外,t(2;12)可能通过两种机制促进白血病发生:(1)ETV6功能丧失(如融合导致的转录抑制功能缺失);(2)激活2p12上的未知伙伴基因(如酪氨酸激酶),但具体机制需进一步分子研究验证。统计学结果:ETV6重排间期核阳性率50.7%(n=300,文献未明确P值);IGH@单等位基因重排阳性率89.7%(n=300,文献未明确P值);双等位基因重排阳性率6.7%(n=300,文献未明确P值)。
