1. 领域背景与文献引入
文献英文标题:Bortezomib induced peripheral neuropathy and single nucleotide polymorphisms in PKNOX1;发表期刊:Biomark Res;影响因子:未公开;研究领域:多发性骨髓瘤治疗相关的药物不良反应(硼替佐米诱导周围神经病变)与基因多态性。
多发性骨髓瘤(multiple myeloma, MM)是一种浆细胞恶性肿瘤,蛋白酶体抑制剂的问世显著改善了患者预后——硼替佐米作为首个上市的蛋白酶体抑制剂,仍是新诊断MM(newly diagnosed MM, NDMM)的一线核心药物,但其非血液学副作用“周围神经病变”(bortezomib-induced peripheral neuropathy, BIPN)严重影响患者生活质量:临床数据显示,硼替佐米单药或联合方案的BIPN发生率可达30%-70%,其中10%-20%为疼痛性BIPN,部分患者需因此减少药物剂量甚至停药。尽管BIPN的机制涉及神经轴突损伤、线粒体功能障碍等,但遗传因素的作用逐渐成为研究热点——2016年一项 genome-wide association study(GWAS)首次发现,PKNOX1基因(编码转录调节因子,调控单核细胞趋化蛋白1(MCP-1)表达)的单核苷酸多态性(SNP)rs2839629与BIPN风险显著相关,但该结论未在更大样本量的临床队列中验证,且未区分“疼痛性BIPN”这一更严重的表型。因此,本研究针对这一空白,通过分析88例接受硼替佐米治疗的MM患者的PKNOX1及邻近区域SNP,探讨其与BIPN(尤其是疼痛性)的关联,为BIPN的风险预测提供生物标志物依据。
2. 文献综述解析
作者围绕“硼替佐米神经毒性的临床挑战→基因多态性作为风险因素的潜在价值→现有研究的局限性”展开评述,核心逻辑如下:
现有研究可分为三个层面:临床层面,硼替佐米联合沙利度胺的方案(如D-VTd)神经毒性更高(CASSIOPEIA试验显示全级别神经病变发生率60.9%),但不同患者的神经毒性差异显著,提示遗传因素参与;机制层面,PKNOX1通过结合MCP-1启动子调控其表达,而MCP-1是神经病理性疼痛的关键介质——PKNOX1的SNP可能改变转录因子结合能力,进而影响MCP-1表达,增加神经毒性风险;技术层面,前期GWAS研究样本量小(仅100余例),未区分疼痛性与非疼痛性BIPN,且未探讨PKNOX1与邻近基因(如胱硫醚-β-合成酶(CBS),参与同型半胱氨酸代谢)间区SNP的协同作用。
本研究的创新点聚焦于三点:表型细化(首次将疼痛性BIPN作为主要终点,更贴合临床需求);位点扩展(同时分析PKNOX1基因内rs2839629与基因间区rs915854,发现两者存在高度连锁不平衡——13例rs2839629纯合突变患者均同时携带rs915854纯合突变);临床转化(验证了基因型与硼替佐米剂量调整的关联,为临床决策提供直接依据)。
3. 研究思路总结与详细解析
本研究的整体框架:研究目标是探讨PKNOX1 rs2839629和PKNOX1-CBS间区rs915854的SNP与MM患者BIPN(尤其是疼痛性)的关联;核心科学问题是“这两个SNP是否可作为BIPN的风险生物标志物”;技术路线为“临床队列建立→SNP检测(Sanger测序)→基因型与临床表型(BIPN分级、疼痛、剂量调整)关联分析”。
3.1 研究队列建立与临床特征收集
实验目的是纳入接受硼替佐米治疗的MM患者,系统收集临床特征及BIPN相关数据。方法细节:纳入88例MM患者,通过电子病历收集硼替佐米治疗状态(起始/正在进行/已停用)、沙利度胺联合用药史、既往神经病变史(特发性/糖尿病性/出血后);通过神经学评估(标准神经系统检查+患者自我报告问卷)确定BIPN分级(根据常见不良反应术语标准(CTCAE))及疼痛情况(疼痛性BIPN定义为存在神经病理性疼痛)。结果解读:队列中73例(83%)出现BIPN,34例(39%)为疼痛性,仅3例(3%)为≥3级严重BIPN;27例(31%)联合沙利度胺,但沙利度胺未增加神经病变风险(Fisher精确检验P=0.44)。产品关联:文献未提及具体实验产品,领域常规使用电子病历系统(如EPIC)收集临床数据。
3.2 单核苷酸多态性(SNP)检测与基因型分析
实验目的是检测患者的PKNOX1 rs2839629和PKNOX1-CBS间区rs915854的基因型。方法细节:提取患者外周血DNA,采用Sanger测序法(金标准)检测两个SNP的基因型——rs2839629的野生型为G/G,杂合突变型为A/G,纯合突变型为A/A;rs915854的野生型为C/C,杂合突变型为C/T,纯合突变型为T/T。结果解读:86例患者成功检测rs2839629基因型,88例成功检测rs915854基因型;13例rs2839629纯合突变患者均同时携带rs915854纯合突变(连锁不平衡);44例rs2839629杂合突变患者中,40例(90.9%)携带rs915854突变(纯合4例,杂合36例)。产品关联:实验所用关键产品为Sanger测序试剂盒(如Applied Biosystems的BigDye Terminator v3.1 Cycle Sequencing Kit)、DNA提取试剂盒(如QIAGEN的QIAamp DNA Blood Mini Kit)(文献未明确提及,基于领域常规方法)。
3.3 基因型与BIPN表型的关联分析
实验目的是探讨两个SNP基因型与BIPN(尤其是疼痛性)的关联。方法细节:将78例有效患者分为三组(无BIPN、非疼痛性BIPN、疼痛性BIPN),采用卡方检验比较三组的基因型频率;进一步采用Fisher精确检验比较“疼痛组”与“无疼痛组”的基因型差异。结果解读:rs2839629纯合突变型在疼痛性BIPN组中的频率(28.1%,32例中9例)显著高于非疼痛性组(5.7%,35例中2例),差异具有统计学意义(P<0.0001,图1B);rs915854纯合突变型的结果一致(27.3%,33例中9例 vs 5.7%,35例中2例,P<0.0001,图1C);rs2839629纯合突变型在疼痛组中的频率显著高于无疼痛组(P=0.04)。图片:
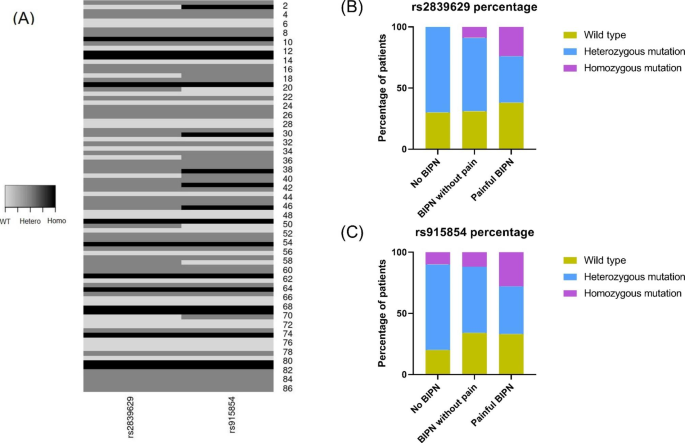
(该图显示两个SNP的纯合突变型在疼痛性BIPN中显著富集)。产品关联:文献未提及具体统计软件,领域常规使用R或SPSS进行卡方检验和Fisher精确检验。
3.4 基因型与硼替佐米剂量调整的关联分析
实验目的是探讨基因型与硼替佐米剂量减少的关联。方法细节:收集患者是否因BIPN需要减少硼替佐米剂量的信息,采用Fisher精确检验比较纯合突变型与非纯合突变型患者的剂量调整率。结果解读:rs2839629纯合突变型患者中,需要剂量调整的比例(46.2%,13例中6例)显著高于非纯合突变型(18.8%,73例中14例),差异具有统计学意义(P=0.03),提示纯合突变型患者更易因神经毒性需要减量。产品关联:文献未提及具体数据收集工具,领域常规使用临床医嘱系统记录药物剂量调整。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本研究涉及的Biomarker是PKNOX1 rs2839629和PKNOX1-CBS间区rs915854的纯合突变基因型,属于“基因多态性生物标志物”。筛选逻辑基于前期GWAS研究(rs2839629与BIPN相关),同时纳入rs915854(因位于PKNOX1与CBS间区,可能协同调控基因表达);验证逻辑为“临床队列Sanger测序检测基因型→关联分析与BIPN表型(疼痛性、剂量调整)的关系”。
研究过程详述
Biomarker来源:88例MM患者的外周血DNA;验证方法:Sanger测序(金标准)检测两个SNP的基因型;特异性与敏感性数据:对于疼痛性BIPN,rs2839629纯合突变型的阳性预测值(PPV)为28.1%(32例疼痛性患者中9例纯合突变),阴性预测值(NPV)为94.3%(35例非疼痛性患者中33例非纯合突变);rs915854纯合突变型的PPV为27.3%(33例疼痛性患者中9例纯合突变),NPV为94.3%(35例非疼痛性患者中33例非纯合突变);统计学显著性:rs2839629纯合突变与疼痛性BIPN的关联P<0.0001(n=77),与剂量调整的关联P=0.03(n=86);rs915854纯合突变与疼痛性BIPN的关联P<0.0001(n=78)。
核心成果提炼
- 功能关联:两个SNP的纯合突变基因型与MM患者的“疼痛性BIPN”和“硼替佐米剂量调整需求”显著相关——纯合突变型患者的疼痛性BIPN风险是未突变型的4.9倍(32例疼痛性患者中9例纯合突变),剂量调整风险是未突变型的2.46倍(13例纯合突变患者中6例需减量)。
- 创新性:首次发现rs2839629与rs915854存在高度连锁不平衡(纯合突变型共现),推测:两者可能通过协同调控PKNOX1或CBS的表达,增加MCP-1水平,进而加重神经病理性疼痛。
- 临床价值:这两个SNP可作为疼痛性BIPN的风险预测生物标志物——临床医生可在MM患者接受硼替佐米治疗前检测这两个SNP的基因型,对于纯合突变型患者,需密切监测神经病变症状(如肢体麻木、疼痛),必要时提前减少硼替佐米剂量,以降低疼痛性BIPN的发生风险,改善患者生活质量。
本研究为BIPN的风险分层提供了首个“基因多态性+临床表型”的生物标志物组合,弥补了现有研究的不足,为MM患者的个体化治疗提供了重要依据。
