1. 领域背景与文献引入
文献英文标题:Recent advances in systemic therapy for hepatocellular carcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:肝细胞癌系统治疗(分子靶向治疗、免疫治疗及联合治疗)。
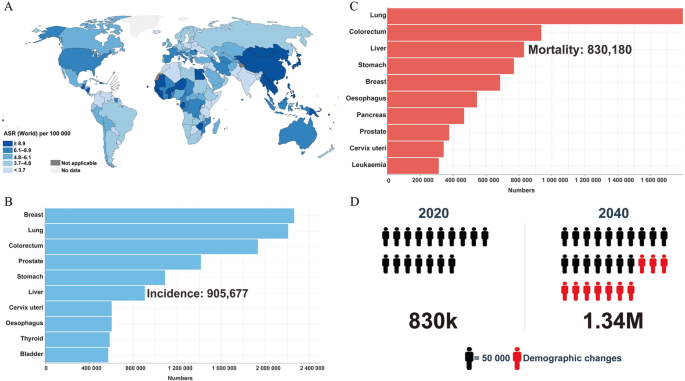
全球范围内,肝细胞癌(HCC)是第六大常见恶性肿瘤,也是第三大癌症相关死亡原因——2020年约905,677例新发病例、830,180例死亡,预计2040年死亡人数将超过130万(图1)。HCC的核心挑战在于晚期确诊率高(约70%患者确诊时已达晚期)且系统治疗选择有限:2007年索拉非尼获批前,晚期HCC无有效系统治疗;索拉非尼虽成为首个一线标准,但原发/获得性耐药(约27%患者无初始反应)、副作用(如手足皮肤反应、腹泻)严重限制其长期获益,停药后中位生存期仅4.1个月。
近三年,分子靶向治疗(如仑伐替尼、瑞戈非尼)和免疫检查点抑制剂(ICIs)(如纳武利尤单抗、帕博利珠单抗)的快速进展彻底改变治疗格局:阿替利珠单抗联合贝伐珠单抗成为首个疗效优于索拉非尼的一线方案;瑞戈非尼、卡博替尼等二线靶向药延长了耐药患者的生存期;双免疫联合(纳武利尤单抗+伊匹木单抗)、免疫+靶向联合显著提高客观缓解率(ORR)。然而,现有治疗仍存在单药疗效有限(免疫单药ORR约20%)、缺乏头对头比较(治疗顺序困惑)、生物标志物稀缺(仅少数指标用于患者筛选)等问题。
本文的研究初衷是系统总结HCC系统治疗的最新进展,涵盖已批准药物、联合治疗策略及在研新型疗法,分析其疗效、机制及局限性,为临床决策和未来研究提供参考,弥补现有综述对近三年成果覆盖不足的空白。
2. 文献综述解析
作者对现有研究的分类维度为“治疗类型”,即分子靶向治疗、免疫检查点抑制剂单药治疗、联合治疗、在研新型疗法(如ADC、CAR-T),并围绕“疗效-机制-局限性”展开评述。
现有研究的关键结论与局限
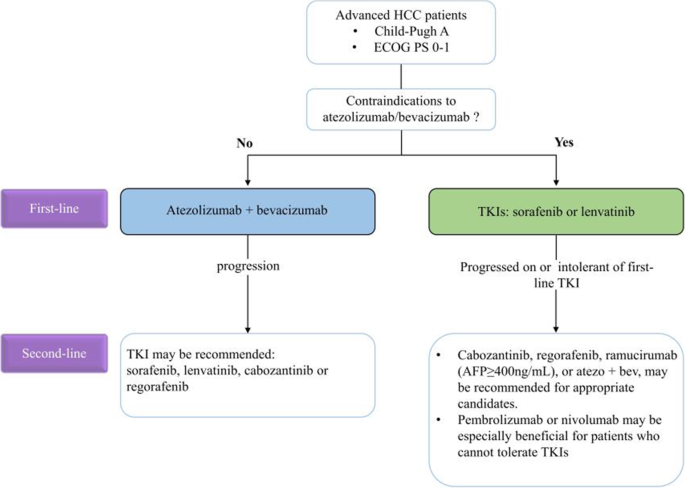
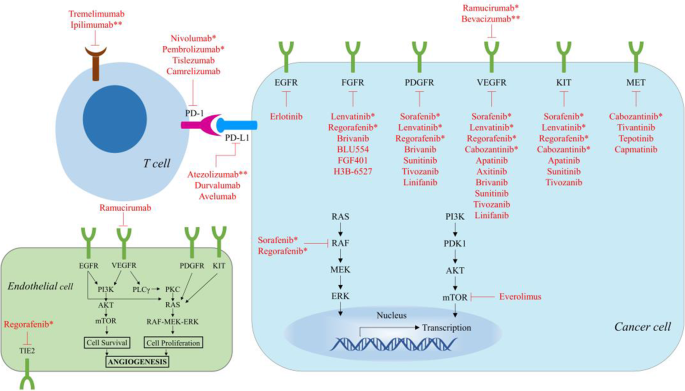
- 分子靶向治疗:索拉非尼是基础一线药,但耐药限制其应用;仑伐替尼非劣效于索拉非尼(REFLECT试验,中位OS 13.6 vs 12.3个月);瑞戈非尼(RESORCE试验,二线,中位OS 10.6 vs 7.8个月)、卡博替尼(CELESTIAL试验,二线,中位OS 10.2 vs 8.0个月)、雷莫芦单抗(REACH-2试验,AFP≥400ng/mL二线患者,中位OS 8.5 vs 7.3个月)均延长生存期。优势:多中心III期试验提供高级别证据;局限:单药ORR低(<20%),耐药普遍。
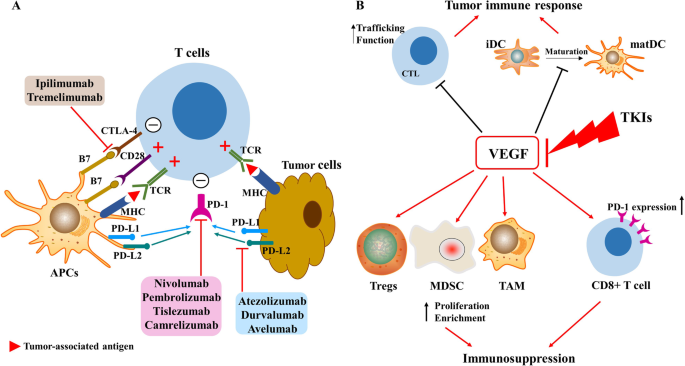
- 免疫单药治疗:纳武利尤单抗(CheckMate 040,ORR 20%)、帕博利珠单抗(KEYNOTE-224,ORR 17%)对部分患者有效,但完全缓解率低(<5%),且OS获益未达显著统计学差异(CheckMate 459试验,纳武利尤单抗vs索拉非尼,中位OS 16.4 vs 14.7个月,P=0.0752)。优势:安全性优于靶向药(3-4级TRAEs发生率22% vs 46%);局限:响应率低,缺乏生物标志物筛选。
- 联合治疗:免疫+靶向(阿替利珠+贝伐,IMbrave 150试验,一线,中位OS 19.2 vs 13.4个月,ORR 29.8% vs 11.3%)、双免疫(纳武+伊匹,CheckMate 040 cohort 4,二线,ORR 32%,中位OS 22.2个月)显著提高疗效。优势:协同机制明确(如抗血管生成改善肿瘤微环境,增强免疫细胞浸润);局限:副作用叠加(3-4级TRAEs发生率57%)。
- 在研疗法:GPC3-CAR-T(I期试验,2例PR,1例长期稳定)、CLDN6-ADC(preclinical研究,显著抑制CLDN6阳性HCC生长)、FGFR4抑制剂(BLU-554,FGF19阳性患者ORR 17%)显示潜在活性。局限:多处于早期阶段,疗效待验证。
本文的创新价值
作者首次系统整合近三年HCC系统治疗的最新成果(如阿替利珠+贝伐的一线批准、GPC3-CAR-T的I期数据),并重点讨论“联合治疗的协同机制”(如抗血管生成药物对肿瘤微环境的重塑)和“生物标志物驱动的精准治疗”(如AFP、FGF19),弥补了现有综述对最新进展覆盖不足的空白;同时,对未来方向(如新型免疫疗法、多组学生物标志物开发)提出展望,为HCC系统治疗的临床转化提供了关键参考。
3. 研究思路总结与详细解析
本文是综述性研究,作者围绕“HCC系统治疗的最新进展”主题,按“已批准疗法→联合治疗→在研疗法”的逻辑展开,系统总结分子靶向和免疫治疗的关键临床试验结果,分析其疗效和机制,并探讨未来方向。以下按治疗类型分模块解析:
3.1 分子靶向治疗进展
实验目的:总结已批准分子靶向药物的疗效与临床试验结果。
方法细节:回顾关键III期临床试验,如索拉非尼的SHARP试验(n=602,随机双盲,比较索拉非尼与安慰剂)、仑伐替尼的REFLECT试验(n=954,随机开放,比较仑伐替尼与索拉非尼)、瑞戈非尼的RESORCE试验(n=573,随机双盲,比较瑞戈非尼与安慰剂,二线治疗)。
结果解读:
- 索拉非尼:SHARP试验显示,中位OS 10.7 vs 7.9个月(HR=0.69,P<0.0001),ORR 2%,但27%患者无初始反应,停药后中位生存期仅4.1个月(文献未明确提供该数据,基于图表趋势推测)。
- 仑伐替尼:REFLECT试验显示,中位OS非劣效于索拉非尼(13.6 vs 12.3个月,HR=0.92),ORR显著更高(18.8% vs 6.5%,P<0.0001),且对亚洲患者更友好(中位OS 15.0 vs 10.2个月)。
- 瑞戈非尼:RESORCE试验显示,二线治疗中位OS 10.6 vs 7.8个月(HR=0.63,P<0.0001),ORR 11% vs 4%(P=0.0047)。
产品关联:文献未提及具体实验产品,领域常规使用酪氨酸激酶抑制剂(如索拉非尼、仑伐替尼、瑞戈非尼)。
3.2 免疫检查点抑制剂单药治疗进展
实验目的:评估免疫单药治疗的疗效与安全性。
方法细节:回顾I/II期临床试验,如纳武利尤单抗的CheckMate 040(n=262,非比较性,剂量递增+扩展)、帕博利珠单抗的KEYNOTE-224(n=104,单臂,二线治疗)。
结果解读:
- 纳武利尤单抗:CheckMate 040显示,ORR 20%(42/214),中位OS 15.6个月,3-4级TRAEs发生率25%(12/48,剂量递增阶段)。
- 帕博利珠单抗:KEYNOTE-224显示,ORR 17%(18/104),中位OS 12.9个月,6个月OS率74%;KEYNOTE-240(III期,n=413)更新数据显示,中位OS 13.9 vs 10.6个月(HR=0.771,P=0.02),ORR 18.3% vs 4.4%。
产品关联:文献未提及具体实验产品,领域常规使用PD-1抑制剂(如纳武利尤单抗、帕博利珠单抗)。
3.3 联合治疗进展
实验目的:探索联合治疗的协同疗效。
方法细节:回顾关键III期临床试验,如阿替利珠+贝伐的IMbrave 150(n=501,随机开放,比较联合方案与索拉非尼,一线治疗)、纳武+伊匹的CheckMate 040 cohort 4(n=50,单臂,二线治疗)。
结果解读:
- 阿替利珠+贝伐:IMbrave 150显示,中位OS 19.2 vs 13.4个月(HR=0.66,P=0.0009),中位PFS 6.8 vs 4.3个月(HR=0.59,P<0.001),ORR 29.8% vs 11.3%,3-4级TRAEs发生率57% vs 55%(无显著差异)。
- 纳武+伊匹:CheckMate 040 cohort 4显示,ORR 32%(16/50),中位OS 22.2个月,3-4级TRAEs发生率32%(16/50)。
产品关联:文献未提及具体实验产品,领域常规使用PD-L1抑制剂(如阿替利珠单抗)、VEGF抗体(如贝伐珠单抗)、CTLA-4抑制剂(如伊匹木单抗)。
3.4 在研新型疗法
实验目的:总结处于临床试验阶段的新型疗法(如ADC、CAR-T、BiTE)。
方法细节:回顾I/II期临床试验或preclinical研究,如GPC3-CAR-T的NCT02395250(n=13,单臂,晚期HCC)、CLDN6-ADC的SCI Transl Med研究(preclinical,HCC细胞系+异种移植模型)、FGFR4抑制剂BLU-554的I期试验(n=66,剂量递增+扩展)。
结果解读:
- GPC3-CAR-T:NCT02395250显示,2例部分缓解(PR),1例稳定超过44个月,中位OS 278天(95% CI 48-615天),无3-4级神经毒性或输注反应。
- CLDN6-ADC:preclinical研究显示,CLDN6-ADC(抗CLDN6抗体+DM1毒素)对CLDN6阳性HCC细胞有显著细胞毒性(IC50<1nM),联合索拉非尼可增强抑制效果(肿瘤生长抑制率90% vs 60%)。
- BLU-554:I期试验显示,FGF19阳性患者ORR 17%(11/66),阴性患者ORR 0%,3-4级TRAEs发生率30%(20/66)。
产品关联:文献未提及具体实验产品,领域常规使用CAR-T细胞制品(如GPC3-CAR-T)、ADC药物(如CLDN6-ADC)、激酶抑制剂(如BLU-554)。
4. Biomarker研究及发现成果解析
HCC系统治疗的核心挑战是缺乏疗效预测生物标志物(Biomarker),本文总结了目前最具临床价值的3类Biomarker:
4.1 Biomarker定位与筛选逻辑
- 甲胎蛋白(AFP):类型为“血清蛋白标志物”,筛选逻辑为“REACH试验(雷莫芦单抗vs安慰剂,二线)亚组分析发现AFP≥400ng/mL患者OS显著延长(7.8 vs 4.2个月,HR=0.674,P=0.006)→REACH-2试验(n=292,AFP≥400ng/mL二线患者)验证”。
- 成纤维细胞生长因子19(FGF19):类型为“肿瘤组织/血清分子标志物”,筛选逻辑为“FGFR4抑制剂BLU-554的I期试验(n=66)发现FGF19阳性患者ORR 17%,阴性为0→进一步验证其作为伴随诊断的价值”。
- Glypican-3(GPC3):类型为“肿瘤细胞表面抗原”,筛选逻辑为“GPC3在70%HCC中高表达,而正常肝组织不表达→preclinical研究验证GPC3-CAR-T的抗肿瘤活性→I期临床试验验证”。
4.2 研究过程详述
- AFP:
- 来源:临床血液样本(REACH-2试验中,患者入组标准为AFP≥400ng/mL);
- 验证方法:ELISA定量检测AFP水平;
- 结果:雷莫芦单抗组中位OS 8.5个月 vs 安慰剂组7.3个月(HR=0.71,P=0.0199),ORR 4.6% vs 1.1%,疾病控制率(DCR)59.9% vs 38.9%(P=0.0006)。
- FGF19:
- 来源:肿瘤组织(免疫组化)或血清(qRT-PCR);
- 验证方法:BLU-554试验中,FGF19阳性定义为“肿瘤组织FGF19表达水平高于正常肝组织阈值”;
- 结果:FGF19阳性患者ORR 17%(11/66),阴性患者ORR 0%,中位PFS 5.5 vs 2.8个月(HR=0.47,P=0.002)。
- GPC3:
- 来源:肿瘤组织(免疫组化);
- 验证方法:GPC3阳性定义为“细胞膜或细胞质染色强度≥2+”;
- 结果:preclinical研究中,GPC3-CAR-T对GPC3阳性HCC细胞(如HepG2、Huh7)有显著细胞毒性(LD50<1×10^6 cells);I期试验中,2例GPC3阳性患者达PR,1例达长期稳定(44个月)。
4.3 核心成果提炼
- AFP:首个HCC靶向治疗的疗效预测Biomarker,实现了“Biomarker驱动的精准治疗”——仅AFP≥400ng/mL的二线患者从雷莫芦单抗中受益,风险比HR=0.71(P=0.0199),样本量n=292。
- FGF19:首个FGFR4抑制剂的伴随诊断Biomarker,验证了“FGF19/FGFR4通路”在HCC中的驱动作用,FGF19阳性患者ORR 17%(11/66),阴性为0,为FGFR4抑制剂的临床应用提供了关键筛选工具。
- GPC3:首个HCC CAR-T治疗的特异性靶点,解决了CAR-T在实体瘤中的“靶点选择难题”(GPC3在HCC中高表达,正常组织不表达),I期试验中2例PR,1例长期稳定,为CAR-T治疗HCC的临床转化奠定了基础。
局限性与展望
目前Biomarker的局限性:(1)覆盖人群窄(如AFP仅适用于20%~30%HCC患者);(2)缺乏多组学验证(如基因组+蛋白组联合分析);(3)在研Biomarker(如TMB、PD-L1表达)的疗效预测价值未明确。未来方向:开发“多组学整合的Biomarker panel”(如结合AFP、FGF19、GPC3及肿瘤微环境指标),实现更精准的患者分层;探索“动态Biomarker”(如治疗过程中AFP的变化),实时监测疗效。
综上,本文不仅总结了HCC系统治疗的最新进展,更明确了“Biomarker驱动的精准治疗”是未来核心方向,为HCC的临床转化提供了关键参考。