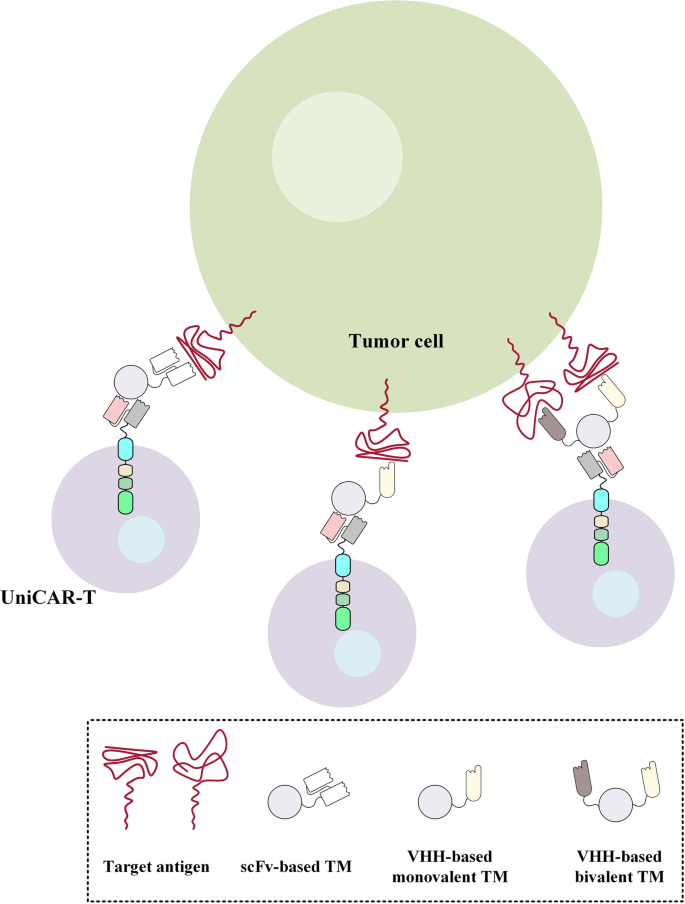
1. 领域背景与文献引入
文献英文标题:Nanobody-based CAR-T cells for cancer immunotherapy;发表期刊:Biomark Res;影响因子:未公开;研究领域:癌症免疫治疗(嵌合抗原受体T细胞疗法)。
CAR-T细胞疗法是基因工程与过继细胞治疗结合的革命性成果,其核心是通过基因编辑使T细胞表达嵌合抗原受体(CAR),从而特异性识别肿瘤抗原并介导杀伤。1993年Eshhar等首次提出CAR结构;2017年FDA批准首个CAR-T产品tisagenlecleucel(针对B细胞急性淋巴细胞白血病,B-ALL),标志着CAR-T进入临床;2022年FDA批准首个纳米抗体基CAR-T产品ciltacabtagene autoleucel(针对复发/难治性多发性骨髓瘤,MM),开启了纳米抗体在CAR-T中的应用新纪元。当前CAR-T研究的热点包括:优化CAR结构(如选择4-1BB或CD28共刺激域以调节T细胞功能、开发分泌细胞因子的第四代CAR)、解决实体瘤挑战(如肿瘤微环境的免疫抑制、靶点异质性导致的抗原逃逸)、探索替代靶向结构域(如纳米抗体、肽段)以克服传统单链可变片段(scFv)的局限性。
然而,传统scFv基CAR-T仍面临关键问题:scFv多为鼠源框架,易引发人体抗鼠抗体(HAMA)反应,降低CAR-T体内持久性;scFv的V_H和V_L结构域通过人工linker连接,易发生聚集,导致T细胞非抗原依赖性活化和耗竭;scFv的大尺寸(~25 kDa)可能影响CAR在T细胞表面的表达及对实体瘤的穿透能力。针对这些局限性,纳米抗体(源自骆驼科动物重链抗体的单域抗体,VHH)因低免疫原性、高稳定性、易人源化等优势,成为CAR靶向结构域的理想替代者。本文系统综述了纳米抗体作为CAR靶向结构域的优势,总结了针对不同肿瘤抗原的纳米抗体基CAR-T研究进展(包括体外、体内及临床研究),为CAR-T疗法的优化提供了新方向。
2. 文献综述解析
作者按“scFv基CAR-T的局限性→纳米抗体的优势→不同靶点的纳米抗体基CAR-T研究”的逻辑展开综述,核心评述如下:
现有研究的关键结论与局限性
现有研究证实:① scFv基CAR-T的主要瓶颈为免疫原性(鼠源框架引发HAMA)、scFv聚集导致T细胞耗竭、易发生抗原逃逸;② 纳米抗体具有低免疫原性(序列与人类V_H3家族高度同源,易人源化)、高稳定性(抗变性剂和蛋白酶)、小尺寸(~15 kDa,易穿透实体瘤)、能识别独特表位(如GPC2的Wnt3a结合位点)等优势;③ 纳米抗体基CAR-T在血液瘤(如MM、T细胞急性淋巴细胞白血病,T-ALL)和实体瘤(如神经母细胞瘤、肝癌)中显示出靶向细胞毒性,部分产品已进入临床(如BCMA靶向的LCAR-B38M)。
现有研究的局限性:① 多数研究仍处于细胞系或小动物模型阶段,临床数据有限;② 实体瘤研究中,纳米抗体基CAR-T对肿瘤微环境的适应能力(如免疫抑制因子的影响)仍需深入;③ 纳米抗体的长期安全性(如人源化后的免疫原性)尚未完全明确。
文献的创新价值
本文的创新在于系统整合了纳米抗体作为CAR靶向结构域的理论优势与临床数据:首次全面对比了scFv与纳米抗体的结构差异,明确了纳米抗体对scFv局限性的解决机制;汇总了10余种肿瘤抗原的纳米抗体基CAR-T研究,重点阐述了BCMA、CD7等靶点的临床疗效(如LCAR-B38M的ORR达88%);并探讨了纳米抗体基CAR-T在实体瘤中的应用潜力(如靶向肿瘤血管的CD105),为CAR-T的临床转化提供了全面参考。
3. 研究思路总结与详细解析
本文为综述性研究,通过系统检索PubMed、Web of Science等数据库的相关文献,按主题分类论述纳米抗体基CAR-T的研究进展,核心环节如下:
3.1 scFv基CAR-T的局限性分析
实验目的:明确传统CAR-T的瓶颈,为纳米抗体的应用提供依据。
方法细节:回顾已发表的临床和基础研究,分析scFv的结构缺陷(如鼠源框架、人工linker)引发的问题。
结果解读:① 免疫原性:scFv的鼠源框架易引发HAMA反应,如Gruber等报道结直肠癌患者使用鼠源mAb CO17-1A后出现HAMA;② 聚集导致耗竭:scFv的linker易导致结构域聚集,Long等发现scFv聚集会触发T细胞非抗原依赖性活化,导致T细胞耗竭;③ 实体瘤穿透能力弱:scFv的大尺寸可能影响CAR在T细胞表面的表达,降低对实体瘤的穿透效率。
产品关联:文献未提及具体实验产品,领域常规使用鼠源或人源化scFv构建CAR,通过慢病毒载体转导T细胞。
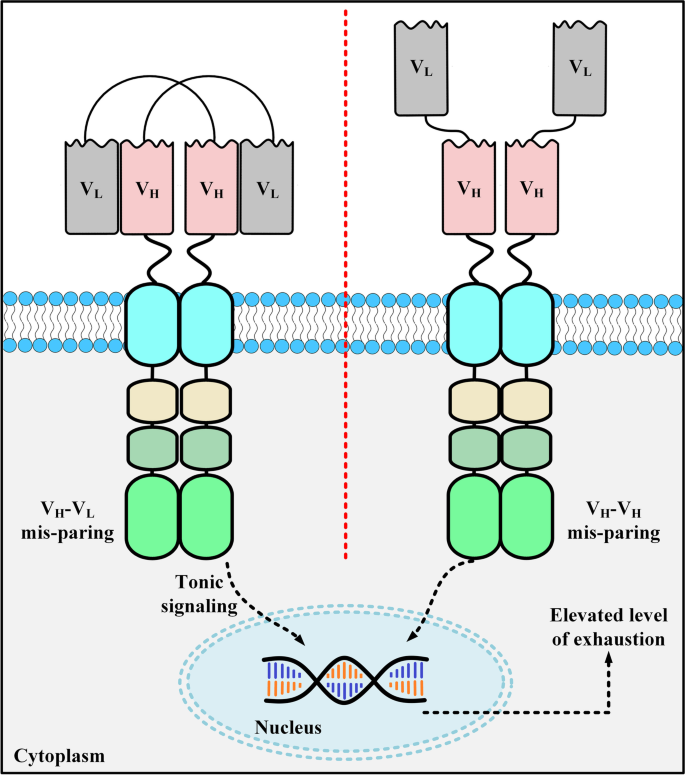
3.2 纳米抗体的优势解析
实验目的:阐述纳米抗体作为CAR靶向结构域的合理性。
方法细节:对比纳米抗体与scFv的结构和功能差异。
结果解读:① 低免疫原性:纳米抗体为单域结构(无V_L和linker),序列与人类V_H3高度同源(~80%),人源化仅需替换少数框架残基(如Vincke等开发的通用人源化纳米抗体 scaffold);② 高稳定性:纳米抗体能在60℃高温或尿素等变性剂中保持活性;③ 小尺寸:~15 kDa的大小使其能穿透实体瘤的致密间质,识别传统抗体无法触及的表位(如GPC2的Wnt3a结合位点);④ 避免聚集:单域结构消除了linker介导的聚集风险。
产品关联:文献未提及具体实验产品,领域常规使用噬菌体展示技术从骆驼科动物免疫库中筛选纳米抗体,或通过基因工程改造人源化纳米抗体。
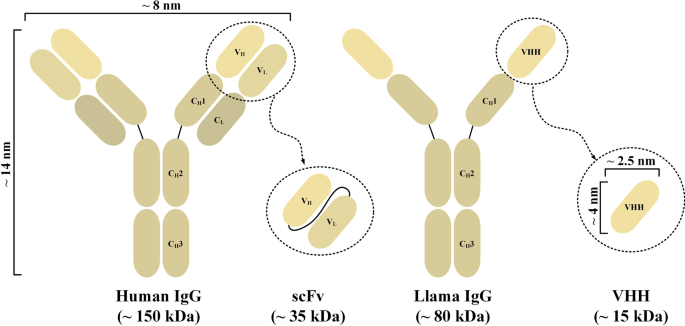
3.3 不同靶点的纳米抗体基CAR-T研究
实验目的:总结纳米抗体基CAR-T在不同肿瘤中的应用。
方法细节:按血液瘤(MM、T-ALL、B细胞非霍奇金淋巴瘤,B-NHL)和实体瘤(神经母细胞瘤、肝癌、乳腺癌)分类,回顾各靶点的研究数据。
结果解读:
- 血液瘤:BCMA是MM的关键靶点,纳米抗体基CAR-T(如LCAR-B38M、ciltacabtagene autoleucel)在临床中显示高响应率,Zhao等报道的I期试验(NCT03090659)中,57例MM患者的客观缓解率(ORR)达88%,完全缓解(CR)率68%;CD7是T-ALL的靶点,Zhang等的I期试验(NCT04004637)中,8例患者的ORR达100%,CR率75%,且细胞因子释放综合征(CRS)反应轻微(仅2例出现2级CRS)。
- 实体瘤:GPC2是神经母细胞瘤的靶点,Li等的研究显示,GPC2纳米抗体基CAR-T能抑制IMR5细胞生长(体外杀伤率达60%),并在体内模型中降低肿瘤负荷(小鼠肿瘤重量减少70%);CD105是肝癌的靶点,Mo等的研究显示,CD105纳米抗体基CAR-T能杀伤Bel7404肝癌细胞(体外杀伤率达50%),并抑制体内肿瘤生长(肿瘤体积缩小60%)。
产品关联:部分研究使用慢病毒载体转导T细胞(如Li等用慢病毒表达GPC2纳米抗体CAR),或CRISPR/Cas9技术(如Mo等用CRISPR构建CD105纳米抗体基CAR-T),文献未提及具体品牌产品。
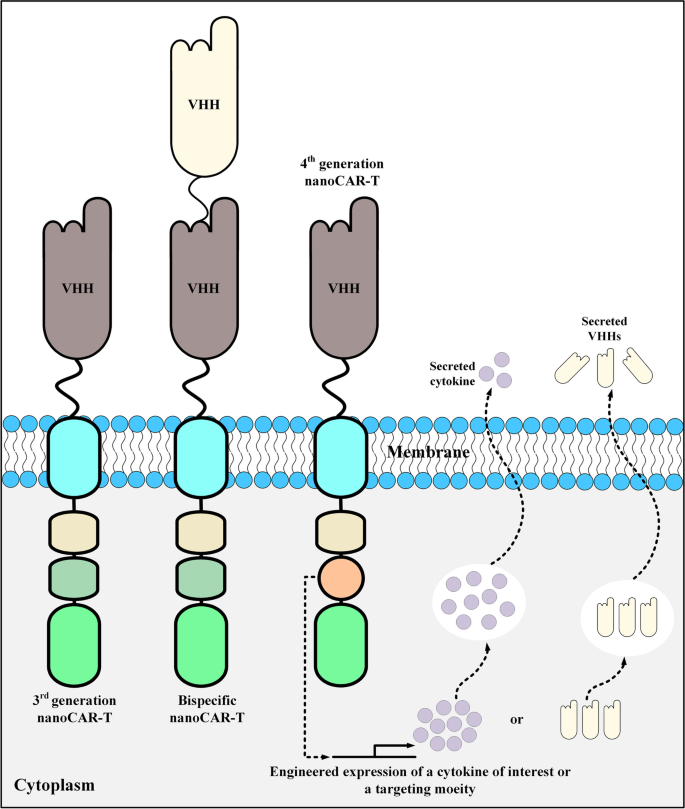
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为肿瘤相关抗原(TAA),包括血液瘤靶点(BCMA、CD7、CD20、CD38、CD33)和实体瘤靶点(GPC2、HER2、EGFR、CD105、EIIIB、PD-L1),筛选逻辑多为“临床样本分析→体外细胞验证→体内模型验证→临床 trials”,验证方法包括流式细胞术、CAR-T体外细胞毒性实验(LDH释放法)、体内异种移植瘤模型、临床疗效评估(如ORR、CR率)。
关键Biomarker的研究过程与成果
- BCMA(多发性骨髓瘤):
- 定位与筛选:BCMA是MM恶性浆细胞表面的TAA,通过临床样本分析发现其高表达,与患者不良预后相关。
- 验证方法:体外实验显示BCMA纳米抗体基CAR-T能杀伤LP-1、RPMI 8226等MM细胞系(杀伤率达70%);体内模型显示CAR-T能抑制MM异种移植瘤生长(肿瘤体积缩小80%);临床I期试验(NCT03090659)显示,57例患者的ORR达88%,CR率68%(n=57,P<0.01)。
核心成果:BCMA纳米抗体基CAR-T(如LCAR-B38M、ciltacabtagene autoleucel)是首个获批的纳米抗体基CAR-T产品,为MM患者提供了新的治疗选择,其创新性在于采用双表位靶向(识别BCMA的两个不同表位),降低抗原逃逸风险。
CD7(T细胞急性淋巴细胞白血病):
- 定位与筛选:CD7在T-ALL细胞上高表达,而在正常T细胞上低表达,通过临床样本分析确定为靶点。
- 验证方法:临床I期试验(NCT04004637)显示,8例患者的ORR达100%,CR率75%(n=8,P<0.05),且CRS反应轻微(仅2例出现2级CRS)。
核心成果:CD7纳米抗体基CAR-T通过基因编辑敲除T细胞表面的CD7,解决了T-ALL中CAR-T的“ fratricide”(自相残杀)问题,显示出高效且安全的临床疗效。
GPC2(神经母细胞瘤):
- 定位与筛选:GPC2在神经母细胞瘤中高表达,通过临床样本分析与患者不良预后相关。
- 验证方法:体外实验显示GPC2纳米抗体基CAR-T能抑制IMR5细胞生长(杀伤率达60%);体内模型显示CAR-T能降低肿瘤负荷(小鼠肿瘤重量减少70%);且纳米抗体能抑制GPC2与Wnt3a的结合,阻断β-catenin信号通路。
- 核心成果:首次发现GPC2作为神经母细胞瘤的CAR-T靶点,纳米抗体基CAR-T不仅能直接杀伤肿瘤细胞,还能抑制肿瘤细胞信号通路,具有双重作用。
成果总结
本文涉及的Biomarker均为肿瘤细胞或肿瘤微环境中的特异性抗原,纳米抗体基CAR-T通过靶向这些抗原,实现对肿瘤细胞的特异性杀伤。其中,BCMA、CD7等靶点的纳米抗体基CAR-T已进入临床并取得显著疗效,GPC2、CD105等靶点为实体瘤CAR-T治疗提供了新方向。纳米抗体的优势(如低免疫原性、高稳定性)显著提升了CAR-T的体内持久性和安全性,为CAR-T疗法的广泛应用奠定了基础。