1. 领域背景与文献引入
文献英文标题:Nuclear transcription factors in mammalian mitochondria;发表期刊:Genome Biology;影响因子:未公开;研究领域:线粒体基因表达调控。
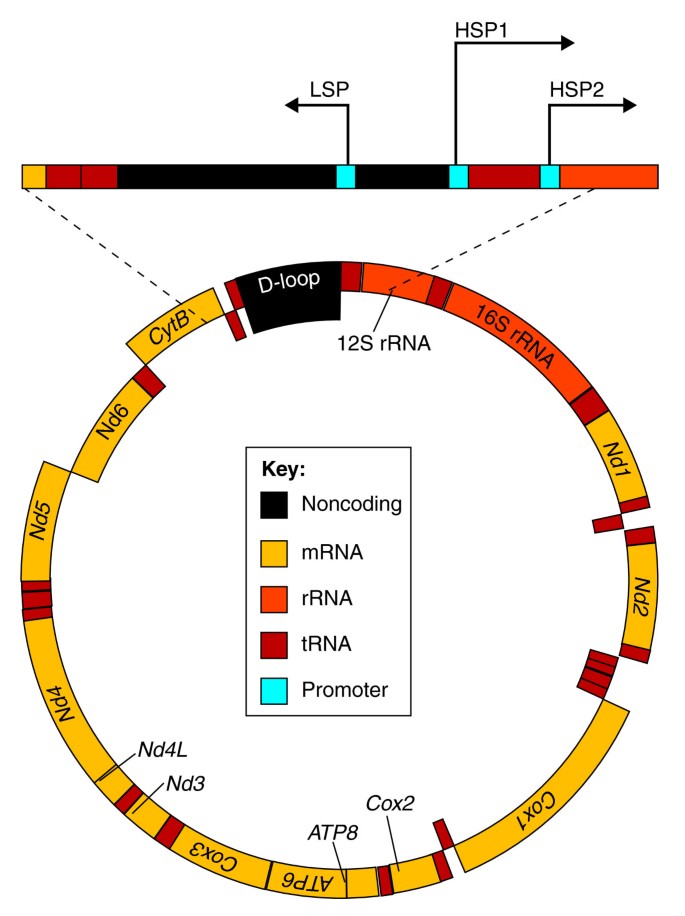
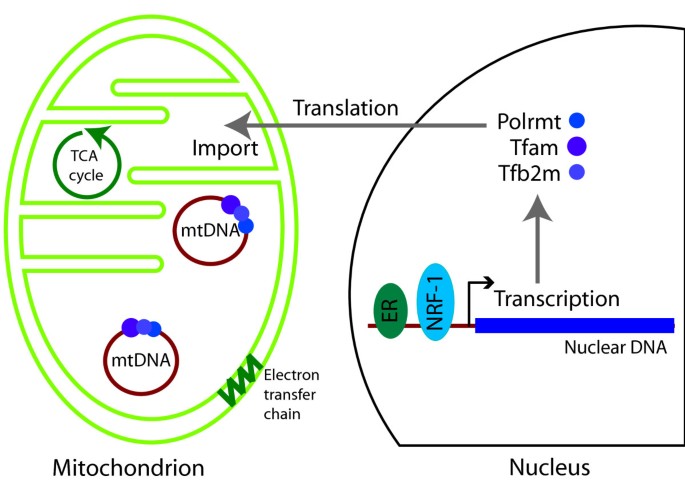
线粒体是真核细胞能量代谢的核心细胞器,通过氧化磷酸化生成ATP,其功能依赖核基因组与线粒体基因组的协同——核基因组编码约99%的线粒体蛋白(如基础转录机器:Tfam、Tfb2m、Polrmt),而线粒体基因组(约16.5 kb)编码13个氧化磷酸化关键蛋白、22个tRNA及2个rRNA,需在基质中完成转录翻译。尽管线粒体功能调控对细胞生存至关重要,但相较于核基因表达,线粒体基因表达的调控机制研究滞后,核心问题在于:核转录因子是否可绕过核基因表达,直接定位于线粒体调控基因表达?早期研究发现多个核转录因子(如糖皮质激素受体、p53、甲状腺激素受体)定位于线粒体,但由于技术限制(如难以区分间接调控与直接调控),其直接作用的机制及生理意义仍不明确。此外,线粒体功能异常与衰老、癌症(代谢重编程)、糖尿病(胰岛素抵抗)等疾病密切相关,但核转录因子的线粒体功能在疾病中的作用尚未系统解析。
针对这一研究缺口,本文综合综述了区分核转录因子核功能与线粒体功能的技术体系,并深入分析了5个well-characterized的核转录因子(甲状腺激素受体p43、环AMP响应元件结合蛋白(CREB)、肿瘤抑制因子p53、信号转导与转录激活因子3(Stat3)、雌激素受体)的线粒体作用机制,为线粒体功能调控及疾病关联研究提供了关键框架。
2. 文献综述解析
作者对现有研究的分类维度主要基于核转录因子的作用方式(间接调控核基因表达进而影响线粒体功能 vs 直接定位于线粒体调控基因表达)及技术方法的应用阶段(定位验证→功能独立性验证→DNA结合验证)。
现有研究的关键结论包括:1)早期研究通过亚细胞分离、免疫印迹等技术,发现糖皮质激素受体、p53、甲状腺激素受体等核转录因子可定位于线粒体;2)核转录因子可能通过结合线粒体DNA(如p43结合甲状腺激素响应元件(T3REs))或与线粒体蛋白相互作用(如p53与Tfam结合),直接调控基因表达或DNA修复;3)染色质免疫沉淀(ChIP)、电泳迁移率变动分析(EMSA)、in organello转录分析等技术为验证直接作用提供了工具,但存在明显局限性——例如,ChIP依赖抗体特异性(某磷酸化CREB抗体因交叉反应丙酮酸脱氢酶导致线粒体定位假阳性),EMSA难以反映体内生理状态,in organello实验需严格排除核污染。
本研究的创新价值在于:1)系统总结了区分核与线粒体功能的技术体系(Table 1),为后续研究提供方法学指导;2)聚焦5个典型核转录因子,深入解析其线粒体作用机制,填补了线粒体转录调控研究中“直接作用”案例不足的空白;3)强调了核转录因子线粒体功能的组织特异性(如p43在肝线粒体为直接调控,而心脏中为间接调控),为疾病研究提供了组织特异性视角。
3. 研究思路总结与详细解析
3.1 整体框架与技术路线
研究目标是综合探讨核转录因子在哺乳动物线粒体中的直接作用及机制,核心科学问题是“核转录因子如何不依赖核基因表达直接调控线粒体功能”,技术路线为“综述技术方法→分析典型案例→总结未来方向”。
3.2 区分核与线粒体作用的技术方法解析
实验目的是建立一套可验证核转录因子线粒体直接作用的技术体系,涵盖三个层面:
定位验证:通过差速离心分离线粒体(富集标记:细胞色素c氧化酶亚基IV(COX IV)),结合免疫印迹(检测因子是否存在于线粒体组分)、免疫电镜(可视化定位)——例如,分离大鼠脑线粒体后,免疫电镜显示CREB定位于基质。
功能独立性验证:in organello转录分析——使用分离的线粒体(排除核污染),加入因子或配体(如甲状腺激素),检测线粒体基因表达变化——例如,向甲状腺功能减退大鼠的肝线粒体加入p43与T3,可恢复mRNA/rRNA比值至正常水平。
DNA结合验证:ChIP(使用线粒体特异性抗体富集DNA,验证体内结合)、EMSA(体外验证因子与线粒体DNA探针的结合)、报告基因分析(将线粒体DNA元件插入核报告载体,验证因子的响应性)——例如,ChIP实验显示CREB可结合线粒体D-loop区域的CRE元件(序列:TGACGTCA)。
结果解读:技术需联合应用以避免假阳性——某核转录因子需同时满足“定位于线粒体”“in organello实验中调控基因表达”“结合线粒体DNA”,才能证明直接作用。技术局限性包括:抗体特异性(如pCREB抗体的交叉反应)、in organello实验的线粒体完整性(需检测膜电位)、ChIP的线粒体DNA富集效率(低于核DNA)。
产品关联:实验中使用的关键工具包括线粒体分离试剂盒(领域常规使用Sigma-Aldrich的Mitochondria Isolation Kit for Tissue)、ChIP-grade抗体(如Abcam的Tfam抗体ab131607)、EMSA探针(定制合成线粒体D-loop区域序列)。
3.3 核转录因子线粒体功能案例分析
3.3.1 甲状腺激素受体p43
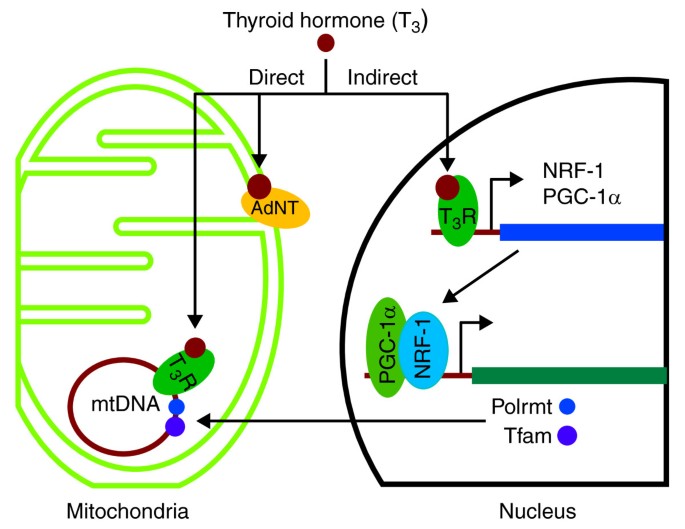
实验目的是研究甲状腺激素(T3)对线粒体转录的直接调控机制。
方法细节:1)构建T3Rα截短体(p43,缺失N端),使用分离的大鼠肝线粒体验证导入途径(是否依赖TOM复合物、ATP);2)in organello实验中,向甲状腺功能减退大鼠的肝线粒体加入p43与T3,检测mRNA/rRNA比值;3)EMSA验证p43与线粒体DNA T3REs的结合。
结果解读:p43是T3Rα的截短体(翻译自替代起始密码子),其线粒体导入不依赖TOM复合物及ATP,且无信号肽切割(与酵母MTF1途径一致);in organello实验中,p43与T3共同刺激线粒体基因转录(mRNA/rRNA比值升高至正常水平),而单独T3无作用;EMSA显示p43可结合线粒体D-loop区域的T3REs。此外,p43的组织特异性明显——肝线粒体中为直接调控,而心脏线粒体中T3通过调控核基因(如Tfam)间接影响功能。
产品关联:线粒体导入实验使用的大鼠肝线粒体分离自正常或丙硫氧嘧啶(PTU)诱导的甲状腺功能减退大鼠(文献未提及具体试剂品牌)。
3.3.2 环AMP响应元件结合蛋白(CREB)
实验目的是验证CREB对线粒体基因表达的直接调控。
方法细节:1)分离大鼠脑线粒体,通过免疫电镜检测CREB定位;2)构建线粒体特异性CREB过表达载体(靶向基质定位信号),转染原代神经元,检测线粒体基因(如NADH脱氢酶亚基2、4、5)表达;3)ChIP检测CREB与线粒体D-loop区域CRE元件的结合。
结果解读:CREB定位于大鼠脑线粒体基质,且不依赖经典定位信号(可能通过分子伴侣mtHSP70导入);线粒体特异性过表达CREB可上调NADH脱氢酶亚基2、4、5的mRNA(不影响核基因c-fos),而显性负突变体(阻断DNA结合)则下调其表达;ChIP实验显示,CREB结合依赖线粒体PKA的磷酸化(Ser133)。
产品关联:ChIP实验使用的CREB抗体(如Cell Signaling Technology的9197S)需验证线粒体特异性(文献未明确提及)。
3.3.3 肿瘤抑制因子p53
实验目的是研究p53在线粒体中的非转录功能(DNA修复)。
方法细节:1)分离HCT116细胞(p53+/+ vs p53-/-)线粒体,免疫印迹检测p53;2)co-IP分析p53与线粒体蛋白Tfam、mtPOLγ的相互作用;3)in vitro DNA修复实验——使用线粒体提取物(含mtPOLγ),加入p53,检测DNA缺口填充效率。
结果解读:p53定位于线粒体基质,与Tfam相互作用增强其对顺铂损伤DNA的结合(抑制对氧化损伤DNA的结合);与mtPOLγ相互作用刺激其DNA合成功能(缺口填充效率升高2倍);p53-/-细胞线粒体DNA完整性下降(氧化损伤积累)。此外,p53的线粒体功能不依赖核转录(突变体仍可刺激mtPOLγ)。
产品关联:co-IP实验使用的Tfam抗体(ab131607)、mtPOLγ抗体(Santa Cruz的sc-515038)为领域常规使用(文献未明确提及)。
4. Biomarker研究及发现成果解析
本文为综述性研究,未聚焦传统诊断/预后Biomarker,而是将核转录因子本身作为线粒体功能调控的分子标志物——其线粒体定位、结合状态及功能活性,可反映线粒体基因表达的调控状态。
4.1 Biomarker定位与筛选逻辑
核转录因子(如p43、CREB、p53)作为线粒体基因表达的直接调控因子,其筛选需遵循“定位验证→功能独立→DNA结合”的三步骤逻辑:
- 定位验证:通过亚细胞分离+免疫印迹/免疫电镜,确认因子定位于线粒体(如p43在肝线粒体的基质中);
- 功能独立:in organello实验验证,因子可不依赖核基因表达调控线粒体基因(如CREB过表达上调NADH脱氢酶基因);
- 分子结合:通过ChIP/EMSA验证,因子可结合线粒体DNA或与线粒体蛋白相互作用(如p53与Tfam结合)。
4.2 核心成果与疾病意义
- 功能关联:核转录因子的线粒体功能直接调控线粒体基因表达——如CREB过表达上调NADH脱氢酶亚基2、4、5的mRNA,p53缺失导致线粒体DNA损伤;
- 组织特异性:Biomarker具有组织特异性——如p43仅在肝线粒体发挥直接调控作用,心脏中为间接调控;
- 疾病相关性:Biomarker的功能异常与疾病密切相关——如p53的线粒体DNA修复功能缺陷,可能导致癌症细胞线粒体突变积累(代谢重编程);雌激素受体的线粒体功能异常,可能参与乳腺癌的激素抵抗。
创新性:首次将核转录因子作为“线粒体功能调控的分子标志物”,而非传统“检测型Biomarker”,为疾病的线粒体靶向治疗提供了新靶点——例如,针对p43的甲状腺激素类似物可治疗肝代谢疾病。
关键图片展示
哺乳动物线粒体基因组的组织(Figure 1):
哺乳动物线粒体结构及核转录因子调控(Figure 2):
甲状腺激素调控线粒体功能的直接与间接途径(Figure 3):