1. 领域背景与文献引入
文献英文标题:E2F mediates enhanced alternative polyadenylation in proliferation;发表期刊:Genome Biology;影响因子:2012年约10.8;研究领域:RNA选择性多聚腺苷酸化(APA)与细胞增殖调控。
选择性多聚腺苷酸化是真核基因表达调控的关键层面——约50%的哺乳动物基因通过APA产生3"非翻译区(3"UTR)长度不同的转录本异构体。3"UTR作为microRNA(miRNA)和RNA结合蛋白的核心作用平台,其长度变化直接调控mRNA的稳定性、翻译效率及亚细胞定位。近年来研究发现,细胞增殖与肿瘤转化中存在全局3"UTR缩短现象(即偏好使用3"UTR近端的多聚腺苷酸化位点,CSs),但这一现象的调控机制始终未明确。此前研究多基于表达芯片技术,仅能分析预定义的CSs,无法检测低丰度或新的APA事件,更难以解析调控网络。
本研究针对“增殖相关APA增强的分子机制”这一核心问题,采用高分辨率3"-Seq技术,系统分析原代成纤维细胞(BJ)和非转化上皮细胞(MCF10A)在增殖、生长停滞、肿瘤转化三种状态下的APA事件,首次揭示E2F转录因子通过调控3"末端加工基因的表达,介导增殖过程中的APA增强。
2. 文献综述解析
文献综述围绕“APA的功能意义与机制研究现状”展开,核心评述逻辑可分为三类:
(1)现有研究的核心结论
- APA与生理/病理过程的关联:Sandberg等(2008)首次报道增殖状态下全局3"UTR缩短,涉及多个细胞类型;Mayr等(2009)发现肿瘤转化也伴随3"UTR缩短,且程度超过增殖本身的影响。
- 技术局限性:现有研究多基于表达芯片,仅能分析预定义的CSs(来自EST数据库),无法检测低丰度CSs(如内含子CSs),更难以解析APA的动态变化。
- 机制空白:增殖相关APA的调控因子未知,APA与增殖的因果关系尚未阐明。
(2)本研究的创新价值
- 技术突破:采用3"-Seq技术,实现单核苷酸分辨率的CSs鉴定,敏感检测低丰度CSs(如内含子CSs),解决了芯片技术的局限性。
- 模型系统:使用两个独立细胞模型(成纤维细胞+上皮细胞),涵盖增殖、停滞、转化三种状态,排除细胞类型特异性。
- 机制创新:首次揭示E2F转录因子通过调控3"末端加工基因的表达,介导增殖相关的APA增强,建立了“转录因子→3"加工机器→APA→增殖”的调控轴。
3. 研究思路总结与详细解析
本研究以“解析增殖过程中APA的动态变化及调控机制”为目标,核心科学问题是“增殖相关APA增强的分子调控机制”,技术路线为“3"-Seq检测APA事件→关联分析增殖/转化状态→机制探索(3"末端加工基因表达→E2F调控验证)→功能验证(E2F敲低对APA的影响)”。
3.1 3"-Seq文库构建与CSs鉴定
实验目的:建立高分辨率多聚腺苷酸化位点图谱,鉴定不同状态下的APA事件。
方法细节:收集BJ细胞(增殖、接触抑制停滞、RAS转化)和MCF10A细胞(增殖、血清饥饿停滞、RAS转化)的总RNA,用Qiagen Oligotex mRNA kit富集mRNA;热片段化后用Invitrogen SuperScript III反转录(使用P7-t25-vn oligo-dT引物),构建3"-Seq文库;通过Illumina Genome Analyzer/HiSeq测序,用Bowtie软件比对至人类基因组(hg18),允许2个错配,仅保留唯一比对的reads。通过检测reads中的非模板poly(A)尾(至少8个A,且前8个中有5个与基因组 mismatch)鉴定CSs,要求CSs至少有10条reads支持,且相邻CSs间距≥50nt。
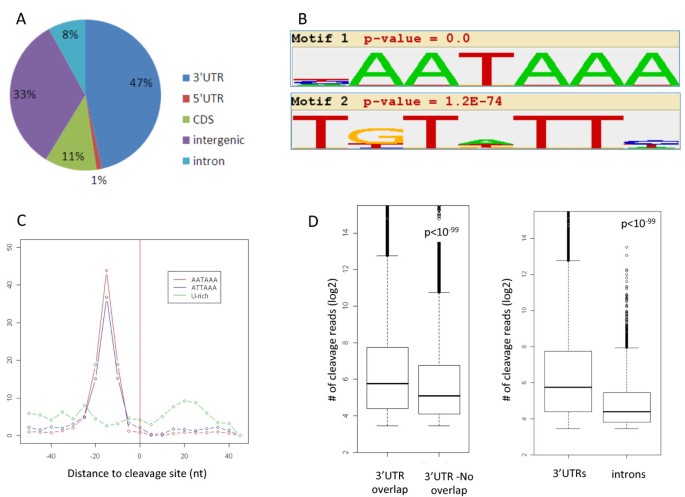
结果解读:共鉴定到43468个CSs,其中约50%定位于3"UTR,8%定位于内含子(Figure 1a)。3"UTR CSs中40%与polyA-DB数据库重叠,未重叠的CSs信号更弱;内含子CSs仅3%与数据库重叠,且信号弱于3"UTR CSs(Figure 1d),说明3"-Seq显著提高了低丰度CSs的检测敏感性。Motif分析显示,3"UTR和内含子CSs周围富含经典多聚腺苷酸化信号(PAS,AAUAAA)和下游U-rich辅助元件(Figure 1b-c),验证了CSs的真实性。
产品关联:实验所用关键产品:Qiagen RNeasy Mini kit(RNA提取)、Invitrogen SuperScript III反转录酶、Illumina测序平台、Bowtie比对软件。
3.2 增殖与APA的关联分析
实验目的:验证增殖状态对APA的调控作用,明确全局3"UTR缩短的普遍性。
方法细节:对BJ细胞(增殖vs接触抑制)和MCF10A细胞(增殖vs血清饥饿)的3"-Seq数据,计算近端多聚腺苷酸化位点使用指数(proximal PUI)(衡量近端CSs的相对使用强度);对含有多个3"UTR CSs的转录本,通过卡方检验(P<0.001)检测CSs使用的显著变化,并计算加权平均CS指数(
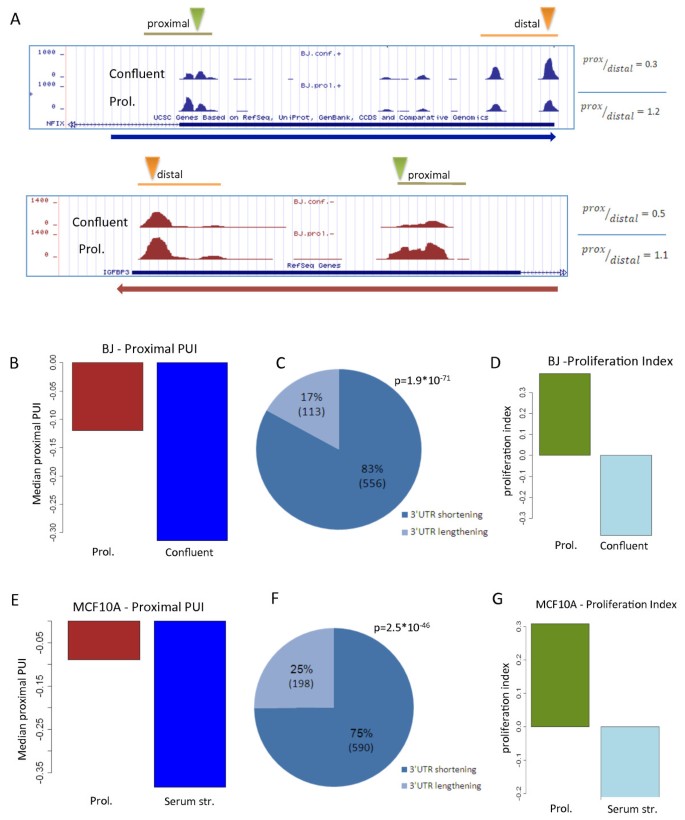
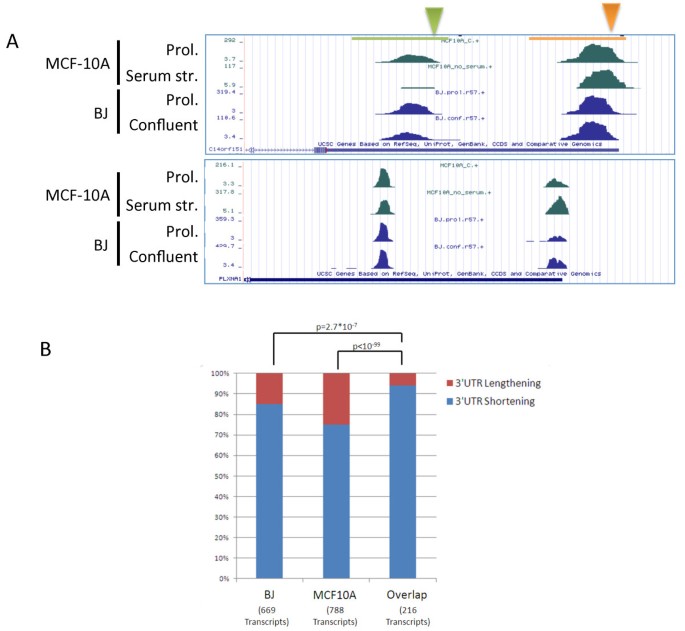
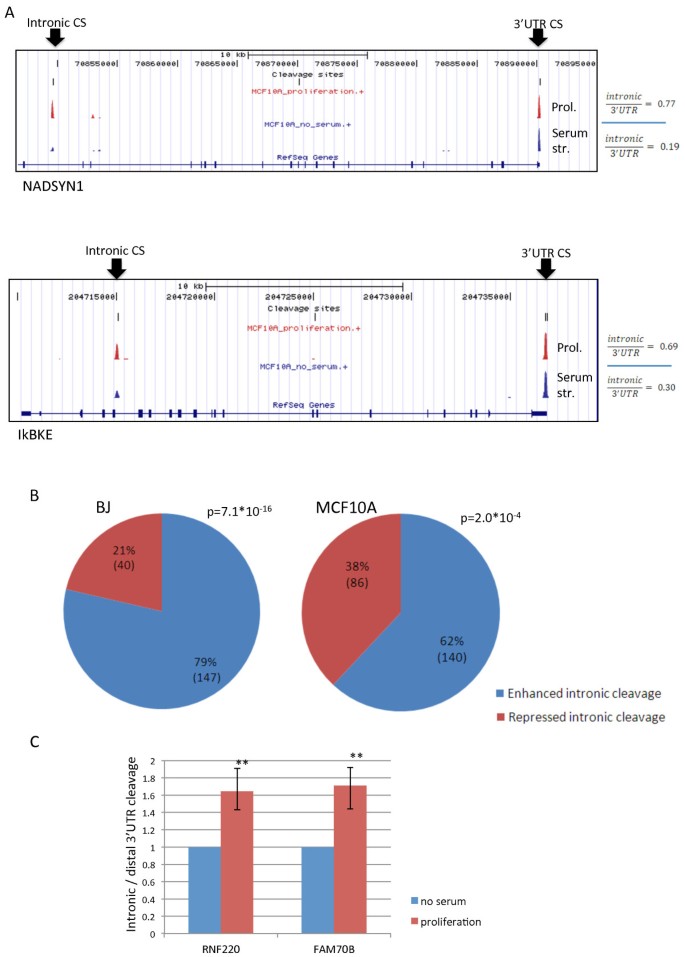
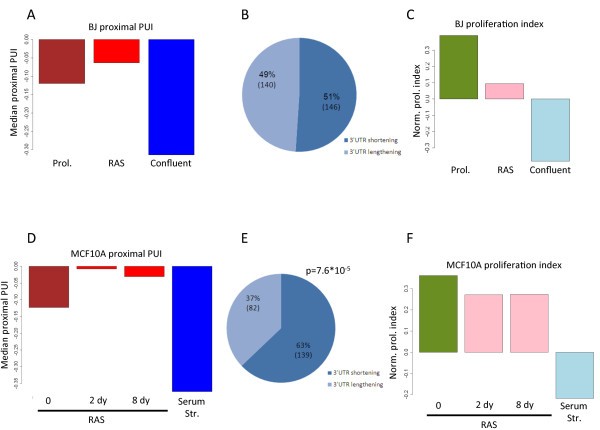
结果解读:BJ细胞中,8749个转录本含有3"UTR CSs,其中1934个有多个CSs;增殖状态下,83%的转录本(556/669)倾向使用近端CSs,proximal PUI显著升高(Figure 2a-c)。MCF10A细胞中,8835个转录本含有3"UTR CSs,1681个有多个CSs;增殖状态下75%的转录本(590/788)使用近端CSs,proximal PUI同样升高(Figure 2e-g)。两个模型的核心重叠集(216个转录本)中94%表现为增殖相关3"UTR缩短(Figure 3a-b),验证了现象的普遍性。此外,增殖状态下内含子CSs的使用显著增加(Figure 4a-b),通过3"-qRT-PCR验证了RNF220和FAM70B的内含子CSs使用增强(Figure 4c)。
3.3 转化与APA的关联分析
实验目的:比较增殖与转化对APA的影响,明确增殖是APA增强的主要驱动因素。
方法细节:用4-OHT诱导BJ细胞(p53/p16敲低+RASG12V)和MCF10A细胞(RASG12V)转化,收集0、2、8天的样本进行3"-Seq;分析转化状态下的proximal PUI和CSs使用变化,计算增殖指数(基于细胞周期基因的相对表达)。
结果解读:BJ细胞转化后,proximal PUI升高但程度弱于增殖(Figure 5a-b),且增殖指数略有下降(Figure 5c)。MCF10A细胞转化后,221个一致变化的转录本中63%使用近端CSs(Figure 5d-e),增殖指数同样下降(Figure 5f)。结果表明,转化相关的3"UTR缩短程度弱于增殖,增殖是APA增强的主要驱动因素。
3.4 E2F对3"末端加工基因的调控机制
实验目的:揭示增殖相关APA增强的分子机制,验证E2F的调控作用。
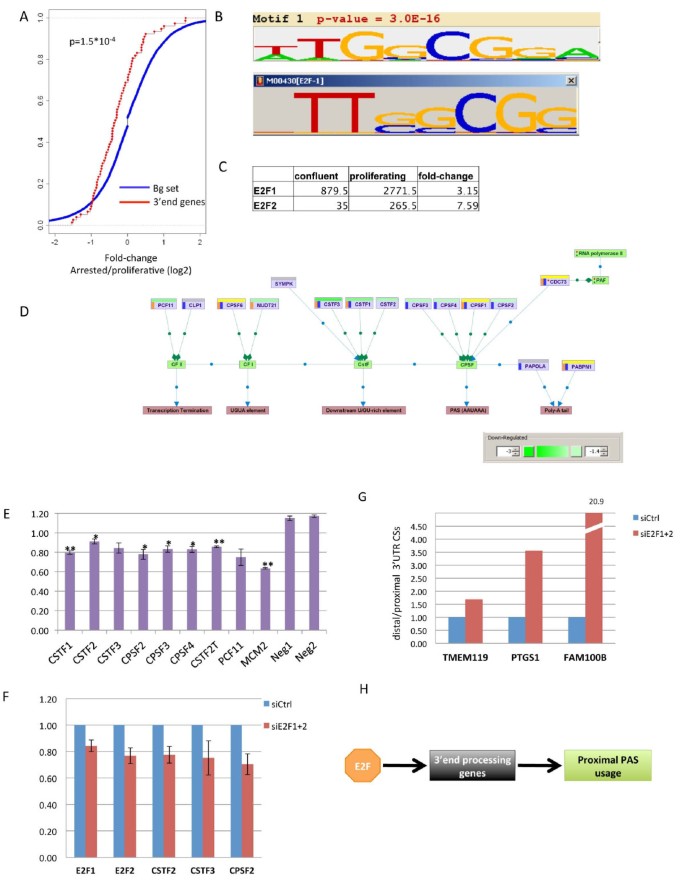
方法细节:1)表达分析:比较增殖与停滞状态下94个3"末端加工基因的表达变化(基于3"-Seq和独立RNA-Seq);2)Motif分析:用AMADEUS软件分析这些基因启动子的富集基序;3)ChIP-Seq验证:整合E2F1/4的ChIP-Seq数据,确认E2F结合;4)功能验证:E2F1敲低后,通过reporter assay检测启动子活性,qPCR检测3"末端加工基因的表达,3"-qPCR检测APA变化。
结果解读:增殖状态下,3"末端加工基因的表达显著升高(BJ细胞中P=0.00015,Figure 6a)。其启动子富含E2F结合基序(Figure 6b),且多个基因(如CPSF、CstF复合物成员)的启动子被E2F1/4结合(Figure 6d)。E2F1敲低显著降低8个3"末端加工基因的启动子活性(Figure 6e),E2F1+2敲低减少CSTF2、CSTF3、CPSF2的表达(Figure 6f),并增加3个转录本的远端CSs使用(Figure 6g)。结果证明,E2F通过调控3"末端加工基因的表达,介导增殖相关的APA增强(Figure 6h)。
4. Biomarker研究及发现成果解析
本研究的Biomarker为“增殖相关的APA事件”,包括“3"UTR近端CSs使用增加”和“内含子CSs使用增加”,是细胞增殖状态的分子特征。
(1)Biomarker定位与筛选逻辑
- 类型:增殖状态的分子标志(非传统诊断标志物)。
- 筛选/验证逻辑:通过3"-Seq检测两个细胞模型的增殖/停滞状态,鉴定一致的APA事件(3"UTR缩短、内含子CSs增加);通过功能验证(E2F敲低)确认其调控机制,确保特异性。
(2)研究过程与核心成果
- 来源与验证:Biomarker来源为BJ和MCF10A细胞的3"-Seq数据,验证方法包括:①proximal PUI定量(全局指标);②单个转录本的CSs使用变化(卡方检验,P<0.001);③3"-qRT-PCR验证内含子CSs的使用(如RNF220、FAM70B)。
- 特异性与敏感性:两个模型的核心重叠集(216个转录本)中94%表现为增殖相关3"UTR缩短;内含子CSs的使用增加在两个模型中均显著(BJ细胞P<0.05,MCF10A细胞P<0.01)。
- 功能关联:建立了“E2F→3"末端加工基因→APA→增殖”的调控轴,APA事件直接关联细胞增殖状态。
(3)创新与意义
本研究首次将APA事件作为增殖状态的分子标志,为增殖异常疾病(如癌症)的研究提供了新靶点。例如,靶向E2F或3"末端加工基因可调控APA,进而抑制肿瘤细胞增殖。
结论:本研究通过高分辨率3"-Seq技术,系统解析了增殖与转化过程中的APA事件,揭示了E2F介导的调控机制,为RNA调控与细胞增殖的研究提供了重要理论基础。
