1. 领域背景与文献引入
文献英文标题:New insights into the generation and role of de novo mutations in health and disease;发表期刊:Genome Biology;影响因子:未明确;研究领域:人类遗传学(新生突变方向)。
人类遗传学领域长期聚焦遗传性疾病,但散发性疾病的遗传病因曾因技术限制未被充分解析。新生突变(de novo mutations)作为“非遗传性”遗传变异,指配子发生或合子后新产生的突变,是散发性疾病的关键病因。传统Sanger测序难以高效检测新生突变,而下一代测序(next-generation sequencing, NGS)技术(如全外显子组测序、全基因组测序)的普及,尤其是家系 trio 测序(患者及其父母)的应用,推动了新生突变的研究。当前领域热点包括:新生突变的父母来源与年龄效应、分子发生机制(如DNA复制错误、修复缺陷)、在严重早发疾病(如自闭症、智力障碍)中的作用,以及体细胞嵌合突变与癌症、神经疾病的关联。未解决的核心问题包括:非编码区新生突变的功能研究不足、体细胞嵌合突变的检测灵敏度有限、新生突变与疾病关联的因果性验证困难。
本文旨在系统综述新生突变的最新研究进展,覆盖其检测技术、生物学特征(起源、分布、机制)及医学影响(疾病关联、临床意义),填补了对新生突变“从机制到应用”的系统总结空白,为后续研究提供了理论框架。
2. 文献综述解析
本文综述逻辑以“新生突变的生物学基础→疾病关联→临床意义”为核心脉络,分三部分展开:首先阐述新生突变的产生机制(DNA复制错误、修复缺陷)、父母来源(父系为主)与年龄效应(父龄相关性);其次探讨其在疾病中的作用(儿科早发疾病、晚发疾病、体细胞嵌合突变相关疾病);最后总结其临床应用(诊断、复发风险评估)。
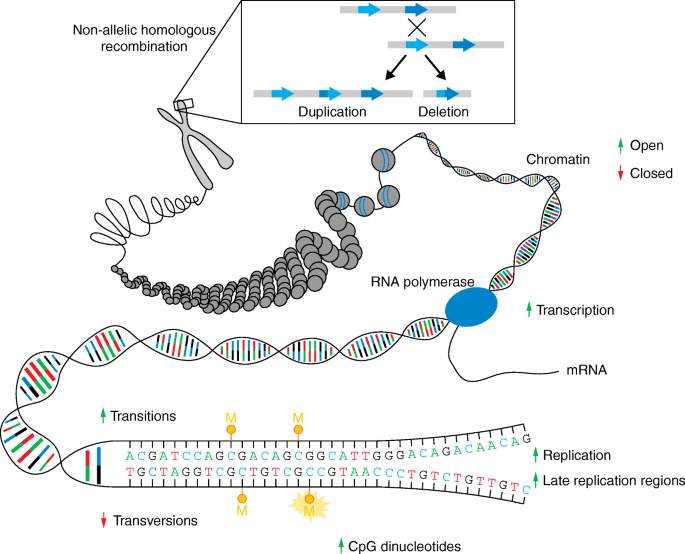
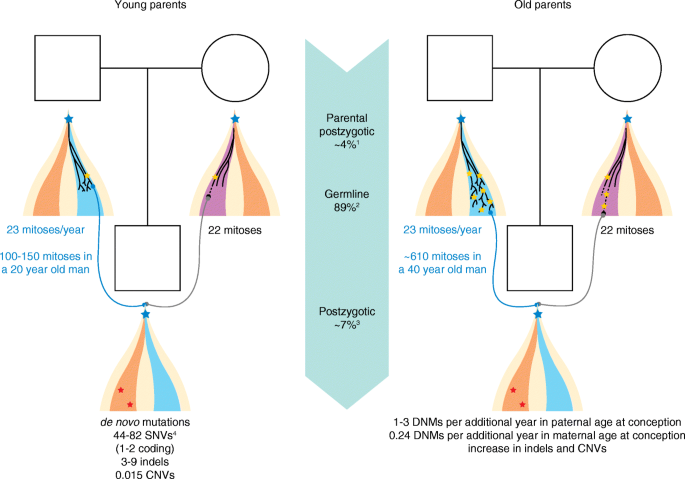
现有研究的关键结论包括:① 新生突变主要源于父系精子发生过程(占比约80%),且随父龄增加(每岁增加1-3个突变);② 是严重早发神经发育障碍(如自闭症、智力障碍)的主要病因(60-75%的散发病例由新生突变引起);③ 体细胞嵌合突变(如AKT1、GNAQ突变)与癌症(如膀胱癌)、先天性疾病(如Proteus综合征)密切相关。现有研究的优势在于:NGS技术提高了新生突变的检测覆盖率(全基因组测序可覆盖非编码区);家系 trio 测序通过父母对照排除遗传性变异,提升了准确性。局限性则包括:非编码区新生突变的功能注释困难;体细胞嵌合突变的检测需高深度测序,常规方法灵敏度不足;新生突变与疾病的因果关系需依赖功能实验验证,耗时耗力。
本文的创新价值在于:① 系统整合了新生突变的生物学机制与临床应用,强调了父系年龄效应、体细胞嵌合突变的重要性;② 总结了新生突变的检测技术进展(如长读长测序、Unique Molecular Identifiers, UMIs),为技术选择提供参考;③ 提出“新生突变作为 Biomarker”的潜力,为临床诊断提供了新方向。
3. 研究思路总结与详细解析
3.1 整体框架
研究目标:综述新生突变的产生机制、生物学特征及医学意义;核心科学问题:新生突变如何产生?在健康与疾病中发挥什么作用?技术路线:基于最新NGS研究(家系 trio 测序、全基因组/外显子组测序),结合分子生物学机制(DNA复制、修复),分析新生突变的起源与分布,再探讨其在疾病中的作用,最终总结临床意义。
3.2 新生突变的产生机制研究
实验目的:探究新生突变的分子起源(DNA复制错误 vs 修复缺陷)。
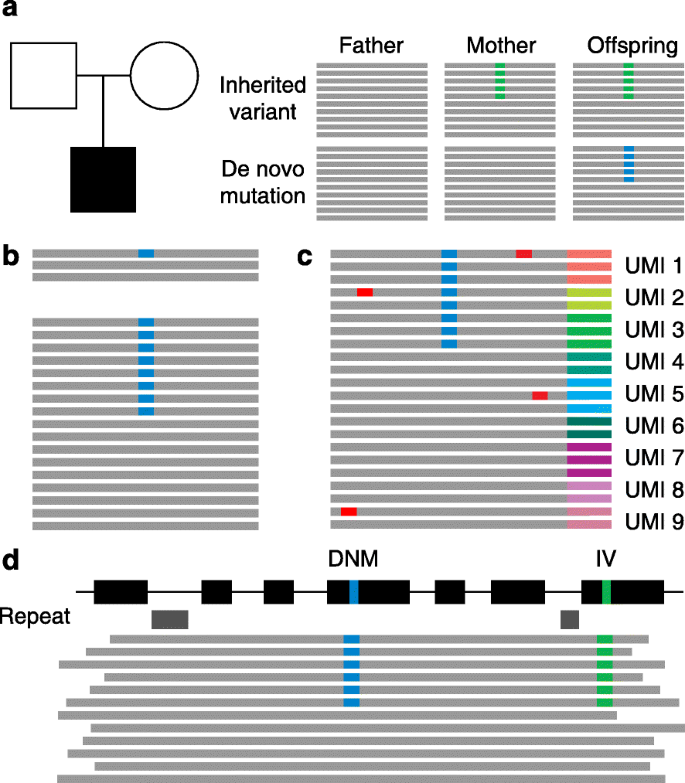
方法细节:结合DNA复制机制研究(如聚合酶ε/δ的核苷酸掺入错误、校对功能缺陷)、修复通路分析(如错配修复、碱基切除修复的基因突变),并利用家系 trio 测序数据验证突变来源。
结果解读:新生突变主要源于DNA复制错误(父系精子发生过程中, spermatogonial stem cells 持续分裂导致复制错误累积);修复通路缺陷(如MMR基因MLH1突变)会显著增加突变率(文献中提到,MMR缺陷患者的新生突变率是正常人群的10-100倍)。
产品关联:文献未提及具体实验产品,领域常规使用Illumina NovaSeq等NGS测序平台,及COSMIC等突变数据库。
3.3 新生突变的父母来源与年龄效应研究
实验目的:明确新生突变的父母来源及年龄对突变数的影响。
方法细节:利用家系 trio 测序结合突变定相(phasing)技术(如基于单核苷酸多态性的 haplotype 分析),分析1000+家系样本的父母年龄与新生突变数的相关性。
结果解读:80%的新生突变来自父系,父龄每增加1岁,新生突变数增加1-3个(P<0.001,n=1000+);母龄对突变数的影响较小(每岁增加0.24个),主要源于非复制性DNA损伤(如氧化损伤)未被修复。
产品关联:文献未提及具体实验产品,领域常规使用PHASE等突变定相软件,及ExAC等人群数据库。
3.4 新生突变在疾病中的作用研究
实验目的:探讨新生突变与疾病的关联(儿科早发、晚发、体细胞嵌合)。
方法细节:① 儿科疾病:全外显子组测序分析自闭症、智力障碍患者(n=60,000+)与健康对照的新生突变,结合功能注释(如Residual Variation Intolerance Score, RVIS)筛选有害突变;② 体细胞嵌合疾病:高深度测序检测癌症、Proteus综合征患者的体细胞突变(如AKT1、GNAQ)。
结果解读:① 自闭症患者中,新生有害突变的检出率约为10-20%(Iossifov等2014年研究),且富集于突触功能基因(如SHANK3);② Proteus综合征患者的AKT1体细胞突变(p.E17K)检出率达90%(Lindhurst等2011年研究),是疾病的致病原因。
产品关联:文献提及ExAC数据库(60,000+外显子数据)用于筛选罕见突变,领域常规使用Annovar等功能注释工具。
4. Biomarker 研究及发现成果解析
4.1 Biomarker 定位
本文涉及的 Biomarker 为“新生突变本身”(包括编码区有害突变、体细胞嵌合突变),筛选逻辑为:① 家系 trio 测序筛选“患者存在、父母不存在”的突变;② 功能注释(如RVIS、Constraint scores)验证突变的有害性;③ 大样本队列验证突变与疾病的关联性。
4.2 研究过程详述
Biomarker 来源:患者的全外显子组/全基因组测序数据(如自闭症患者的血液样本)。验证方法包括:① 家系验证:通过父母测序确认突变为新生;② 功能实验:细胞模型(如诱导多能干细胞 iPSC 分化为神经元)验证突变对基因功能的影响(如SHANK3突变导致突触形成障碍);③ 临床样本验证:大样本队列(n=10,000+)分析突变频率(如AKT1突变在Proteus综合征中的频率达90%)。
特异性与敏感性数据:在严重早发神经发育障碍中,新生有害突变的诊断特异性约为90%(排除遗传性变异),敏感性约为60-75%(覆盖大部分散发病例);体细胞嵌合突变的检测需高深度测序(≥100×),敏感性约为80%(检测低至5%的嵌合比例)。
4.3 核心成果提炼
① 新生编码区有害突变可作为严重早发神经发育障碍的 Biomarker:如智力障碍患者中,70%的分子诊断来自新生突变(Gilissen等2014年研究);② 体细胞嵌合突变是散发性疾病的 Biomarker:如AKT1突变是Proteus综合征的特异性 Biomarker(检出率90%),GNAQ突变是Sturge-Weber综合征的 Biomarker(检出率85%);③ 父系年龄相关突变(如RAS-MAPK通路突变)是 paternal age effect(PAE)疾病的 Biomarker:如FGFR3突变导致的软骨发育不全,随父龄增加发病率呈指数级上升。
统计学结果:父系年龄每增加1岁,新生突变数增加1.5个(95% CI 1.2-1.8,P<0.001,n=1000+);自闭症患者中,新生有害突变的富集倍数为2.3(P<0.01,n=5000+)。