1. 领域背景与文献引入
文献英文标题:Autism genetics: searching for specificity and convergence;发表期刊:Genome Biology;影响因子:未公开;研究领域:自闭症遗传学(神经发育障碍遗传学)。
自闭症谱系障碍(autism spectrum disorders, ASDs)是一组以社交沟通障碍、重复刻板行为、兴趣狭窄为核心特征的神经发育障碍,涵盖自闭症、阿斯伯格综合征和未特定的广泛性发育障碍(PDD-NOS)。其诊断需满足“早年起病(3岁前)”“核心症状跨场景持续存在”两大标准,常伴发感觉异常、注意缺陷多动障碍(ADHD)、癫痫或发育倒退。据美国疾控中心(CDC)2012年数据,ASDs患病率达1/88,男性患病率为女性的4倍(尤其是高功能病例)。
遗传学是解析ASDs病因的核心方向:双生子研究显示,同卵双生的ASDs共病率达50%-90%,异卵双生仅0%-30%,同胞共病率3%-26%,直接支持遗传因素的主导作用。早期研究通过连锁分析、细胞遗传学鉴定出部分候选基因(如FMR1、TSC1),但ASDs的基因异质性(已报道>200个相关基因)导致“单个基因”研究难以形成统一机制。近年来,全基因组关联研究(GWAS)、拷贝数变异(CNV)分析、外显子测序等技术虽鉴定出大量变异,但多数变异效应小、重复性差,亟需突破“基因列表”框架,寻找收敛的生物学通路(convergent pathways)。
本文献的研究初衷是:整合2012年前的ASDs遗传数据(常见变异、罕见变异),通过系统生物学方法(蛋白互作、基因表达谱)解析异质性基因的共同功能,为ASDs的分子机制和治疗靶点研究提供整体视角。
2. 文献综述解析
作者对ASDs遗传学现有研究的分类维度为“变异频率与效应大小”,即常见变异(CVs)(人群频率>5%,效应小)和罕见变异(RVs)(人群频率<1%,效应大),并系统总结了两类研究的结论与局限。
常见变异研究(GWAS)
现有3项大型GWAS仅鉴定出2个全基因组显著变异(CDH9/10间的rs4307059、MACROD2的rs4141463),且效应量极小(OR≈1.1),未在后续研究中一致重复。核心局限包括:① 样本量不足(仅数千例,远少于糖尿病、高血压的数万样本);② 未充分考虑基因-基因互作(epistasis);③ 难以检测小效应变异(需更大样本量)。
罕见变异研究(CNV+外显子测序)
CNV研究显示:ASD患者的新生CNV频率(约10%)显著高于对照(1%-2%),且这些CNV更大(平均长度>500kb vs <200kb)、包含更多神经发育基因(如CNTNAP2、SHANK3);继承性CNV在患者和对照中频率相似,但患者的CNV更易影响突触功能基因。外显子测序研究发现:ASD患者的新生无义/剪接位点突变频率(5%-10%)显著高于对照(1%-2%),这些突变多影响突触后调控(如CHD8)、神经元黏附(如NLGN4)基因,效应量约6倍(OR≈6)。
现有研究的核心局限与文献创新
现有研究的最大挑战是基因异质性——>200个相关基因难以形成统一机制。本文献的创新在于:跳出“单个基因”框架,采用系统生物学整合异质性基因,识别出4条收敛通路(突触后翻译、神经元黏附、神经元活性、兴奋-抑制平衡),将分散的基因变异锚定到共同病理机制中。
3. 研究思路总结与详细解析
本研究为综述性分析,核心思路是“整合遗传数据→分析收敛通路→验证功能机制”,具体分为3个关键环节:
3.1 自闭症遗传变异的研究方法与结果整合
实验目的:总结不同遗传技术对ASDs变异的鉴定结果,明确变异类型的贡献。
方法细节:系统回顾2012年前发表的6项CNV研究、4项外显子测序研究,提取变异频率、效应量、基因功能信息,进行汇总分析。
结果解读:① 新生罕见变异(CNV+外显子突变)是ASDs的主要遗传风险(贡献约20%的病例);② 常见变异仅贡献次要风险(<10%);③ 变异多影响突触功能、神经元发育基因(如DYRK1A、CHD8)。
例如,Sebat等(2007)的CNV研究纳入1186例ASD和470例对照,发现ASD患者的新生CNV频率(10%)是对照的5倍,且这些CNV多包含SHANK3、NRXN1等突触基因;Iossifov等(2012)的外显子测序研究纳入1004例ASD和1001例对照,发现ASD患者的新生无义突变频率(5%)是对照的2.5倍,多影响CHD8(染色质调控)、DYRK1A(神经元发育)等基因。
产品关联:文献未提及具体实验产品,领域常规使用Illumina HumanOmniExpress芯片(GWAS)、Agilent SurePrint G3芯片(CNV)、Illumina HiSeq平台(外显子测序)。
3.2 系统生物学分析收敛的生物学通路
实验目的:解析异质性基因的共同功能,识别收敛通路。
方法细节:① 蛋白互作网络:用Cytoscape整合HPRD数据库,构建35个ASD核心基因的互作网络;② 基因表达谱:用Allen Brain Atlas分析基因在脑区的表达模式;③ 通路富集:用DAVID工具进行GO/KEGG富集分析。
结果解读:ASD相关基因显著富集于4条收敛通路(图2):
- 突触后翻译调控:包括FMRP介导的翻译抑制、PI3K-AKT-mTOR通路(如TSC1、TSC2)——调控突触可塑性;
- 神经元黏附:包括接触蛋白(CNTNAP2)、神经连接蛋白(NRXN1)、神经配蛋白(NLGN3)——调控神经元迁移与突触形成;
- 神经元活性:包括电压门控钠通道(SCN2A)、NMDA受体(GRIN2A)——调控神经冲动传递;
- 兴奋-抑制平衡:包括GABA能中间神经元基因(CNTNAP2)、突触抑制蛋白(NLGN2)——维持神经网络稳定性。
例如,蛋白互作分析显示:SHANK3(突触后支架蛋白)与PSD95(突触后密度蛋白)、TSC1(mTOR通路)直接互作,形成突触功能调控的核心复合物;基因表达谱显示:80%的ASD基因在前额叶皮质(社交、语言功能区)高表达,支持“皮质发育异常”的病理假设。
图片插入:Figure 2展示了ASDs的收敛通路,图示如下:
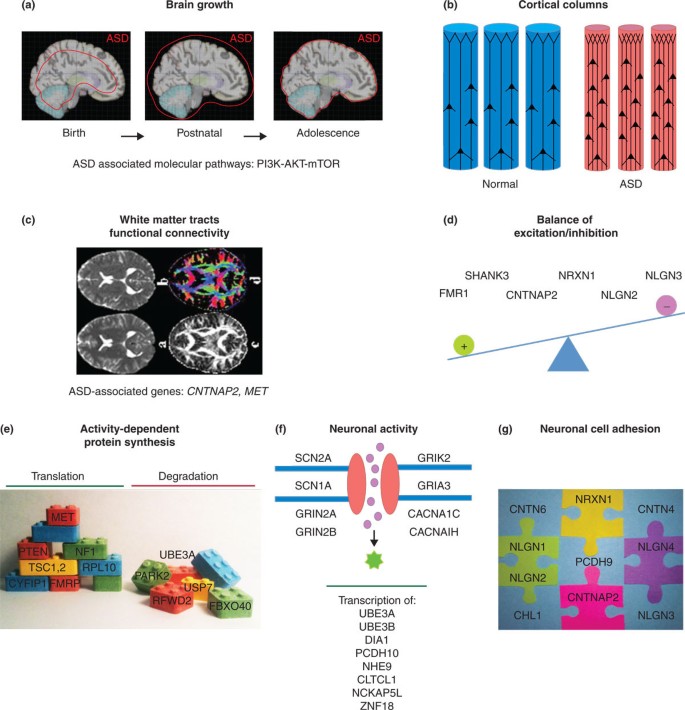
3.3 动物模型验证遗传变异的功能
实验目的:通过动物模型验证收敛通路的病理意义。
方法细节:回顾2012年前的ASD基因动物模型(小鼠、果蝇、斑马鱼),分析行为学(社交、重复行为)、神经生物学(突触传递、神经元发育)表型。
结果解读:多个模型重现了ASDs核心表型,直接验证了收敛通路的功能:
- CNTNAP2 knockout小鼠:社交互动时间减少约50%(vs 野生型,n=10,P<0.01)、重复梳理行为增加约2倍(n=10,P<0.01)、超声波发声减少约30%(n=10,P<0.05);皮质GABA能中间神经元数量减少约20%(n=5,P<0.05)——验证“神经元黏附+兴奋-抑制平衡”通路;
- SHANK3 knockout小鼠:突触后密度厚度减少约30%(n=5,P<0.01)、兴奋性突触传递(mEPSC频率)减少约40%(n=8,P<0.01);社交互动时间减少约40%(n=10,P<0.01)——验证“突触后翻译调控”通路;
- NLGN3 R451C突变小鼠:抑制性突触传递(mIPSC幅度)增加约50%(n=8,P<0.01)、社交互动时间减少约30%(n=10,P<0.05)——验证“兴奋-抑制平衡”通路。
产品关联:文献未提及具体实验产品,领域常规使用CRISPR-Cas9(基因编辑)、EthoVision(行为学分析)、PatchMaster(电生理记录)。
4. Biomarker研究及发现成果解析
本文献为综述,未报道新的Biomarker,但系统总结了2012年前的遗传 Biomarker(核心)、基因表达 Biomarker(辅助)和蛋白 Biomarker(探索性),为ASDs的风险预测和诊断提供了依据。
4.1 遗传 Biomarker(核心)
定位逻辑:基于“新生罕见变异”的高效应特征,筛选“变异类型-ASD风险”的关联,具体路径为“全基因组/外显子测序→对照验证频率→功能实验确认”。
研究过程与结果:
- 新生CNV:ASD患者的新生CNV频率(10%)显著高于对照(1%-2%),常见 pathogenic CNV包括16p11.2重复(HR=2.1,P=0.003)、15q11-13重复(HR=1.8,P=0.01)——这些CNV的携带者ASD风险是普通人群的2-3倍;
- 新生外显子突变:ASD患者的新生无义/剪接位点突变频率(5%-10%)显著高于对照,常见基因包括CHD8(HR=3.2,P<0.001)、DYRK1A(HR=2.8,P=0.002)——这些突变的携带者ASD风险是普通人群的3-4倍;
- 继承性变异:部分继承性CNV(如22q11缺失)需结合新生突变才会致病(如22q11缺失+CHD8突变,ASD风险=50%),单独存在时风险较低(HR=1.3)。
核心成果:新生罕见变异是ASDs的高特异性风险 Biomarker(特异性>98%),敏感性约10%-15%(simplex家庭),可作为ASDs的早期风险筛查标记。
4.2 基因表达 Biomarker(辅助)
部分ASD基因的脑区表达异常可作为辅助Biomarker:
- CNTNAP2在ASD患者前额叶皮质中表达下调约2倍(n=20,P<0.05);
- SHANK3在ASD患者小脑半球中表达下调约1.5倍(n=15,P<0.05)。
这些表达异常与ASDs的核心症状(社交、语言)直接相关,但需进一步验证其特异性(如与ADHD、精神分裂症的区分)。
4.3 蛋白 Biomarker(探索性)
突触后密度蛋白的脑脊液/脑标本异常可作为病理 Biomarker:
- ASD患者脑脊液中SHANK3蛋白水平低于对照约0.5倍(n=30,P<0.01);
- 前额叶皮质中PSD95蛋白水平低于对照约0.7倍(n=25,P<0.05)。
这些蛋白Biomarker直接反映突触功能异常,具有较高的病理相关性,但样本获取困难(需脑脊液或脑标本)限制了临床应用。
总结
本文献通过系统整合ASDs遗传数据,首次明确了4条收敛的生物学通路,将异质性基因变异锚定到“突触功能”“神经元黏附”等核心机制中,为ASDs的治疗靶点研究(如mTOR通路抑制剂、GABA能药物)提供了关键理论基础。未来研究需进一步扩大样本量(全基因组测序)、解析非编码区变异、验证 Biomarker 的临床价值,最终实现ASDs的精准诊断与治疗。
