1. 领域背景与文献引入
文献英文标题:A model based on adipose and muscle-related indicators evaluated by CT images for predicting microvascular invasion in HCC patients;发表期刊:Biomarker Research;影响因子:未明确;研究领域:肝癌微血管侵犯(MVI)预测、身体成分与肝癌预后。
肝细胞癌(HCC)是全球第三大致癌死亡原因,手术切除是其主要治愈手段,但微血管侵犯(MVI)是术后复发的核心驱动因素——即使是≤2cm的小肝癌,5年复发率仍高达70%。MVI仅能通过术后病理确诊,术前精准预测MVI对制定个性化手术方案(如宽切缘切除、解剖性肝切除)至关重要。现有MVI预测方法存在明显局限:① 临床变量模型(如甲胎蛋白AFP、肿瘤大小)特异性不足,易受非癌性肝病干扰;② 影像组学模型需增强CT多期扫描及三维肿瘤分割,计算复杂且易过拟合;③ 基因检测或肝活检需侵入性操作,可能导致肿瘤播散或出血。此外,近年研究证实身体成分(脂肪、肌肉组织)与肝癌预后密切相关,但鲜有研究将其用于MVI预测。
本文针对上述痛点,提出利用CT评估的脂肪和肌肉相关指标结合临床变量,构建无创、易用的nomogram预测MVI,并验证其对手术决策的指导价值,旨在填补“身体成分- MVI- 手术策略”的研究空白。
2. 文献综述解析
作者将现有MVI预测研究分为三类,系统评述其优势与局限:
(1)临床变量模型
以AFP、肿瘤大小等常规指标为核心,如Cucchetti等构建的ANN模型测试集准确性达91%,但需专用软件,临床推广困难;Li等结合MRI与血液指标的nomogram虽有一定准确性,但血清标志物在肝炎、肝硬化中也会异常,特异性不足。
(2)影像组学模型
基于增强CT的多期扫描特征,如Yang等的影像组学nomogram C指数达0.79,但需三维肿瘤分割与复杂特征提取,计算负担重,基层医院难以应用。
(3)基因/活检模型
通过肝活检或放射基因组学预测MVI,如Banerjee等的放射基因组学模型准确性良好,但活检的侵入性可能导致肿瘤种植,风险大于收益。
现有研究的核心局限是依赖增强CT、侵入性操作或模型复杂。本文的创新点在于:① 采用L3水平的平扫CT评估身体成分(脂肪、肌肉),无需增强扫描,降低操作门槛;② 仅纳入6项变量(3项影像+3项临床),模型简单易用;③ 首次验证模型对手术决策的指导价值——高风险患者采用宽切缘或解剖性切除可显著改善预后。
3. 研究思路总结与详细解析
3.1 研究设计与患者纳入
实验目的:建立训练集与验证集,确保数据的代表性与可靠性。
方法细节:回顾性纳入2018-2021年A机构(训练集,158例)与B机构(验证集,53例)的HCC患者,纳入标准为:① 术前2周内完成平扫CT;② 行根治性肝切除;③ 术后病理确诊MVI状态。排除标准包括:术前接受抗肿瘤治疗、CT图像质量差、病理未报告MVI。
结果解读:共纳入211例患者,MVI发生率47.9%(101/211);训练集中位随访23.9个月,验证集27.1个月,随访内容包括影像学检查、血液学指标及肿瘤标志物。
3.2 CT身体成分指标提取
实验目的:量化脂肪与肌肉组织的面积及密度,获取身体成分相关变量。
方法细节:采用Siemens 64排螺旋CT扫描,选取第三腰椎(L3)水平的平扫图像(该水平组织面积与全身组织量相关性最高,r²=0.855~0.927);使用SliceOmatic软件半自动化测量:① 骨骼肌(SM):包括腰大肌、竖脊肌等,HU阈值-30~150;② 皮下脂肪(SAT)与肌内脂肪(IMAT):HU阈值-190~-30;③ 内脏脂肪(VAT):HU阈值-150~-30。通过身高标准化(cm²/m²)得到指数(如SMI、IMATI)。两位5年以上经验的肝胆外科医生独立 delineate 区域,随机选取40例样本验证一致性(组内相关系数0.87~0.91)。
结果解读:成功提取VAT密度、IMATI、SM面积等18项身体成分指标,为后续变量筛选提供基础。
3.3 变量筛选与nomogram构建
实验目的:通过数据降维筛选关键变量,构建MVI预测nomogram。
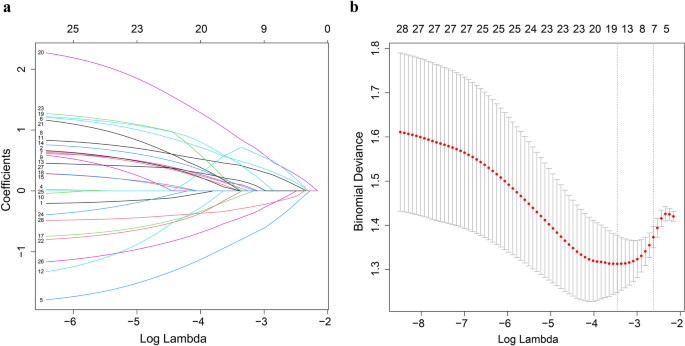
方法细节:采用LASSO逻辑回归进行变量筛选(迭代1000次,十倍交叉验证减少过拟合),保留非零系数的变量;将筛选后的变量纳入多因素logistic回归,确认独立预测因素。
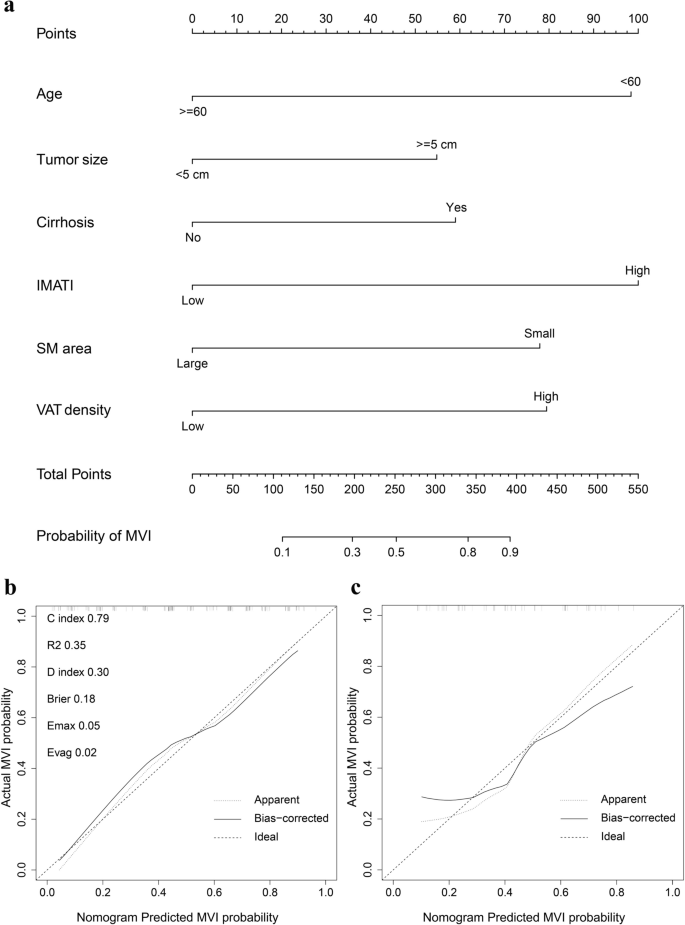
结果解读:LASSO回归筛选出18项候选变量(Fig2),多因素回归进一步确认6项独立预测因素:年龄(OR=0.214,P=0.001)、肿瘤大小(OR=2.359,P=0.025)、肝硬化(OR=2.518,P=0.033)、VAT密度(OR=3.468,P=0.003)、IMATI(OR=4.783,P<0.001)、SM面积(OR=0.295,P=0.008)。基于上述6项因素构建nomogram(Fig3a)。
3.4 nomogram验证与临床utility评估
实验目的:验证nomogram的准确性与临床实用性。
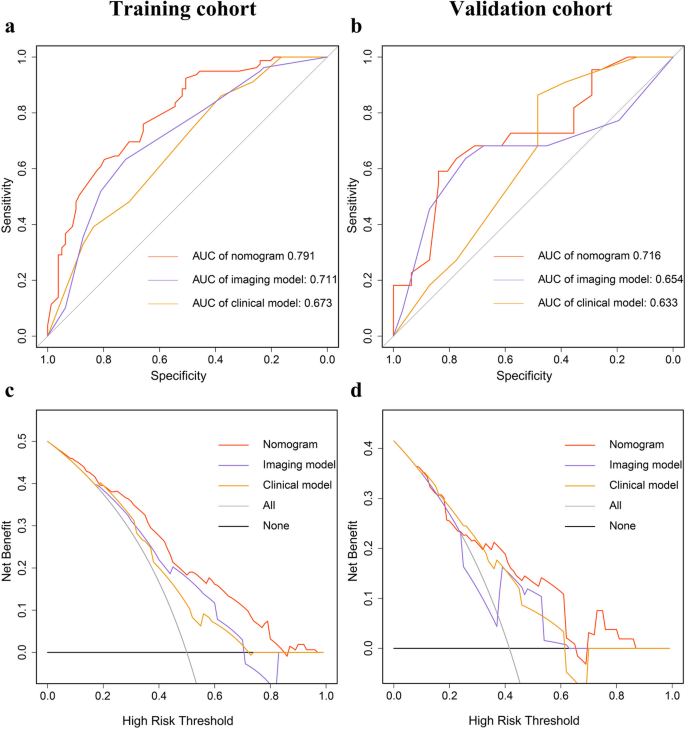
方法细节:① 区分度:计算C指数(训练集、验证集);② 校准度:绘制校准曲线(预测概率与实际概率的一致性);③ 临床净收益:决策曲线分析(DCA);④ 对比分析:与“临床模型(仅年龄、肿瘤大小、肝硬化)”“影像模型(仅VAT密度、IMATI、SM面积)”的ROC曲线(AUC)与DCA比较。
结果解读:训练集C指数0.79(95%CI 0.72-0.86),验证集0.75(95%CI 0.62-0.89);校准曲线显示预测与实际概率一致性良好(Fig3b、c);ROC曲线显示nomogram的AUC(训练集0.791、验证集0.716)优于临床模型(0.673、0.633)与影像模型(0.711、0.654)(Fig4a、b);DCA显示nomogram在更广的阈值概率范围内具有更高临床净收益(Fig4c、d)。
3.5 风险分层与生存分析
实验目的:根据nomogram得分分层,分析不同手术方式对预后的影响。
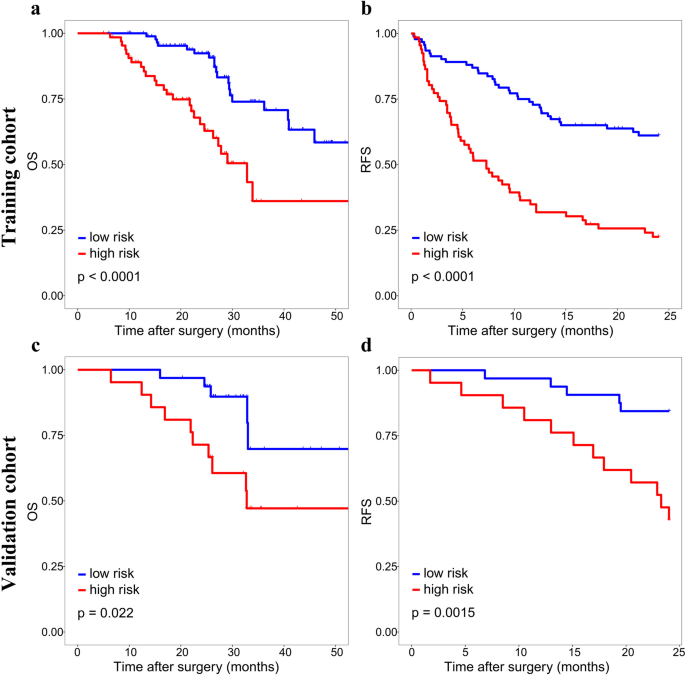
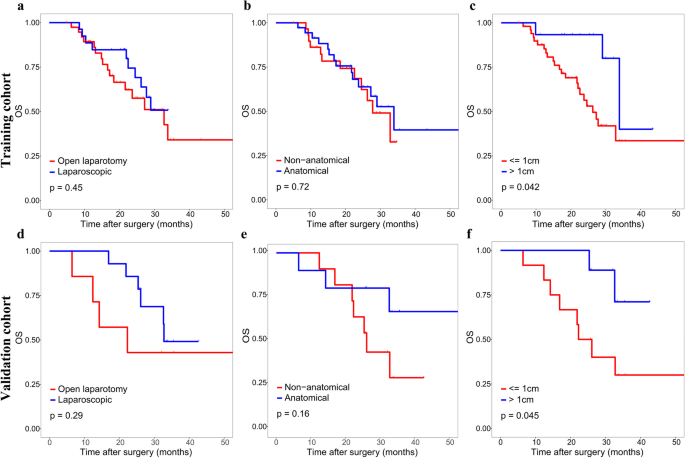
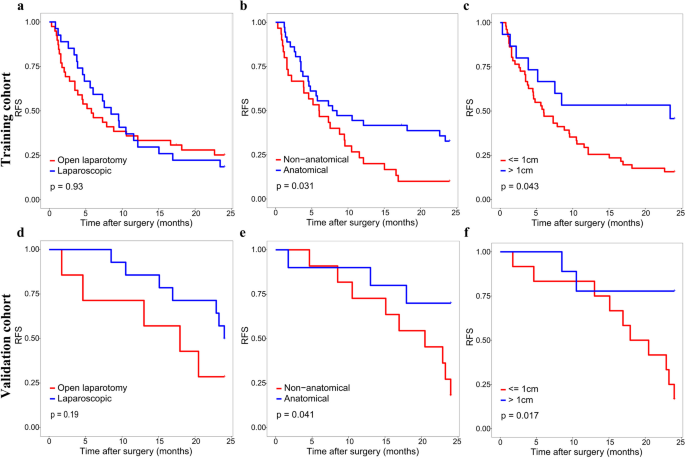
方法细节:通过Youden指数确定训练集的最佳cut-off值(273.8),将患者分为高风险(>273.8)与低风险(≤273.8)组;采用Kaplan-Meier曲线分析两组的2年复发率(RFS)与总生存(OS);进一步分析高风险患者中,不同手术方式(宽切缘/窄切缘、解剖性/非解剖性切除)对预后的影响。
结果解读:高风险组2年复发率显著高于低风险组(训练集:68.2% vs 31.8%;验证集:71.4% vs 28.6%),OS更短(Fig5);高风险患者采用宽切缘(≥1cm)或解剖性切除可显著改善2年RFS(Fig6、7),宽切缘还可改善OS;低风险患者手术方式对预后无显著影响(补充图3、4)。
4. Biomarker研究及发现成果解析
本研究的Biomarker为组合型无创预测指标,包括3项影像指标(VAT密度、IMATI、SM面积)与3项临床指标(年龄、肿瘤大小、肝硬化)。定位:通过平扫CT与临床资料获取,是术前预测MVI的无创组合Biomarker,筛选逻辑为“LASSO回归降维→多因素logistic回归确认独立预测因素”。
研究过程详述
- 指标来源:L3水平的平扫CT图像(测量脂肪、肌肉的面积与密度)及临床病历(年龄、肿瘤大小、肝硬化史)。
- 验证方法:① LASSO回归筛选出18项候选变量,排除冗余;② 多因素logistic回归确认6项为独立预测因素;③ 外部验证(验证集C指数0.75);④ 生存分析验证其对手术决策的指导价值。
- 特异性与敏感性:训练集最佳cut-off值273.8,区分MVI存在与否的敏感性79.7%、特异性63.3%(补充图2)。
核心成果
- 预测效能:组合指标构建的nomogram在训练集与验证集均表现出良好的区分度(C指数0.79/0.75)与校准度,ROC与DCA结果优于临床或影像单独模型。
- 临床指导:高风险患者采用宽切缘或解剖性切除可显著改善2年RFS,宽切缘还可改善OS,为手术决策提供量化依据。
- 易用性:模型仅需平扫CT与临床变量,无需增强扫描或侵入性检查,操作简单,适合基层医院推广。
综上,本文构建的nomogram实现了MVI的术前无创预测,为肝癌患者的个性化手术方案制定提供了重要工具,弥补了现有研究的不足。
