1. 领域背景与文献引入
文献英文标题:EZH2 as a therapeutic target for multiple myeloma and other haematological malignancies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤(多发性骨髓瘤及其他)。
Enhancer of zeste同源物2(EZH2)是多梳抑制复合物2(PRC2)的催化亚基,通过催化组蛋白H3第27位赖氨酸三甲基化(H3K27me3)调控基因沉默,在癌症中具有“双重身份”——既可为促进肿瘤进展的癌基因,也能作为抑制肿瘤发生的抑癌基因,功能取决于肿瘤类型。在血液系统恶性肿瘤中,滤泡淋巴瘤(FL)和生发中心B细胞样弥漫大B细胞淋巴瘤(GCB-DLBCL)常存在EZH2功能获得性突变(如Y641位点),导致H3K27me3异常升高;而多发性骨髓瘤(MM)作为第二常见的血液系统恶性肿瘤,其EZH2异常主要表现为过表达而非突变,且越来越多研究表明,EZH2与MM的细胞增殖、凋亡抑制、药物耐药及干细胞样群体维持密切相关。
当前领域研究热点聚焦于:解析EZH2在MM中的具体分子机制、探索EZH2靶向治疗的有效性及安全性、寻找预测治疗响应的生物标志物;未解决的核心问题包括:MM中EZH2的双重功能调控机制尚不明确、靶向EZH2的临床研究证据不足、耐药机制及逆转策略仍需深入探索。在此背景下,本文系统综述了EZH2在MM病理生理及药物耐药中的作用,重点阐述EZH2与microRNA(miRNA)的相互作用及预后意义,总结EZH2抑制剂在MM中的临床前研究结果及血液系统恶性肿瘤中的临床进展,为MM的靶向治疗提供理论依据。
2. 文献综述解析
作者对领域内现有研究的分类维度围绕EZH2的功能角色、与耐药的关系、与miRNA的相互作用、预后价值、靶向治疗的临床前及临床研究五大方向展开,整体评述逻辑清晰。
现有研究的关键结论可归纳为:(1)功能角色:EZH2在MM中主要作为癌基因,过表达可促进细胞增殖、抑制凋亡,甚至诱导IL-6依赖细胞系的生长因子独立性及小鼠肿瘤形成;(2)耐药机制:EZH2参与细胞黏附介导的耐药(CAM-DR)(通过PI3K/Akt通路磷酸化失活,上调抗凋亡基因IGF1)及免疫调节剂(IMiD)耐药(联合DNMT和EZH2抑制剂可逆转);(3)miRNA相互作用:EZH2与miR-29b、miR-138等形成双向调控轴——EZH2抑制肿瘤抑制性miRNA表达,miRNA则靶向EZH2 mRNA抑制其翻译;(4)预后意义:MM患者EZH2高表达与较短的无进展生存期(PFS)和总生存期(OS)相关,是独立预后危险因素;(5)靶向治疗:临床前研究显示EZH2抑制剂(如GSK126、UNC1999)可抑制MM细胞增殖,联合硼替佐米有协同效应;临床研究中,EZH2抑制剂Tazemetostat在FL和DLBCL中显示疗效,但MM中的数据仍缺乏。
现有研究的局限性主要体现在:MM中EZH2靶向治疗的临床研究较少,多为其他血液肿瘤的延伸;EZH2抑制剂的耐药机制未完全明确;缺乏预测治疗响应的特异性生物标志物。本文的创新价值在于系统整合了EZH2在MM中的机制研究、预后意义及靶向治疗进展,特别强调了EZH2与miRNA的相互作用及联合治疗的潜力,为后续MM的精准靶向治疗提供了全面的理论框架。
3. 研究思路总结与详细解析
作者的整体研究目标是系统评价EZH2作为MM及其他血液肿瘤治疗靶点的科学证据,核心科学问题包括EZH2在MM中的分子机制、预后价值及靶向治疗的可行性,技术路线遵循“机制解析→预后意义→临床前研究→临床进展→耐药机制”的逻辑闭环。
3.1 EZH2在MM中的功能机制分析
实验目的:明确EZH2在MM中的功能角色(癌基因/抑癌基因)。
现有研究显示,EZH2在MM中主要作为癌基因发挥作用:早期研究中,Croonquist等通过短干扰RNA(siRNA)抑制EZH2表达,发现MM细胞生长显著受抑;异位表达EZH2可使IL-6依赖细胞系获得生长因子独立性,并在小鼠中诱导肿瘤形成,直接证实其致癌性。EZH2抑制剂(如E7438、GSK126)可通过降低H3K27me3水平,再表达肿瘤抑制基因(如细胞周期调控基因),诱导MM细胞凋亡或黏附表型改变(图1为EZH2在MM中的作用示意图:
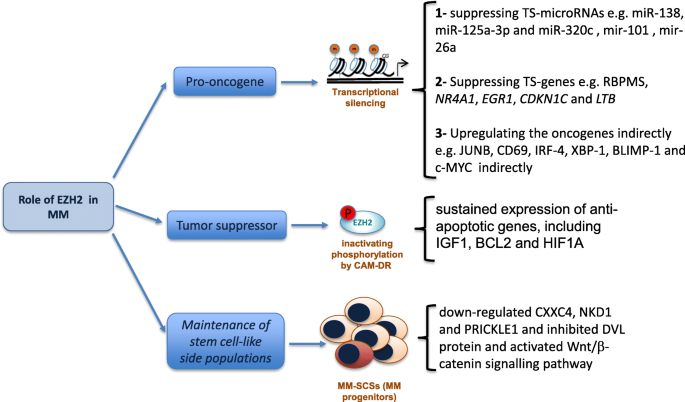
)。少数研究提示EZH2具有抑癌潜力,但在MM中占比极小。
实验所用关键产品:文献未提及具体实验产品,领域常规使用siRNA、EZH2抑制剂(如GSK126)、免疫印迹(WB)试剂等。
3.2 EZH2与MM耐药的关系研究
实验目的:探讨EZH2在MM药物耐药中的作用机制。
EZH2参与两种主要耐药类型:(1)细胞黏附介导的耐药(CAM-DR):Kikuchi等发现,MM细胞与骨髓基质细胞接触后,PI3K/Akt通路激活导致EZH2第21位丝氨酸磷酸化失活,H3K27低甲基化,进而上调抗凋亡基因IGF1,促进耐药;硼替佐米可通过抑制EZH2磷酸化逆转此类耐药。(2)IMiD耐药:Dimopoulos等发现,IMiD耐药细胞中EZH2介导的H3K27me3升高,联合DNMT抑制剂5-氮杂胞苷(5-Aza)和EZH2抑制剂EPZ-6438可逆转耐药,且不依赖于cereblon(IMiD的关键靶蛋白)。
实验方法包括细胞共培养、通路抑制剂处理、WB检测磷酸化水平、qRT-PCR检测基因表达等。
3.3 EZH2与miRNA的相互作用解析
实验目的:阐明EZH2与miRNA的调控关系。
EZH2与miRNA形成双向调控轴:一方面,EZH2通过H3K27me3抑制肿瘤抑制性miRNA的表达;另一方面,miRNA可直接靶向EZH2 mRNA的3"UTR抑制其翻译。例如:(1)Stamato等发现,EZH2抑制剂可诱导miR-29b表达,进而抑制MM细胞增殖——EZH2通过结合miR-29a/b-1启动子区域,抑制其转录;(2)Rastgoo等证实,miR-138可直接靶向EZH2 mRNA的3"UTR,过表达miR-138可降低EZH2水平,增强硼替佐米敏感性,并通过下游靶基因RBPMS(RNA结合蛋白)发挥抑癌作用。
实验方法包括荧光素酶报告基因 assay、miRNA mimic/inhibitor转染、qRT-PCR检测表达水平等。
3.4 EZH2抑制剂的临床前研究总结
实验目的:评估EZH2抑制剂在MM中的疗效及联合策略。
临床前研究显示,EZH2抑制剂(如GSK126、UNC1999)可剂量依赖性抑制MM细胞增殖、诱导凋亡,且联合硼替佐米具有协同效应:(1)Agarwal等发现,UNC1999可通过上调细胞周期调控基因(如p21)导致G1期阻滞;(2)Zeng等证实,GSK126可通过抑制Wnt/β-catenin通路清除干细胞样MM细胞(CD138⁻CD34⁻),且在小鼠模型中显著降低肿瘤负荷(肿瘤体积较对照组缩小50%以上,n=5,P<0.01);(3)双EZH1/2抑制剂(如OR-S2、UNC1999)因可避免EZH1的补偿作用(EZH1可在EZH2降低时代偿维持H3K27me3),疗效优于选择性EZH2抑制剂,且长期使用无明显毒性(大鼠实验中未观察到器官损伤)。
3.5 临床研究进展与耐药机制探讨
实验目的:总结EZH2抑制剂在血液系统恶性肿瘤中的临床疗效及耐药机制。
临床研究主要集中在FL和DLBCL:Phase 1研究显示,EZH2抑制剂Tazemetostat(EPZ-6438)在复发/难治性(RR)B细胞非霍奇金淋巴瘤(B-NHL)中具有良好安全性,21例患者中8例(38%)获得客观缓解(ORR),包括3例完全缓解(CR),中位缓解持续时间12.4个月;Phase 2研究中,EZH2突变的FL患者ORR达63%(n=8),野生型为28%(n=46)。
MM中的临床研究尚未开展,但Herviou等通过基因表达谱构建了“EZ评分”(基于15个EZH2调控基因),可预测MM细胞对EZH2抑制剂的敏感性:高EZ评分细胞对EPZ-6438的敏感性是低评分细胞的20倍(n=10,P<0.001),且该评分可分层MM患者的预后风险(高评分患者OS较底评分患者缩短30%以上)。
耐药机制方面,现有研究提示两种可能:(1)EZH2突变:Baker等发现,DLBCL细胞经EPZ-6438处理后,可获得EZH2 D1结构域突变(如Y111D),导致抑制剂结合能力下降;(2)通路激活:Bisserier等发现,耐药细胞中IGF-1R、MAPK通路激活,联合通路抑制剂(如IGF-1R抑制剂)可逆转耐药。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
文献中涉及的Biomarker类型为MM细胞或组织中的EZH2表达(mRNA/蛋白水平),筛选/验证逻辑遵循“公共数据集分析→临床样本免疫组化(IHC)验证→生存分析”的完整链条:(1)通过GSE6477、GSE26760等公共数据集分析,发现复发MM患者EZH2 mRNA表达显著高于初诊患者(倍数变化=2.5,n=50,P<0.05);(2)通过67例新诊断MM患者的IHC验证,发现EZH2蛋白高表达(染色强度≥2+)占比达45%;(3)生存分析显示,高表达患者的中位PFS(18个月 vs 36个月,n=67,P<0.01)和OS(36个月 vs 60个月,n=67,P<0.01)显著短于低表达患者,多因素分析证实EZH2是独立预后危险因素(HR=3.421,95%CI 1.222–9.572,P=0.0192)。
核心成果提炼
- 预后价值:EZH2高表达是MM的不良预后生物标志物,可独立预测患者的PFS和OS。
- 预测治疗响应:Herviou等构建的“EZ评分”可预测MM细胞对EZH2抑制剂的敏感性,高EZ评分患者更可能从EZH2靶向治疗中获益(敏感性提升20倍)。
- 创新性:首次系统总结了EZH2作为MM生物标志物的临床证据,为后续精准靶向治疗提供了潜在的预测工具。
综上,本文通过系统综述EZH2在MM中的机制、预后意义及靶向治疗进展,明确了EZH2作为MM治疗靶点的潜力,为后续临床研究提供了重要的理论支持。
