1. 领域背景与文献引入
文献英文标题:Multi-omics analysis dissects the genetic architecture of seed coat content in Brassica napus;发表期刊:Genome Biology;影响因子:未公开;研究领域:油菜(Brassica napus)种皮含量遗传机制研究。
油菜是全球重要的油料作物,种子含油量(SOC)是其核心育种目标之一。种皮含量(SCC,种皮重量占总种子重量的比例)是影响SOC的关键因素,二者呈显著负相关——种皮越薄(SCC越低),种子胚的占比越高,SOC通常越高。黄色种子的油菜因SCC低、SOC高、油质透明等优点,成为育种热点,但SCC的遗传调控机制仍未完全解析。
现有研究表明,SCC受种皮结构(如次生细胞壁增厚)、木质素和类黄酮合成(苯丙烷代谢途径)等多因素调控。木质素是种皮次生细胞壁的主要成分,其含量与种皮厚度正相关;类黄酮(如原花青素)决定种皮颜色,黄色种子的类黄酮含量低,种皮更薄。此外,转录因子如TRANSPARENT TESTA 8(TT8)可调控类黄酮合成,影响种皮颜色和SCC,但这些基因如何协同调控SCC与SOC的分子机制仍不清楚。
尽管之前的全基因组关联研究(GWAS)定位了一些SCC相关的数量性状位点(QTL),但缺乏多组学数据的整合分析,关键调控基因的功能验证不足,尤其是新基因(如Cinnamoyl-CoA reductase-like,CCRL)在种皮发育中的作用未被报道。本研究旨在通过转录组全关联分析(TWAS)、GWAS、表达数量性状位点(eQTL)分析和基因模块分析,结合CRISPR/Cas9功能验证,系统解析油菜SCC的遗传结构,为低SCC、高SOC的油菜育种提供关键遗传资源。
2. 文献综述解析
文献综述以“SCC的遗传调控”为核心,按“表型关联→遗传定位→分子调控”的逻辑评述现有研究:
首先,作者总结了SCC与SOC的负相关关系——黄色种子油菜的SCC比黑色种子低20%-30%,SOC高5%-8%,这一关联的分子基础是碳源在苯丙烷途径(合成木质素、类黄酮)与脂肪合成之间的分配竞争。其次,现有GWAS研究定位了多个SCC相关QTL,如染色体C05上的QTL同时调控SCC、SOC和种皮颜色,但这些QTL的候选基因未被克隆。最后,分子调控层面,TT家族基因(如TT8、TT1)通过调控类黄酮合成影响种皮颜色和SCC,但这些基因是否参与木质素合成仍有争议。
现有研究的技术优势在于利用GWAS快速定位QTL,但局限性包括:(1)缺乏转录组数据的整合,无法直接关联基因表达与表型;(2)功能验证多集中在模式植物拟南芥,油菜中的同源基因功能未被系统验证;(3)未解析SCC调控的核心网络,尤其是新基因(如CCRL)的作用。
本研究的创新点在于:(1)采用多组学整合策略(TWAS+GWAS+eQTL+基因模块),直接关联基因表达与SCC,鉴定到新的调控基因BnaC07.CCRL和BnaTT8s;(2)通过eQTL分析发现染色体A09上的调控热点,解析了其通过BnaTT8s和BnaC07.CCRL调控SCC的分子机制;(3)用CRISPR/Cas9验证了关键基因的功能,明确了它们在木质素合成和碳分配中的作用。
3. 研究思路总结与详细解析
本研究的整体思路是“表型-组学-基因-功能”的闭环:首先测定382份油菜材料的SCC和SOC表型,收集发育种子的转录组数据;然后通过TWAS、GWAS、eQTL分析和基因模块分析鉴定SCC相关基因和QTL;再通过CRISPR/Cas9敲除关键基因,验证其对SCC、木质素含量和SOC的调控作用;最后解析碳源在苯丙烷途径与脂肪合成之间的分配网络。
3.1 表型与转录组数据收集
实验目的是获取油菜自然群体的SCC、SOC表型及发育种子的转录组数据,为后续关联分析提供基础。
方法细节:选取382份全球油菜种质(包括春性、冬性、半冬性材料),种植于武汉实验田(2016-2017年),收获成熟种子后测定SCC(种皮重量/总种子重量)和SOC(近红外反射光谱仪);收集257份材料20天_after_flowering(DAF)和253份材料40 DAF的发育种子,进行RNA-seq测序(来自作者之前的研究)。
结果解读:SCC的变异范围为11.83%-21.87%(n=382),呈现连续分布的数量性状特征;SOC的变异范围为35.2%-48.6%,与SCC显著负相关(Pearson系数R²=0.18,P=3.33×10⁻¹⁹)。转录组数据覆盖了种子发育的两个关键阶段:20 DAF是种子胚胎发育早期,40 DAF是脂肪快速积累期。
产品关联:文献未提及具体实验产品,领域常规使用Foss NIRSystems 5000近红外光谱仪测定SOC,电子天平(精度0.1mg)测定种皮重量,Illumina HiSeq平台进行RNA-seq测序。
3.2 转录组全关联分析(TWAS)
实验目的是鉴定与SCC显著关联的基因,直接关联基因表达与表型。
方法细节:以SCC为表型,分别对20 DAF和40 DAF的转录组数据进行TWAS(使用EMMAX软件,混合线性模型校正群体结构),显著阈值为FDR<0.05。
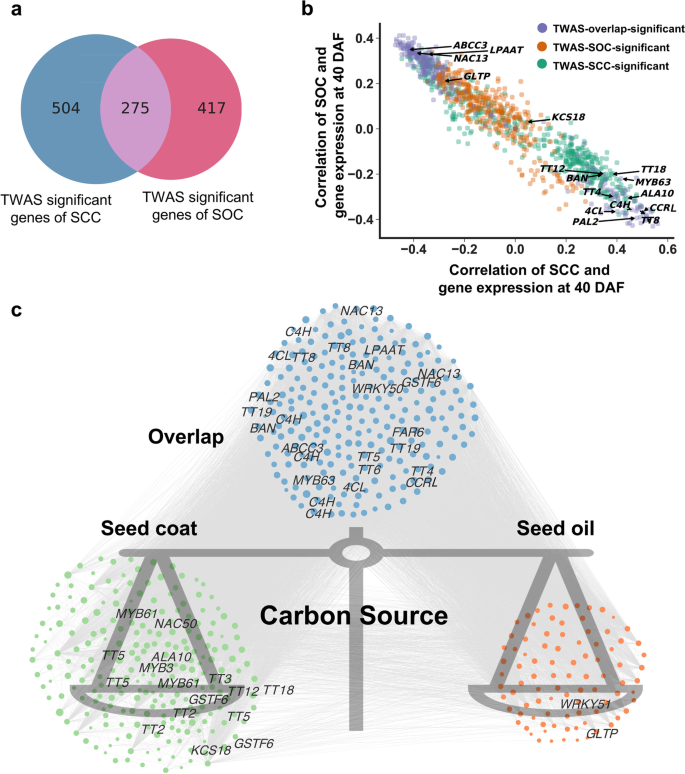
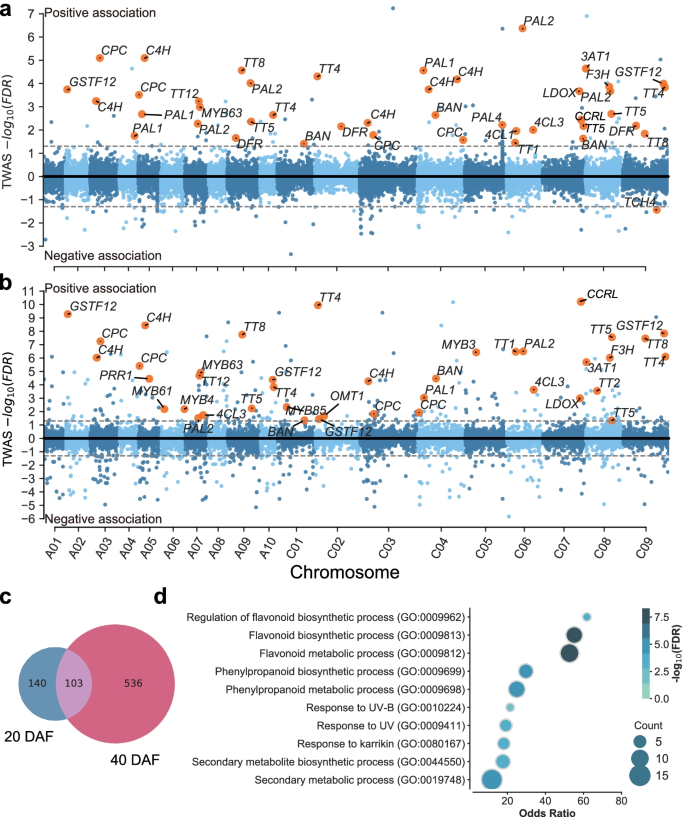
结果解读:20 DAF鉴定到243个显著基因,40 DAF鉴定到639个显著基因,其中103个基因在两个阶段重叠(Fig.1c)。这些重叠基因主要富集在苯丙烷途径(如苯丙氨酸解氨酶PAL2、4-香豆酰-CoA连接酶4CL)、类黄酮合成(如原花青素合成酶BAN、黄酮3-羟化酶F3H)和木质素合成(如CCRL、肉桂醇脱氢酶CAD)(Fig.1d)。其中,BnaC07.CCRL(C07染色体上的CCRL同源基因)和BnaTT8s(A09、C09染色体上的TT8同源基因)的表达与SCC相关性最高。
图片对应:
产品关联:文献未提及具体工具,领域常规使用EMMAX软件进行TWAS,ClusterProfiler包进行GO富集分析。
3.3 基因模块分析
实验目的是鉴定与SCC相关的共表达基因模块,解析基因间的协同调控关系。
方法细节:使用独立成分分析(ICA)对20 DAF和40 DAF的转录组数据进行模块划分,计算模块与SCC的相关性(线性混合模型,LMM)。
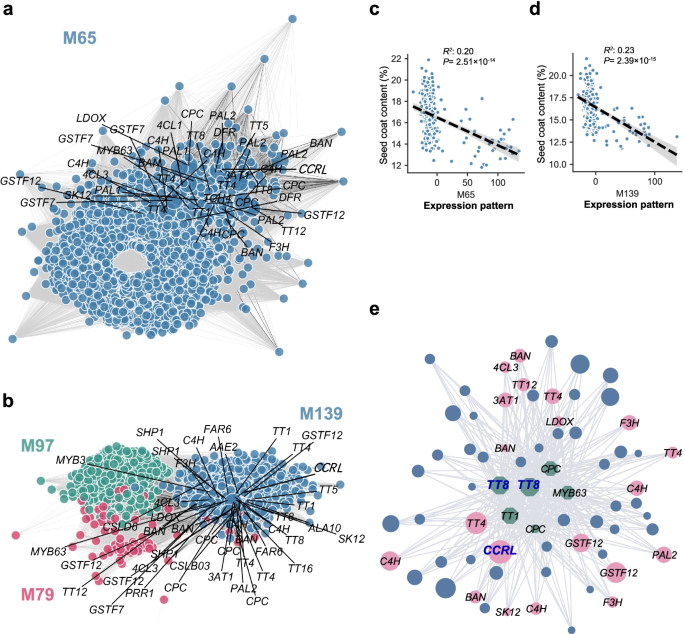
结果解读:20 DAF鉴定到1个与SCC显著相关的模块M65(LMM P=1.52×10⁻¹¹),40 DAF鉴定到3个模块M139(P=6.09×10⁻¹³)、M79(P=1.14×10⁻⁷)、M97(P=4.1×10⁻⁴)。其中,M65和M139模块的基因重叠度最高,包含BnaTT8s和BnaC07.CCRL(Fig.2e)。进一步分析显示,BnaTT8s的表达与M139模块的基因表达高度相关,提示其作为核心转录因子调控模块内基因。
图片对应:
产品关联:文献未提及具体工具,领域常规使用WGCNA或ICA软件进行共表达模块分析。
3.4 GWAS与eGWAS分析
实验目的是定位SCC的QTL,并解析关键基因的表达调控位点。
方法细节:用8,593,156个单核苷酸多态性(SNP,MAF>0.05)进行GWAS(GEMMA软件,混合线性模型),显著阈值为7.96×10⁻⁶;以BnaTT8s和BnaC07.CCRL的表达为表型,进行eQTL分析(GEMMA软件)。
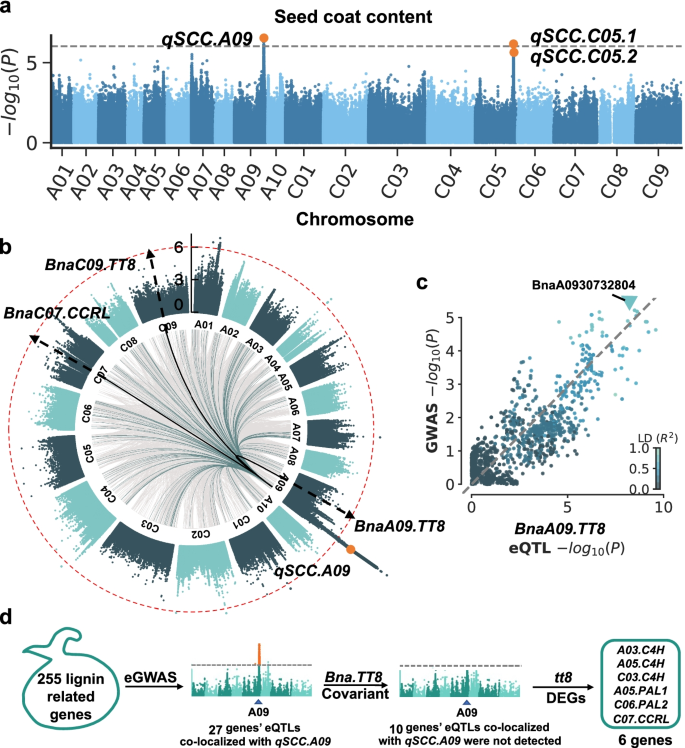
结果解读:GWAS鉴定到3个SCC相关QTL:qSCC.A09(A09染色体)、qSCC.C05.1(C05染色体)、qSCC.C05.2(C05染色体)(Fig.3a)。eQTL分析发现,qSCC.A09是BnaTT8s和BnaC07.CCRL的共同调控位点——BnaA09.TT8的eQTL峰值位于qSCC.A09(P=1.2×10⁻⁸),BnaC07.CCRL的eQTL也共定位到该区域(Fig.3b)。进一步分析显示,qSCC.A09通过调控BnaTT8s的表达,间接影响苯丙烷途径基因(如PAL、C4H)的表达(Fig.3d)。
图片对应:
产品关联:文献未提及具体工具,领域常规使用GEMMA软件进行GWAS和eGWAS,LocusZoom软件进行共定位分析。
3.5 CRISPR/Cas9功能验证
实验目的是验证BnaTT8s和BnaC07.CCRL对SCC的调控作用。
方法细节:设计sgRNA靶向BnaTT8s(A09和C09染色体上的同源基因,靶向bHLH结构域)和BnaCCRL(C07、A03、C05染色体上的同源基因,靶向保守的还原酶结构域),构建CRISPR/Cas9载体,转化油菜品种Westar的下胚轴,获得T2代纯合突变体。测定突变体的SCC、木质素含量(酸水解法)、SOC(近红外光谱仪)和下游基因表达(qRT-PCR)。
结果解读:BnaTT8双敲除突变体(L18、L24、L30)的种皮颜色变为黄色,SCC从野生型的13.9%降低到7.68%-8.60%(n=6,P<0.05),木质素含量降低27.0%-42.2%(n=3,P<0.05),SOC增加4.90%-6.03%(n=6,P<0.05)(Fig.4d-f)。BnaCCRL三敲除突变体(L21)的SCC从野生型的16.0%降低到14.0%(n=6,P<0.05),木质素含量降低17.6%(n=3,P<0.05),SOC增加3.00%-4.20%(n=6,P<0.05)(Fig.5d-f)。qRT-PCR显示,突变体中苯丙烷途径基因(如PAL、C4H、CCoAOMT)的表达显著下调(Additional file 1: Fig.S14)。
图片对应:
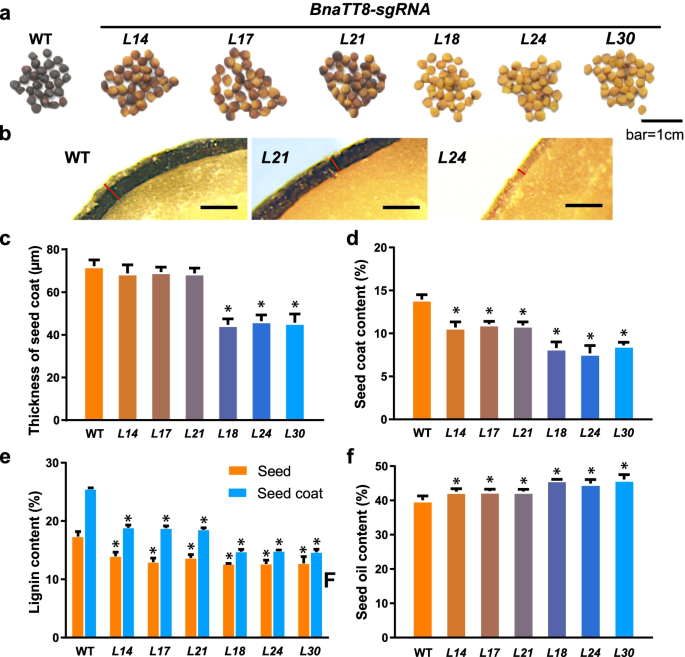
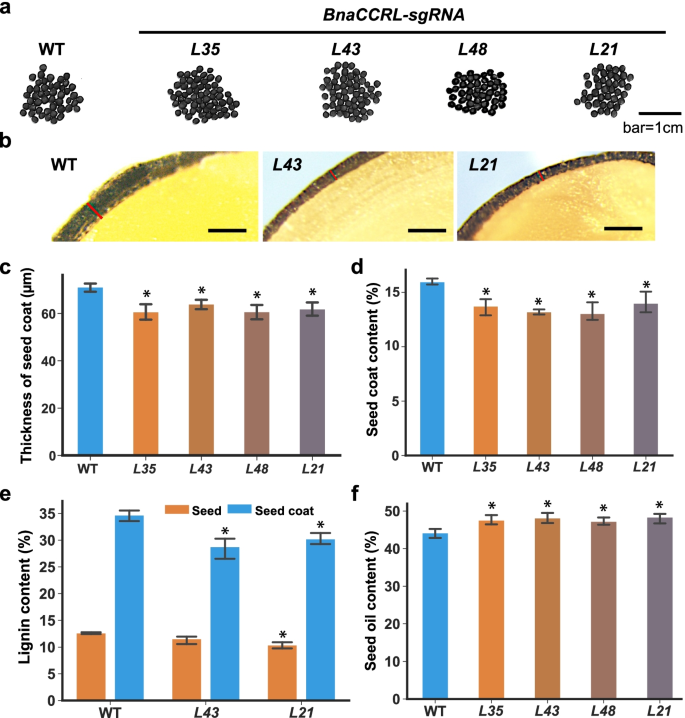
产品关联:实验所用关键产品:CRISPR/Cas9载体(pET-28b-Sumo,文献未提具体品牌),Westar油菜品种(受体材料),qRT-PCR引物(序列见补充表S21)。
4. Biomarker研究及发现成果解析
本研究中的Biomarker是指与SCC显著关联的分子标记(基因和QTL),包括BnaC07.CCRL、BnaTT8s和qSCC.A09调控热点,其筛选与验证逻辑为“多组学鉴定→共表达模块→功能验证”。
Biomarker定位与验证
- 来源:BnaC07.CCRL来自TWAS显著基因(40 DAF,FDR=1.2×10⁻⁶),BnaTT8s来自基因模块分析(M139模块,P=6.09×10⁻¹³),qSCC.A09来自GWAS定位(P=3.1×10⁻⁷)。
- 验证方法:(1)eGWAS验证:BnaTT8s和BnaC07.CCRL的eQTL共定位到qSCC.A09,证明该QTL是其上游调控位点;(2)功能验证:CRISPR敲除突变体的SCC、木质素含量和SOC表型显著变化,证明其功能;(3)表达关联:BnaTT8s和BnaC07.CCRL的表达与SCC正相关(R²=0.35和0.28,P<0.01)。
- 特异性与敏感性:BnaTT8双敲除突变体的SCC降低幅度达40%(从13.9%到8.29%),敏感性高;qSCC.A09的eQTL解释了BnaTT8s表达变异的32%,特异性强。
核心成果
- 新基因鉴定:BnaC07.CCRL编码肉桂酰-CoA还原酶类似蛋白,通过促进木质素合成增加种皮厚度,是油菜种皮发育的关键新基因。
- 转录因子调控机制:BnaTT8s作为bHLH转录因子,通过调控苯丙烷途径基因(如PAL、C4H)的表达,协同调控类黄酮和木质素合成,进而影响SCC。
- 调控热点解析:qSCC.A09通过调控BnaTT8s和BnaC07.CCRL的表达,成为SCC的核心调控位点。
- 碳分配网络:SCC相关基因(如TT8、CCRL)的表达与SOC负相关,说明碳源在苯丙烷途径与脂肪合成之间的分配竞争是SCC与SOC负相关的分子基础(Fig.6c)。
创新性
首次在油菜中报道BnaC07.CCRL的功能,揭示了BnaTT8s在木质素合成中的新作用,整合多组学数据解析了SCC的遗传结构,为低SCC、高SOC的油菜育种提供了关键分子标记。
图片对应: