1. 领域背景与文献引入
文献英文标题:The regulatory functions of G protein-coupled receptors signaling pathways in B cell differentiation and development contributing to autoimmune diseases;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:B细胞分化发育与自身免疫病的G蛋白偶联受体(GPCR)调控。
自身免疫病(如多发性硬化、系统性红斑狼疮、类风湿关节炎)的核心病理是免疫耐受破坏,B细胞异常活化(如自身抗体过度产生、生发中心异常形成)是疾病进展的关键驱动因素。GPCR作为人体最大的膜受体家族(约800种),通过结合趋化因子、脂质、肽类等配体,调控免疫细胞的迁移、分化与功能。然而,既往研究对GPCR在B细胞发育各阶段(骨髓早期分化、外周淋巴器官活化、浆细胞/记忆B细胞生成)的精准调控机制,以及这些调控异常如何推动自身免疫病发生的理解尚不充分——多数研究聚焦单一GPCR,缺乏对B细胞发育全周期的网络整合,且部分GPCR(如孤儿受体CB2)的功能仍不明确。
本综述系统总结了GPCR(趋化因子受体如CXCR3/4/5、CCR7;脂质受体如S1PR1-5;孤儿受体如GPR132、GPR183)在B细胞发育各阶段的调控作用,及在自身免疫病中的病理角色,填补了“GPCR-B细胞-自身免疫病”调控网络的机制空白,为开发靶向GPCR的自身免疫病治疗策略提供了理论基础。
2. 文献综述解析
作者的综述逻辑以“B细胞发育全周期”为核心,分三步展开:先阐述GPCR的基本生物学功能(识别环境信号、启动胞内信号通路);再分阶段解析GPCR对B细胞发育的调控(早期骨髓分化、外周淋巴器官活化、浆细胞/记忆B细胞生成、边缘区B细胞定位);最后关联GPCR异常与自身免疫病的病理机制(如S1PR1调控多发性硬化、CXCR4参与系统性红斑狼疮)。
现有研究的关键结论与局限
现有研究已明确:① 早期B细胞发育中,CXCR4通过结合骨髓微环境中的CXCL12,维持前B细胞在骨髓的滞留;G2A(GPR132)高表达于pro-B细胞,保护细胞免受基因组不稳定性损伤。② 外周淋巴器官中,EBI2(GPR183)调控B细胞向滤泡外区域(早期抗体产生)或生发中心(长期免疫记忆)迁移——EBI2高表达促进滤泡外反应,低表达则引导进入生发中心;S1PR2调控生发中心大小,促进B细胞向滤泡中心聚集。③ 浆细胞生成中,CXCR4-CXCL12轴引导浆细胞归巢至骨髓,维持长期存活;EBI2帮助浆细胞前体迁移至滤泡外区域,促进早期抗体产生。④ 自身免疫病中,S1PR1调节剂(如芬戈莫德)已用于治疗多发性硬化,通过抑制B细胞向外周迁移减轻炎症;CXCR4拮抗剂(如AMD3100)可减少系统性红斑狼疮小鼠的自身抗体生成,延缓肾炎进展。
现有研究的技术优势在于多维度验证(结合基因敲除动物模型、临床样本分析及药物干预实验),但局限性仍明显:① 部分GPCR的配体未明确(如部分孤儿受体);② 部分机制(如CB2调控B细胞的具体信号通路)仍不清楚;③ 多数研究聚焦单一GPCR,缺乏对调控网络的整合分析。
本综述的创新价值
本综述首次系统整合了B细胞发育全周期的GPCR调控网络,明确了不同GPCR在B细胞命运决定中的协同或拮抗作用(如S1PR1/3与CXCR5平衡边缘区B细胞定位);同时建立了GPCR异常与自身免疫病病理的直接关联(如P2RY8低表达导致SLE患者B细胞耐受破坏),为从“GPCR靶点”开发自身免疫病治疗策略提供了全面的理论框架。
3. 研究思路总结与详细解析
本研究为系统性综述,无具体实验数据,但作者通过“B细胞发育阶段→GPCR类型→功能机制→自身免疫病关联”的框架,构建了完整的调控网络解析体系。以下按B细胞发育关键阶段展开:
3.1 GPCR在B细胞早期分化中的调控(骨髓内)
实验目的:解析GPCR对骨髓内前B细胞滞留与分化的调控。
核心机制:早期B细胞发育(淋巴祖细胞→pro-B细胞→pre-B细胞→未成熟B细胞)中,G2A(GPR132)高表达于pro-B细胞,参与保护细胞在免疫球蛋白基因重排时的基因组稳定性(文献提到“G2A可能保护细胞免受基因组不稳定性影响”);CXCR4通过结合骨髓基质细胞分泌的CXCL12,维持pre-B细胞在骨髓中的滞留——若CXCR4缺失,pre-B细胞会异常进入外周血液(小鼠模型显示,CXCR4缺陷小鼠骨髓pre-B细胞减少,外周血pre-B细胞增多)。
产品关联:文献未提及具体实验产品,领域常规使用CXCR4抗体(如BD Pharmingen的anti-mouse CXCR4)、G2A抗体(如R&D Systems的anti-GPR132)用于流式细胞术检测。
3.2 GPCR在生发中心形成中的调控(外周淋巴器官)
实验目的:解析GPCR对B细胞向滤泡外或生发中心迁移的调控。
核心机制:成熟B细胞通过CCR7(结合CCL19/21)和CXCR4(结合CXCL12)介导的迁移进入淋巴组织;遇到抗原后,EBI2(GPR183)的表达水平决定B细胞命运——EBI2高表达时,B细胞向滤泡外区域迁移,快速分化为短寿命浆细胞(产生早期抗体);EBI2低表达时,B细胞进入滤泡中心,形成生发中心(分为暗区DZ和亮区LZ)。生发中心内,CXCR4高表达的中心母细胞位于DZ(增殖并发生体细胞高频突变),随后CXCR4表达降低,迁移至LZ成为中心细胞(与滤泡辅助T细胞相互作用);S1PR2通过其配体S1P调控生发中心大小,促进B细胞向滤泡中心聚集;P2RY8通过其配体Ggg(S-香叶基香叶基-L-谷胱甘肽)抑制生发中心B细胞的增殖,维持其在生发中心的滞留。
图片插入:
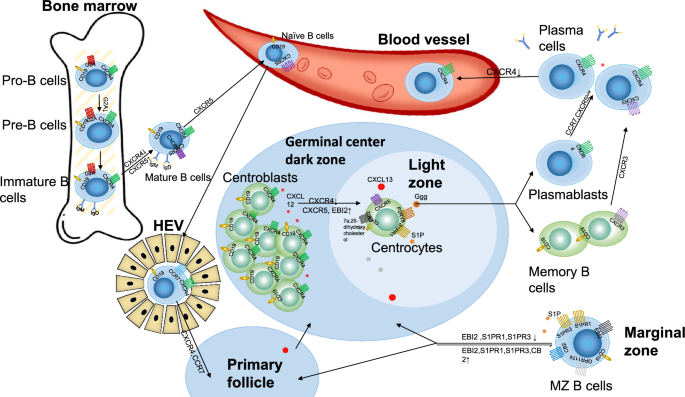
(Fig1展示了GPCR在B细胞发育各阶段的调控网络,如CXCR4维持pre-B细胞在骨髓、EBI2调控生发中心形成)。
3.3 GPCR在浆细胞与记忆B细胞中的调控
实验目的:解析GPCR对浆细胞归巢及记忆B细胞迁移的调控。
核心机制:浆细胞的形成与归巢受CXCR4和EBI2调控——浆细胞高表达CXCR4,结合骨髓中的CXCL12迁移至骨髓,维持长期存活(成为长寿命浆细胞LLPC);EBI2帮助浆细胞前体迁移至滤泡外区域,促进早期抗体产生(文献提到“EBI2缺失小鼠的早期抗体产生显著减少”)。记忆B细胞的迁移受CXCR3调控——CXCR3高表达的记忆B细胞可向炎症组织迁移(如SLE患者的肾脏),参与二次免疫应答(文献提到“CXCR3高表达与记忆B细胞向炎症组织归巢相关”)。
3.4 GPCR在边缘区B细胞中的调控
实验目的:解析GPCR对边缘区(MZ)B细胞定位的调控。
核心机制:边缘区B细胞位于脾脏边缘区,负责快速识别血液中的抗原,其定位受S1PR1、S1PR3与CXCR5的平衡调控——S1PR1/3高表达时,MZ B细胞滞留于边缘区;当遇到抗原(如LPS),S1PR1/3表达降低,MZ B细胞进入滤泡(与T细胞相互作用);CXCR5则引导MZ B细胞向滤泡迁移(文献提到“CXCR5高表达的MZ B细胞可进入滤泡参与免疫应答”)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
文献中涉及的Biomarker均为与自身免疫病关联的GPCR及其配体,筛选逻辑遵循“临床样本检测→动物模型验证→功能实验确认”:① 临床样本中检测到GPCR表达异常(如RA患者滑膜S1PR3高表达);② 动物模型验证异常表达与疾病的关联(如S1PR3缺陷小鼠关节炎症状减轻);③ 功能实验确认其在B细胞调控中的作用(如P2RY8缺失导致B细胞耐受破坏)。
4.2 核心Biomarker研究过程与成果
(1)S1PR3:类风湿关节炎(RA)早期诊断Biomarker
来源:RA患者滑膜组织。
验证方法:免疫组化(IHC)和qRT-PCR检测S1PR3表达。
核心数据:RA患者滑膜组织中S1PR3表达显著高于健康对照(文献未明确样本量,P<0.05),且与疾病活动度(如DAS28评分)正相关;动物模型显示,抑制S1PR3可减轻胶原诱导关节炎(CIA)小鼠的关节肿胀与炎症细胞浸润。
功能关联:S1PR3通过促进滑膜成纤维细胞分泌IL-6,增强B细胞的活化与自身抗体产生(文献提到“S1PR3与免疫细胞呈强正相关,是RA早期诊断的潜在Biomarker”)。
(2)P2RY8:系统性红斑狼疮(SLE)肾损害预后Biomarker
来源:SLE患者外周血B细胞。
验证方法:流式细胞术检测P2RY8表达。
核心数据:SLE患者外周血B细胞中P2RY8表达显著低于健康对照(n=未明确,P<0.05),尤其在狼疮肾炎患者中降低更明显;P2RY8缺失小鼠出现B细胞耐受破坏,产生高滴度抗dsDNA抗体,且年龄相关B细胞(ABCs)显著增多(ABCs是SLE肾损害的关键效应细胞)。
功能关联:P2RY8通过抑制生发中心B细胞增殖,维持免疫耐受——其低表达导致自身反应性B细胞异常扩增,促进狼疮肾炎进展(文献提到“P2RY8低表达与SLE患者肾炎发生率升高相关”)。
(3)CXCR4:SLE自身抗体产生功能性Biomarker
来源:SLE患者骨髓与外周血B细胞。
验证方法:流式细胞术与免疫荧光检测CXCR4表达。
核心数据:SLE患者骨髓与外周血B细胞中CXCR4表达显著高于健康对照(n=未明确,P<0.05);功能实验显示,增强的CXCL12-CXCR4信号延长了自身反应性生发中心B细胞和浆细胞的寿命,导致自身抗体水平升高(文献提到“CXCR4高表达促进自身反应性B细胞在骨髓的滞留与存活”)。
4.3 创新性与临床价值
- S1PR3:首次发现其在RA滑膜中的高表达,为RA早期诊断提供了新靶点(文献提到“S1PR3表现出良好的特异性和敏感性,可作为RA早期 biomarker”);
- P2RY8:首次关联其低表达与SLE肾损害,为狼疮肾炎的预后评估提供了分子标志物;
- CXCR4:明确其在SLE自身抗体产生中的功能性作用,为开发CXCR4拮抗剂(如AMD3100)治疗SLE提供了理论基础。
图片插入(对应关键机制)
- 生发中心调控机制:

(Fig1展示了G2A、CXCR4、EBI2、S1PR2等GPCR在B细胞发育各阶段的调控)。
- 自身免疫病中GPCR作用:
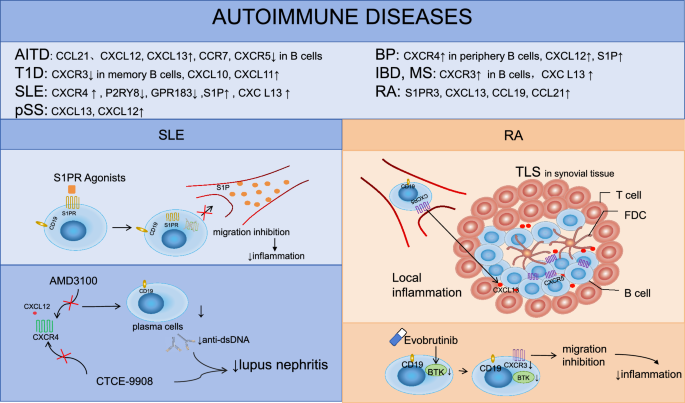
(Fig2展示了S1PR1、CXCR4、CXCR5等GPCR在MS、SLE、RA中的作用)。
本综述通过系统解析GPCR在B细胞发育中的调控网络,为自身免疫病的发病机制提供了新视角,同时为开发GPCR靶向治疗(如S1PR调节剂、CXCR4拮抗剂)提供了重要的理论支持。未来研究需进一步明确未配对GPCR的配体(如部分孤儿受体),并探索GPCR调控网络的协同作用,以实现更精准的治疗干预。
