1. 领域背景与文献引入
文献英文标题:The ketogenic diet increases Neuregulin 1 expression via elevating histone acetylation and its anti-seizure effect requires ErbB4 kinase activity;发表期刊:Cell & Bioscience;影响因子:5.39(2021年);研究领域:神经科学-癫痫的代谢饮食治疗机制。
癫痫是全球最常见的神经系统疾病之一,影响约1%的人口,其中三分之一患者对现有抗癫痫药物耐药,亟需探索新型治疗策略。生酮饮食(KD)作为一种高脂肪、低碳水化合物的饮食模式,自1920年代起被证实可有效缓解难治性癫痫,但具体分子机制仍不明确。前期研究发现,KD喂养可增加小鼠海马神经调节蛋白1(NRG1)的表达,而敲除其受体ErbB4会消除KD对抑制性突触活性和癫痫的改善作用,但KD上调NRG1的具体亚型、调控机制,以及ErbB4激酶活性是否为KD抗癫痫效果的必要条件,这些关键问题尚未解决。本研究针对上述空白,系统探讨了KD对NRG1的调控机制及ErbB4激酶活性的功能需求,为KD的临床应用提供了更清晰的分子基础。
2. 文献综述解析
作者对现有研究的评述逻辑分为三部分:NRG1的亚型与功能、KD的表观遗传调控、ErbB4激酶活性的争议。现有研究表明,NRG1通过可变剪接产生6种亚型(I-VI),其中I、II、III型是脑内主要亚型,不同亚型具有 distinct 的组织分布和功能;KD的主要代谢产物β-羟基丁酸可作为组蛋白去乙酰化酶(HDAC)抑制剂,通过上调组蛋白乙酰化调控基因表达;ErbB4作为NRG1的主要受体,在神经发育、抑制性突触组装中起关键作用,但部分研究显示其功能可能不依赖激酶活性(如促进突触成熟),而KD的抗癫痫效果是否需要ErbB4激酶活性尚未明确。
现有研究的优势在于初步揭示了NRG1/ErbB4通路在KD中的作用,局限在于未明确KD上调的NRG1具体亚型、调控机制,以及ErbB4激酶活性的必要性。本研究的创新点在于:首次证实KD特异性上调海马I型NRG1,且其机制为组蛋白乙酰化修饰;通过药理和基因手段明确ErbB4激酶活性是KD增强抑制性突触活性和抗癫痫的必要条件。
3. 研究思路总结与详细解析
整体框架
研究目标:阐明KD上调NRG1的分子机制及ErbB4激酶活性的功能需求;核心科学问题:KD是否特异性调控NRG1亚型、组蛋白乙酰化是否介导该过程、ErbB4激酶活性是否为KD抗癫痫的必要条件;技术路线:KD处理动物→检测NRG1表达及调控机制→验证组蛋白乙酰化的作用→抑制ErbB4激酶活性→评估突触功能和癫痫表型。
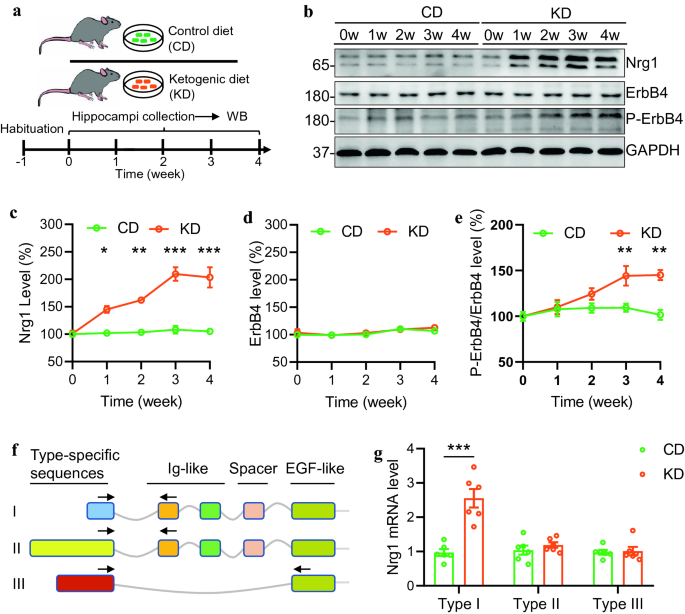
3.1 KD对海马NRG1表达及亚型的影响
实验目的:明确KD是否上调NRG1及具体亚型。
方法细节:将C57/B6小鼠随机分为对照饮食(CD)或KD组,喂养1、2、3、4周后,提取海马组织,通过Western blot检测NRG1、ErbB4及磷酸化ErbB4(P-ErbB4)蛋白水平,qRT-PCR检测I、II、III型NRG1的mRNA水平。
结果解读:Western blot显示,KD组NRG1蛋白水平在1周时开始升高(P=0.0459,n=4),3周达峰值(较0周增加约2倍,P<0.0001,n=4),而ErbB4蛋白水平无显著变化(P=0.077,n=4),P-ErbB4水平在3周时显著升高(P=0.0055,n=4);qRT-PCR结果显示,KD组I型NRG1 mRNA水平较CD组显著升高(P<0.0001,n=5),而II、III型mRNA无差异(P>0.85,n=5)。
实验所用关键产品:NRG1抗体(Santa Cruz,sc-28916)、ErbB4抗体(Santa Cruz,sc-8050)、P-ErbB4抗体(Cell Signaling,Tyr1284)。
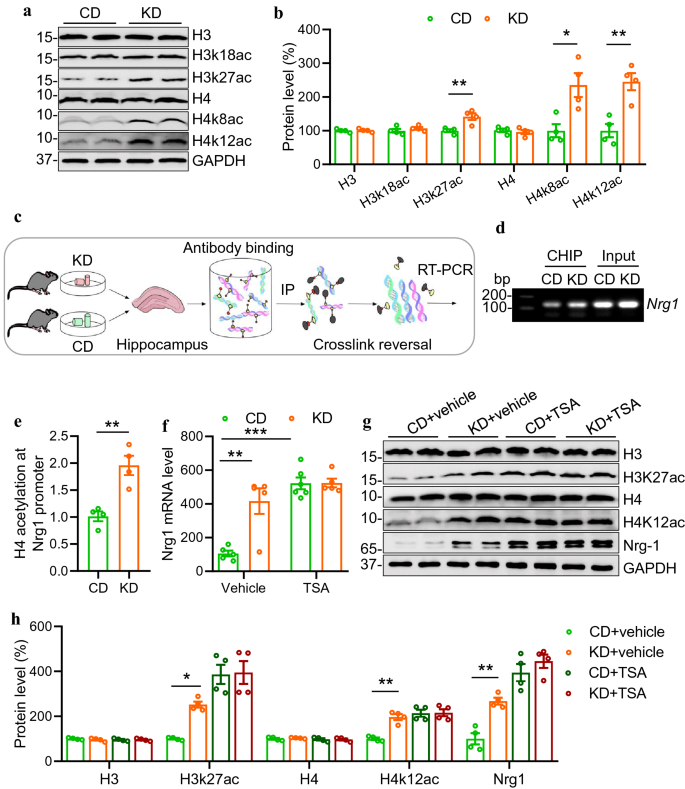
3.2 组蛋白乙酰化介导KD对NRG1的调控
实验目的:验证组蛋白乙酰化是否参与KD上调NRG1的过程。
方法细节:首先通过Western blot检测CD/KD组海马组蛋白H3(K27)、H4(K8/K12)的乙酰化水平;随后采用染色质免疫沉淀(ChIP)技术,用乙酰化H3、H4抗体富集DNA,PCR检测I型NRG1启动子区的乙酰化水平;最后向CD/KD小鼠腹腔注射HDAC抑制剂曲古抑菌素A(TSA,5 mg/kg),检测NRG1的mRNA和蛋白水平。
结果解读:KD组H3K27ac、H4K8ac、H4K12ac水平较CD组显著升高(P<0.01,n=4);ChIP结果显示,KD组I型NRG1启动子区乙酰化H3、H4的 occupancy显著增加(H4乙酰化:P=0.0033,n=4);TSA处理后,CD组NRG1 mRNA水平升高至KD组水平(P<0.0001,n=5),而CD+TSA与KD+TSA组的NRG1 mRNA无差异(P>0.9999,n=5),蛋白水平结果一致。
实验所用关键产品:组蛋白抗体(Active motive,H3:61799、H3k27ac:39133、H4:61299、H4k8ac:61103、H4k12ac:39165)、ChIP抗体(abcam,乙酰化H4:ab233193;Sigma,乙酰化H3:06-599)。
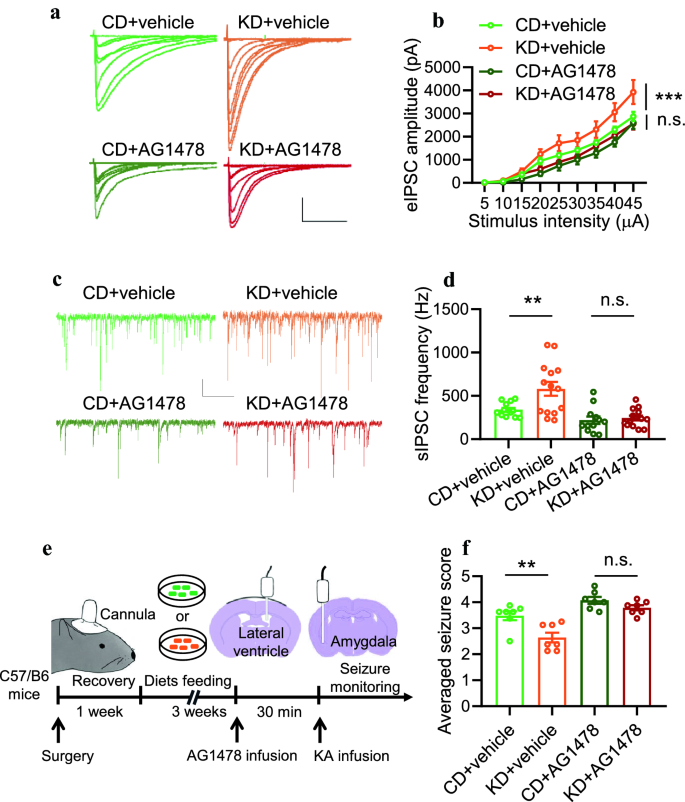
3.3 组蛋白乙酰化介导KD对抑制性突触活性及癫痫的改善
实验目的:验证组蛋白乙酰化是否介导KD的功能效果。
方法细节:TSA处理CD/KD小鼠后,采用全细胞膜片钳技术记录海马CA1区锥体神经元的诱发抑制性突触后电流(eIPSCs)和自发抑制性突触后电流(sIPSCs);随后用 kainic acid(KA)诱导急性癫痫模型,评估seizure score。
结果解读:KD组eIPSCs振幅较CD组显著增加(P<0.0001,n=21神经元/4小鼠),sIPSCs频率升高(P=0.0044,n=13神经元/4小鼠);TSA处理后,CD组eIPSCs振幅和sIPSCs频率升高至KD组水平,CD+TSA与KD+TSA组无差异(eIPSCs:P=0.7815,n=16神经元/4小鼠;sIPSCs:P=0.9099,n=13神经元/4小鼠);癫痫模型中,KD组seizure score较CD组降低(P=0.0076,n=8小鼠),TSA处理后两组无差异(P=0.9756,n=8小鼠)。
3.4 药理抑制ErbB4激酶活性消除KD的效果
实验目的:验证ErbB4激酶活性是否为KD效果的必要条件。
方法细节:向CD/KD小鼠海马切片或侧脑室注射ErbB4激酶抑制剂AG1478(5 μM或5 mM),记录eIPSCs和sIPSCs,或评估KA诱导的seizure score。
结果解读:AG1478处理后,KD组eIPSCs振幅降至CD组水平(P=0.7815,n=14神经元/3小鼠),sIPSCs频率无差异(P=0.9996,n=14神经元/3小鼠);体内实验中,AG1478处理后KD组seizure score与CD组无差异(P=0.7313,n=7小鼠)。
实验所用关键产品:AG1478(Sigma)。
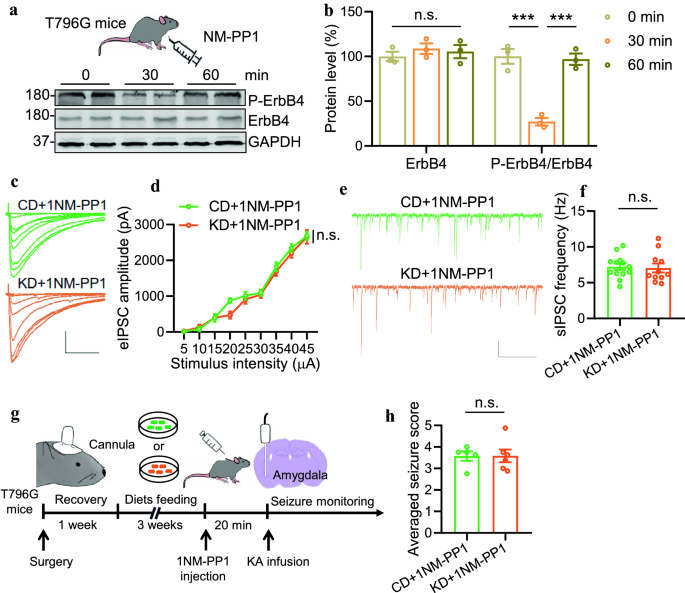
3.5 基因抑制ErbB4激酶活性消除KD的效果
实验目的:排除药理抑制剂的非特异性。
方法细节:使用T796G基因修饰小鼠(ErbB4 ATP结合口袋突变,可被1NM-PP1特异性抑制),CD/KD喂养后注射1NM-PP1(0.1 μg/g体重),记录电生理和seizure score。
结果解读:1NM-PP1处理后,KD组与CD组的eIPSCs振幅(P=0.0735,n=11神经元/3小鼠)、sIPSCs频率(P=0.8189,n=11神经元/3小鼠)无差异;癫痫模型中,两组seizure score无差异(P=0.9829,n=6小鼠)。
实验所用关键产品:1NM-PP1(MedChemExpress,HY-13942)。
4. Biomarker研究及发现成果解析
Biomarker定位
神经调节蛋白1(NRG1,尤其是I型)作为KD抗癫痫效果的功能性Biomarker,筛选逻辑为:KD处理后表达上调→其调控机制(组蛋白乙酰化)被验证→下游功能依赖ErbB4激酶活性→与抑制性突触活性和癫痫表型直接相关。
研究过程详述
Biomarker来源为海马组织(动物实验),验证方法包括:
1. 表达水平验证:Western blot(蛋白水平)、qRT-PCR(mRNA水平)显示KD特异性上调I型NRG1;
2. 调控机制验证:ChIP证实KD通过增加I型NRG1启动子区组蛋白乙酰化上调其表达;
3. 功能验证:电生理记录显示NRG1上调与抑制性突触活性增强相关,癫痫模型显示其与抗癫痫效果相关;
4. 特异性与敏感性:KD仅上调I型NRG1(特异性),喂养1周后开始升高,3周达峰值(敏感性)。
核心成果提炼
- 功能关联:NRG1 I型是KD增强抑制性突触活性和抗癫痫的关键介质(KD组eIPSCs振幅增加P<0.0001,seizure score降低P=0.0076);
- 调控机制:KD通过上调组蛋白乙酰化(H3K27ac、H4K8ac/H4K12ac)增加I型NRG1表达(启动子区乙酰化H4增加P=0.0033);
- 激酶活性需求:ErbB4激酶活性是KD效果的必要条件(药理/基因抑制后,KD组与CD组无差异)。
本研究首次明确了KD上调NRG1的具体亚型和分子机制,以及ErbB4激酶活性的功能需求,为KD的临床应用提供了新的靶点(如HDAC抑制剂或ErbB4激活剂),也为癫痫的精准治疗提供了理论基础。