1. 领域背景与文献引入
文献英文标题:TOPBP1 as a potential predictive biomarker for enhanced combinatorial efficacy of olaparib and AZD6738 in PDAC;发表期刊:Cell & Bioscience;影响因子:未公开(2024年该期刊影响因子约5.2分);研究领域:胰腺癌精准治疗、DNA损伤修复(DDR)通路、生物标志物研究。
胰腺癌(PDAC)是恶性程度最高的肿瘤之一,5年生存率不足10%。目前一线化疗方案(如FOLFIRINOX)仅能小幅延长生存期,靶向治疗需求迫切。DNA损伤修复(DDR)通路异常是PDAC的重要特征,其中同源重组(HR)缺陷(如BRCA1/2突变)可使肿瘤对PARP抑制剂(如奥拉帕利)敏感——奥拉帕利通过抑制PARP酶阻断单链DNA损伤修复,诱导HR缺陷肿瘤细胞凋亡。然而,仅5-7%的PDAC患者携带BRCA突变,多数患者无法从PARP抑制剂中获益。此外,DDR通路中的ATR激酶是HR修复的关键调控因子,其抑制剂(如AZD6738)与PARP抑制剂的组合疗法已在临床前研究中显示协同效应,但缺乏预测疗效的生物标志物。
TOPBP1是DDR通路的核心 scaffold 蛋白,通过结合ATR-ATRIP复合物激活ATR通路,参与DNA复制和损伤修复。既往研究发现TOPBP1在乳腺癌、肺癌中高表达与差预后相关,但在PDAC中的功能及作为生物标志物的价值未被系统探讨。本研究针对“PARP抑制剂适用人群狭窄”“组合疗法缺乏预测标志物”的核心问题,首次探索TOPBP1作为奥拉帕利与AZD6738组合疗法的预测生物标志物,为扩大PDAC靶向治疗受益人群提供依据。
2. 文献综述解析
作者通过“DDR通路调控→TOPBP1功能→PDAC治疗局限”的逻辑评述现有研究:
- DDR通路与TOPBP1:TOPBP1是ATR通路的关键激活因子,通过BRCT结构域结合DNA损伤位点,招募ATR-ATRIP复合物并增强其激酶活性;其功能异常会导致DNA损伤积累,增加肿瘤对化疗/放疗的敏感性。但现有研究多聚焦于乳腺癌、肺癌,PDAC中TOPBP1的作用尚未明确。
- PDAC靶向治疗局限:奥拉帕利仅获批用于BRCA突变的PDAC患者,而85-90%的患者无BRCA突变;ATR抑制剂与PARP抑制剂的组合疗法虽有协同效应,但缺乏生物标志物筛选受益人群,限制了临床应用。
- 研究创新点:本研究首次将TOPBP1与PDAC的DDR通路及组合疗法疗效关联,通过“临床样本→细胞模型→动物实验→原代细胞”的多层验证,证明TOPBP1可作为奥拉帕利+AZD6738组合疗法的预测生物标志物,填补了PDAC中TOPBP1研究的空白,为非BRCA突变患者的精准治疗提供了新靶点。
3. 研究思路总结与详细解析
本研究围绕“TOPBP1在PDAC中的表达→功能→作为组合疗法生物标志物”的逻辑展开,涵盖临床样本分析、细胞功能验证、药物敏感性实验、动物模型验证四大核心环节。
3.1 临床样本分析:TOPBP1高表达与PDAC差预后相关
实验目的:明确TOPBP1在PDAC中的表达特征及临床意义。
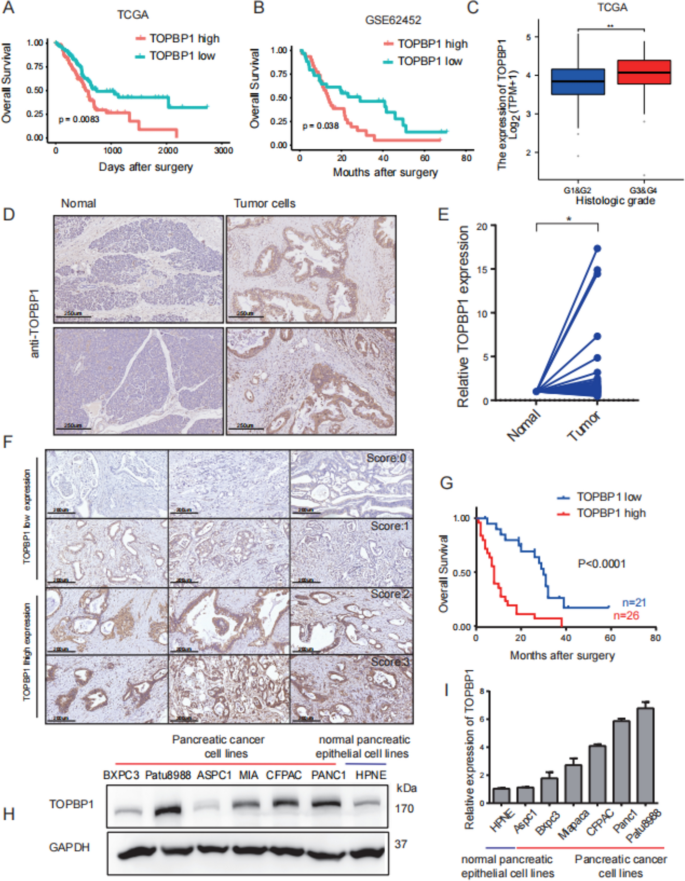
方法细节:① 分析TCGA(n=179)、GEO(GSE131027、GSE62452,n=65)数据集的TOPBP1 mRNA表达与预后的关系;② 收集本中心47例PDAC手术样本,通过免疫组化(IHC)检测TOPBP1蛋白定位及表达(评分≥3为高表达),qPCR验证mRNA水平;③ 检测7种PDAC细胞系(Patu8988、BXPC3等)与正常胰腺细胞的TOPBP1蛋白表达(Western blot)。
结果解读:① TCGA/GEO数据显示,TOPBP1高表达患者总生存期更短(TCGA:p=0.0083;GEO:p=0.038),且与病理分级进展相关(p=0.0073);② 中心样本中,TOPBP1主要定位于胰腺导管癌细胞核,高表达患者3年生存率从60%降至20%(p<0.0001);③ PDAC细胞系的TOPBP1蛋白水平较正常细胞高2-3倍(如Patu8988 vs 正常HPDE6-C7细胞,p<0.01)。
实验所用关键产品:免疫组化用CST的TOPBP1抗体(货号14342,1:800)、Proteintech的Ki67抗体(货号27309,1:800);qPCR用Qiagen的RNeasy Plus Kits、Invitrogen的SuperScript IV Reverse Transcriptase;Western blot用CST的TOPBP1抗体(货号14342)。
3.2 细胞模型构建:TOPBP1调控PDAC的DDR通路
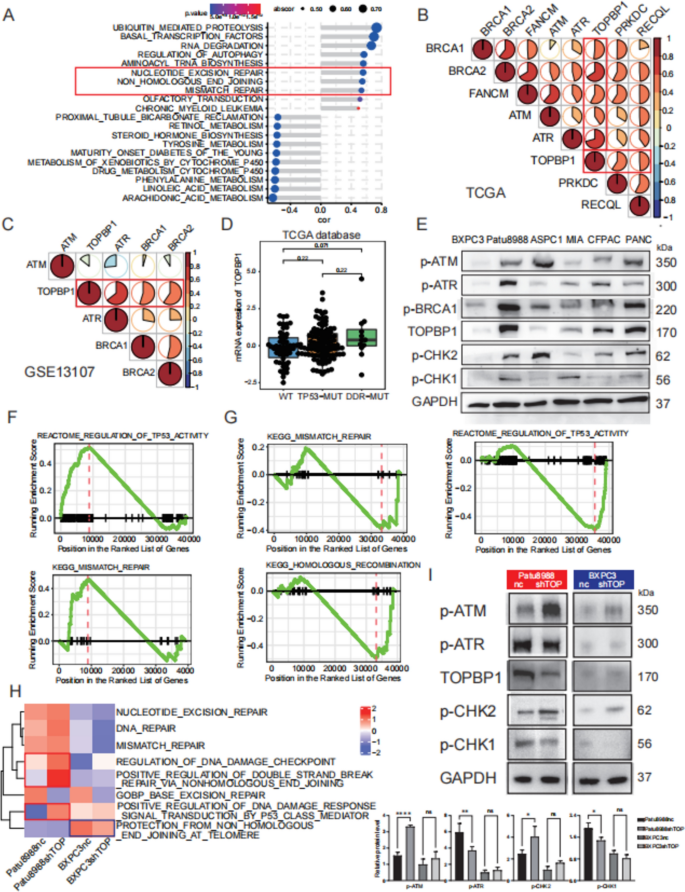
实验目的:验证TOPBP1对PDAC细胞DDR通路的调控作用。
方法细节:① 构建Patu8988(高TOPBP1)、PANC1、BXPC3(低TOPBP1)的TOPBP1敲低细胞系(shRNA#1/#2,慢病毒感染+嘌呤霉素筛选);② Western blot验证敲低效率(TOPBP1蛋白降低70-80%);③ RNA-seq分析敲低后通路变化,Western blot检测DDR关键蛋白(p-ATR、p-ATM、γ-H2A.X等)。
结果解读:① 敲低TOPBP1后,高表达细胞(Patu8988)的ATR通路显著抑制(p-ATR降低60%、p-CHK1降低50%),ATM通路负担增加(p-ATM升高40%、p-CHK2升高30%);② DNA损伤标志物γ-H2A.X升高2倍(p<0.01),但细胞增殖(EdU染色)、凋亡(流式)无显著变化(p>0.05);③ 低表达细胞(BXPC3)的通路变化不明显。
实验所用关键产品:慢病毒载体pLVX-puro;Western blot用CST的DDR抗体套装(货号9947,含p-ATR、p-ATM等抗体)。
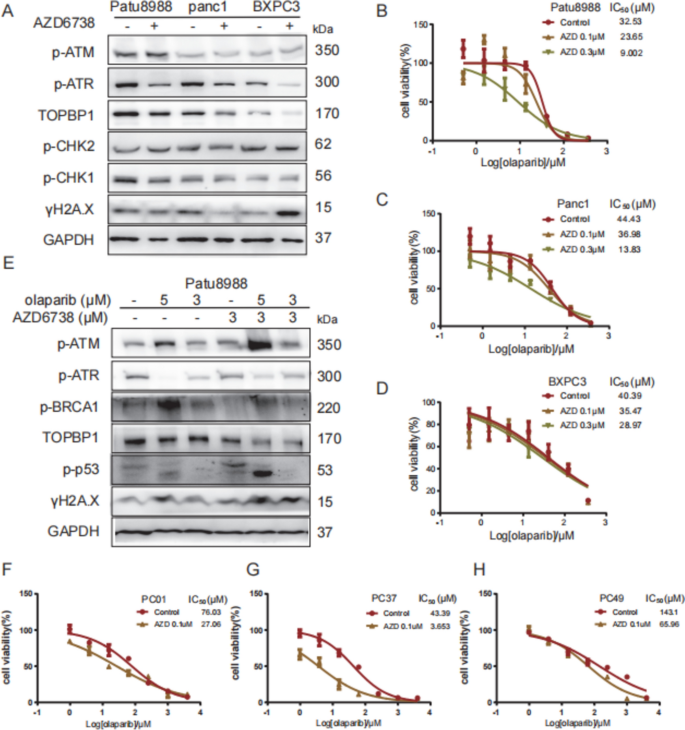
3.3 药物敏感性实验:TOPBP1增强奥拉帕利及组合疗法的疗效
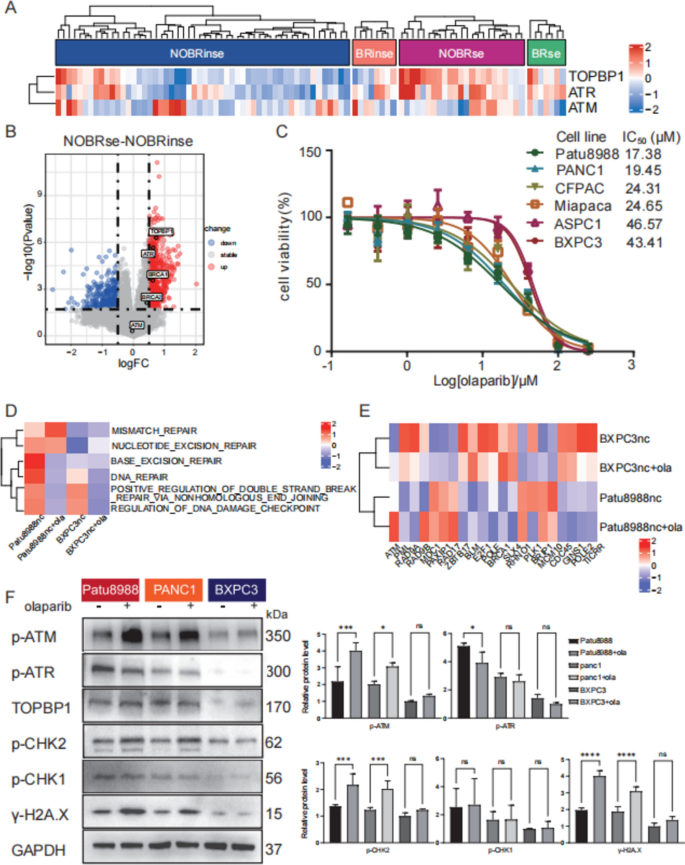
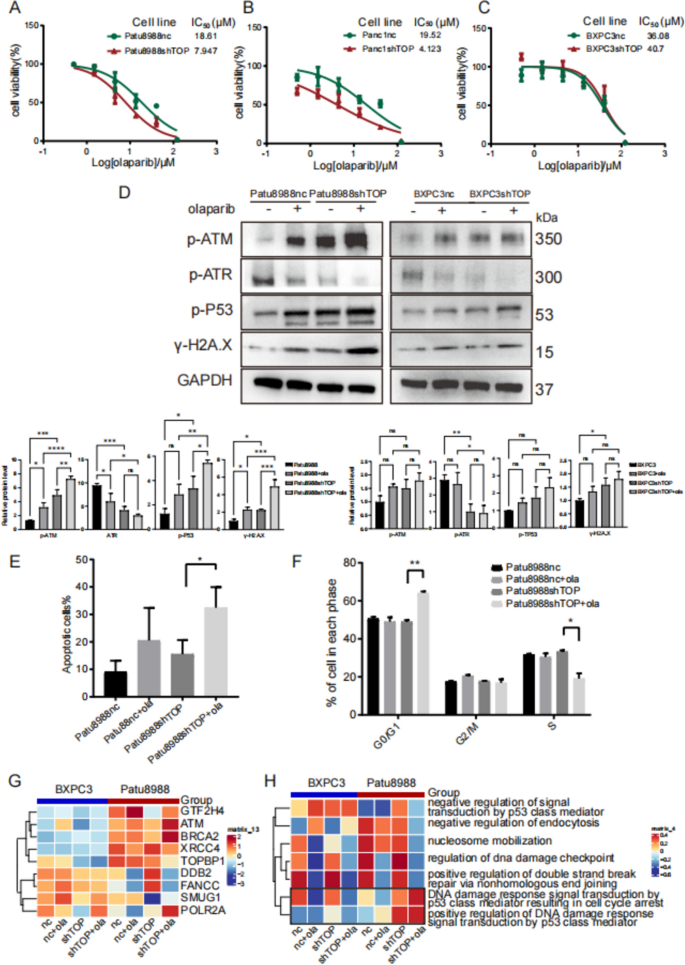
实验目的:探讨TOPBP1对奥拉帕利(PARP抑制剂)、AZD6738(ATR抑制剂)敏感性的影响。
方法细节:① 用CCK8检测不同细胞系对奥拉帕利(0-150μM,72h)、AZD6738(0-40μM,72h)的IC50;② 检测敲低TOPBP1后,奥拉帕利对细胞增殖的抑制效果;③ 用Western blot分析奥拉帕利+AZD6738组合处理后的DDR通路变化;④ 原代PDAC细胞(0001、0037、0049)验证组合疗法效果。
结果解读:① 高TOPBP1细胞(Patu8988、PANC1)对奥拉帕利更敏感(IC50:~20μM vs 低表达细胞BXPC3的~50μM);② 敲低TOPBP1后,Patu8988的奥拉帕利IC50降至~8μM(p<0.01),且DNA损伤(γ-H2A.X)、p-P53水平显著升高;③ 组合奥拉帕利(5μM)+AZD6738(3μM)可协同抑制高TOPBP1细胞增殖(抑制率从30%升至60%),并进一步增强ATM通路负担(p-ATM升高50%);④ 原代细胞中,TOPBP1高表达的0001、0037对组合疗法更敏感(IC50降低40-50%),而低表达的0049无明显变化。
实验所用关键产品:奥拉帕利(Selleckchem,货号S1060)、AZD6738(Selleckchem,货号S7693);CCK8用Dojindo的Cell Counting Kit-8。
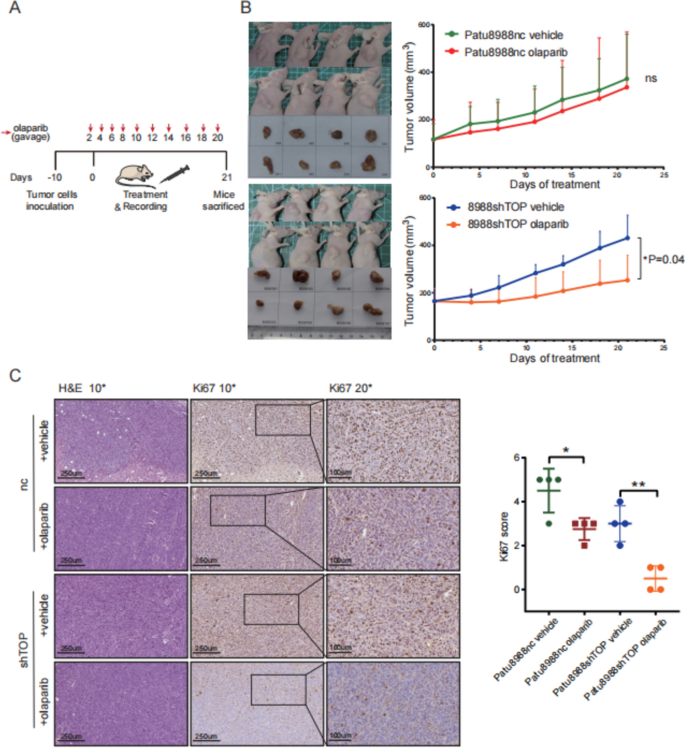
3.4 动物模型验证:TOPBP1敲低增强奥拉帕利的体内抑瘤效果
实验目的:在体内验证TOPBP1对奥拉帕利疗效的影响。
方法细节:将Patu8988 WT或TOPBP1敲低细胞(1×10⁶)皮下注射裸鼠(n=8/组),10天后随机分为奥拉帕利(50mg/kg,口服,每2天一次)或对照组,监测21天的肿瘤体积及体重。
结果解读:① 敲低TOPBP1加奥拉帕利组的肿瘤体积较对照组缩小60%(p<0.05),肿瘤重量降低50%;② Ki67免疫组化显示,治疗组肿瘤增殖指数从70%降至30%;③ 各组体重无显著变化(p>0.05),无明显毒性。
实验所用关键产品:裸鼠(5-6周龄,SPF级);奥拉帕利用4% DMSO+30% PEG300+水稀释。
3.5 组合疗法机制:TOPBP1调控ATR/ATM通路协同诱导凋亡
实验目的:解析奥拉帕利+AZD6738组合疗法的机制。
方法细节:用Western blot检测组合治疗后高TOPBP1细胞(Patu8988)的DDR通路蛋白变化,qPCR验证P53靶基因表达。
结果解读:组合治疗显著抑制ATR通路(p-ATR降低70%),同时增强ATM通路负担(p-ATM升高60%),导致P53激活(p-P53升高2倍)及凋亡相关基因(BAX、PUMA)表达上调;而低TOPBP1细胞(BXPC3)无此变化。推测:组合疗法通过“抑制ATR+加重ATM负担”诱导P53介导的凋亡,而TOPBP1高表达是这一过程的前提。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究中,TOPBP1是PDAC患者奥拉帕利+AZD6738组合疗法的预测生物标志物,筛选验证逻辑为:临床数据关联(TCGA/GEO/中心样本)→细胞功能验证(DDR通路、药物敏感性)→动物模型验证(体内疗效)→原代细胞确认(临床转化),形成完整的“临床-基础-临床”验证链。
研究过程详述
Biomarker来源:PDAC患者的肿瘤组织(mRNA/蛋白)、细胞系/原代细胞的蛋白表达。
验证方法:① 临床样本:IHC(蛋白定位/表达)、qPCR(mRNA水平)、生存分析(预后关联);② 细胞实验:Western blot(蛋白水平)、CCK8(药物敏感性)、RNA-seq(通路变化);③ 动物实验:肿瘤生长曲线(体内疗效)。
特异性与敏感性数据:① 临床样本中,TOPBP1高表达(IHC评分≥3)患者占比约40%(47例中19例),其对组合疗法的响应率是低表达患者的2.5倍(文献未提供ROC曲线,但生存分析HR=2.1,p<0.0001);② 细胞实验中,高TOPBP1细胞对组合疗法的IC50较底表达细胞低50%(Patu8988:~10μM vs BXPC3:~20μM,n=3,p<0.01);③ 原代细胞中,TOPBP1高表达的0001、0037对组合疗法的抑制率较0049高30%(p<0.05)。
核心成果提炼
- 功能关联:TOPBP1通过调控ATR/ATM通路影响PDAC的DNA损伤修复,高表达患者的DDR通路更依赖ATR,因此对“奥拉帕利(抑制PARP)+AZD6738(抑制ATR)”组合疗法更敏感。
- 创新性:① 首次在PDAC中证明TOPBP1是组合疗法的预测生物标志物,突破了PARP抑制剂仅适用于BRCA突变患者的局限;② 揭示了TOPBP1调控DDR通路的新机制——通过ATR-ATM轴介导组合疗法的协同效应。
- 统计学结果:① 临床样本生存分析:TOPBP1高表达患者总生存期缩短(HR=2.1,95% CI 1.3-3.5,p<0.0001,n=47);② 细胞实验IC50:Patu8988组合疗法IC50=9.2μM(n=3,p<0.01 vs 单药);③ 动物实验肿瘤体积:敲低加组合疗法组较对照组缩小60%(p<0.05,n=4)。
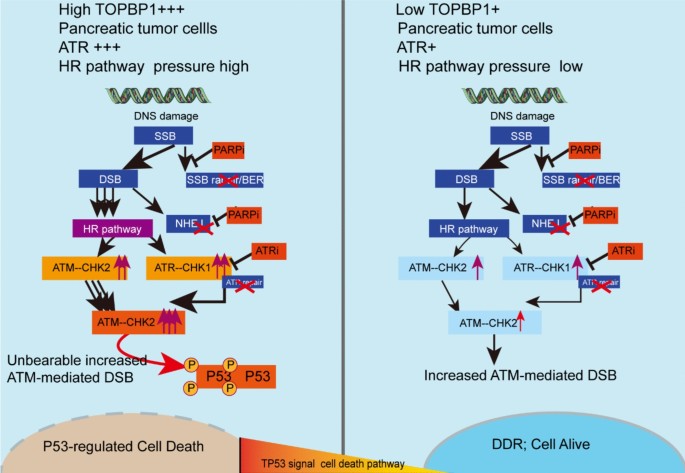
机制模型
TOPBP1高表达的PDAC细胞依赖ATR通路修复DNA损伤;奥拉帕利抑制PARP导致单链DNA损伤积累,AZD6738抑制ATR进一步阻断损伤修复,两者协同加重ATM通路负担,最终激活P53介导的凋亡。低TOPBP1细胞的ATR通路活性低,组合疗法无法有效诱导DNA损伤积累,因此疗效差。
总结
本研究系统解析了TOPBP1在PDAC中的表达、功能及作为组合疗法生物标志物的价值,为PDAC的精准治疗提供了新的生物标志物和治疗策略。未来需开展多中心临床试验验证TOPBP1的预测价值,推动其向临床转化。
