1. 领域背景与文献引入
文献英文标题:Single‐cell transcriptomic landscape reveals the differences in cell differentiation and immune microenvironment of papillary thyroid carcinoma between genders;发表期刊:Cell Biosci;影响因子:未公开;研究领域:甲状腺乳头状癌(PTC)性别差异的单细胞转录组学。
甲状腺癌是全球最常见的内分泌系统恶性肿瘤,其中乳头状甲状腺癌(PTC)占病理类型的75%–85%。性别是PTC的核心预后因素:女性发病率约为男性的3倍,但男性患者疾病更具侵袭性(如更大肿瘤体积、更高淋巴结转移率),5年生存率显著低于女性。现有研究已证实PTC的性别差异与基因表达谱(如TGF-β通路激活、HLA家族下调)、临床表型相关,但单细胞层面的细胞异质性(如恶性上皮细胞的克隆进化)、免疫微环境互作(如肿瘤浸润淋巴细胞与恶性细胞的对话)差异尚未解析,这是PTC性别研究的核心空白。本文旨在通过单细胞RNA测序(scRNA-seq)解析PTC中性别相关的细胞分化和免疫微环境差异,为理解性别对PTC的影响提供单细胞层面的新见解。
2. 文献综述解析
作者对现有研究的分类维度基于“研究层次”与“科学问题”,分为临床流行病学、bulk转录组、免疫微环境三类:
- 临床流行病学研究证实,PTC的性别差异体现在“发病率倒置”(女性高发)与“预后倒置”(男性差);
- bulk转录组研究发现,男性PTC富集细胞增殖通路(如TGF-β),女性富集免疫调节通路(如HLA家族);
- 免疫微环境研究提示,肿瘤浸润B细胞数量与患者预后正相关,但性别对B细胞浸润的影响未明确。
现有研究的局限性在于:(1)无法区分恶性细胞的克隆异质性(bulk测序掩盖了单细胞差异);(2)未解析性别特异性的恶性细胞与近端细胞(成纤维细胞、内皮细胞)的互作模式;(3)对免疫细胞(尤其是B细胞)的性别特异性浸润特征研究不足。
本文的创新价值在于首次利用scRNA-seq描绘PTC的性别特异性单细胞景观:明确了恶性上皮细胞的性别特异性CNV突变与分化轨迹,解析了恶性细胞与成纤维细胞/内皮细胞的互作差异,以及B淋巴细胞的性别特异性浸润特征,填补了PTC性别研究的单细胞空白。
3. 研究思路总结与详细解析
本文的研究目标是解析PTC中性别相关的细胞集群组成、恶性上皮细胞分化及免疫微环境差异;核心科学问题是“性别如何调控PTC的恶性上皮细胞分化及免疫微环境互作”;技术路线遵循“样本收集→单细胞制备→测序分析→功能验证”的闭环逻辑:收集不同性别PTC及结节性甲状腺肿的组织,制备单细胞悬液后进行scRNA-seq,通过细胞聚类、CNV分析、伪时间分化等方法解析性别差异,最终通过统计检验验证结果。
3.1 样本收集与单细胞制备
实验目的是获取高质量的不同性别PTC及结节性甲状腺肿的单细胞样本。
方法细节:收集3例结节性甲状腺肿(对照)、4例男性PTC、7例女性PTC的新鲜组织,用冷生理盐水冲洗后剪碎,加入含40 U/ml DNase I(Gibco)、1.0 ml/ml胶原酶IV(Sigma-Aldrich)的DMEM(Gibco)中37℃消化1小时;通过70μm尼龙细胞筛(Millipore)过滤,胎牛血清(Gibco)重悬后,台盼蓝检测细胞活力(平均≥90%);将男性PTC、女性PTC、结节性甲状腺肿的细胞分别 pooling 到BD Rhapsody的三个通道。
结果:成功制备符合测序要求的单细胞样本,细胞活力和密度满足实验需求。
实验所用关键产品:DMEM(Gibco)、DNase I(Gibco)、胶原酶IV(Sigma-Aldrich)、70μm细胞筛(Millipore)、胎牛血清(Gibco)、BD Rhapsody Single-Cell Analysis System。
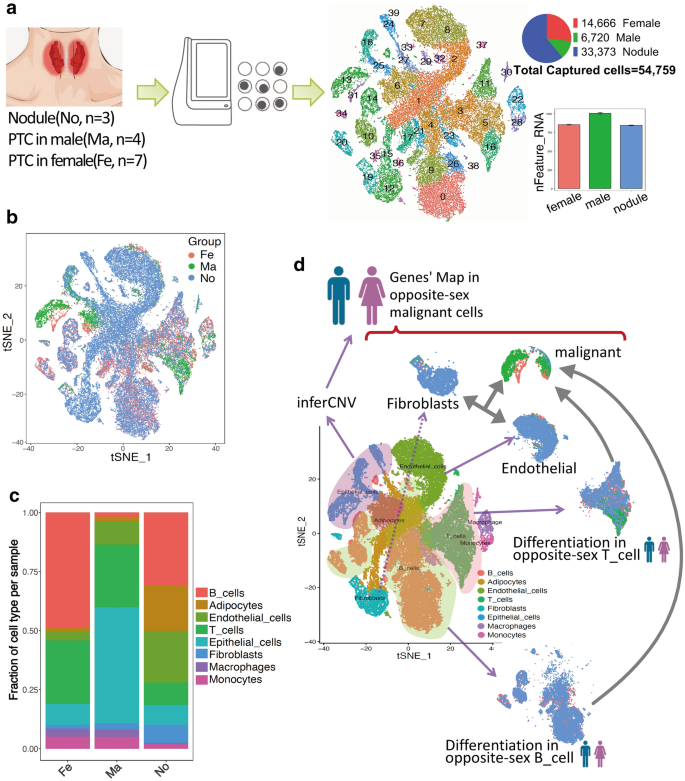
3.2 单细胞RNA测序与细胞聚类
实验目的是构建PTC的单细胞转录组景观,解析性别特异性细胞集群组成。
方法细节:采用BD Rhapsody平台进行scRNA-seq,用Seurat软件(v3.1.2)过滤低质量细胞(基因数>200、线粒体基因比例<10%);计算基因变异系数后进行主成分分析(PCA)降维,通过Louvain算法进行细胞聚类(多分辨率网络),最终用tSNE可视化细胞集群。
结果:共捕获54759个细胞,分为8个主要集群(恶性上皮细胞、成纤维细胞、内皮细胞、B细胞等);性别差异分析显示,女性PTC的内皮细胞、成纤维细胞、B细胞比例显著高于男性(如B细胞比例女性为12% vs 男性为5%,n=7 vs n=4,P<0.05)。
产品关联:Seurat软件、BD Rhapsody测序平台。

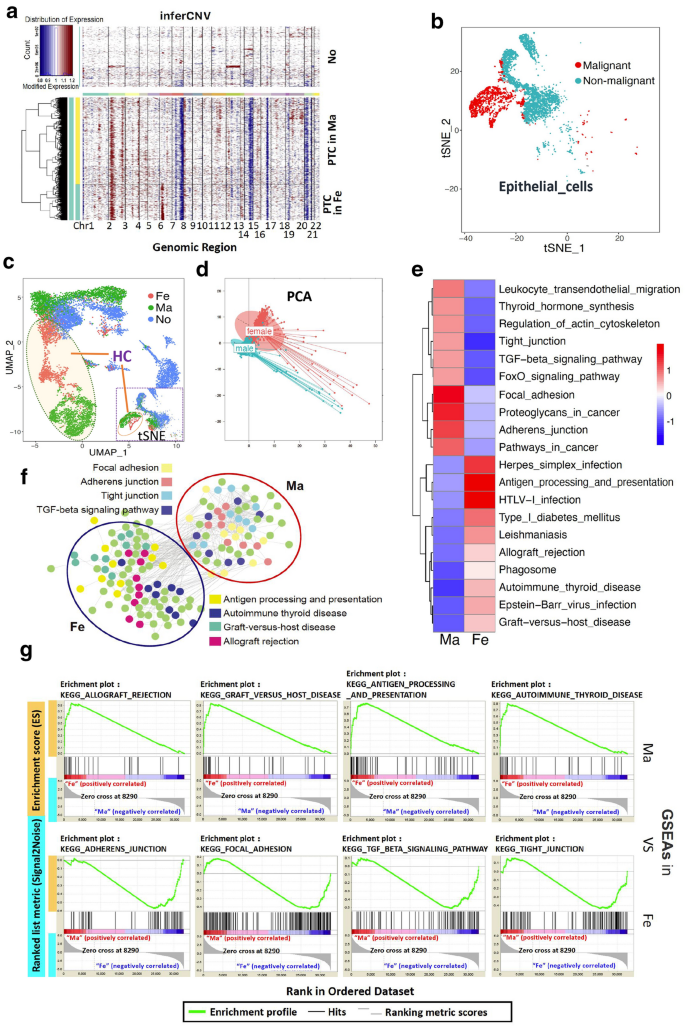
3.3 恶性上皮细胞的CNV与分化分析
实验目的是解析恶性上皮细胞的性别特异性CNV突变和分化轨迹。
方法细节:以结节性甲状腺肿的上皮细胞为对照,用inferCNV工具分析男性、女性PTC上皮细胞的拷贝数变异(CNV);通过PCA分析恶性上皮细胞的基因表达差异,用Monocle软件进行伪时间分化分析。
结果:(1)CNV突变具有性别特异性:男性PTC的恶性上皮细胞主要突变染色体1q、8p,女性为6p、14q(P<0.05);(2)基因表达谱差异:男性高表达RPS4Y1(细胞增殖)、S100A4(侵袭),女性高表达HLA-DRA、HLA-DPB1(抗原提呈)(log2FC>1.0,P<0.05);(3)分化轨迹差异:男性恶性细胞在分化状态2、7富集(涉及focal adhesion通路),女性在状态3富集(涉及抗原处理提呈通路)。
产品关联:inferCNV工具、Monocle软件。
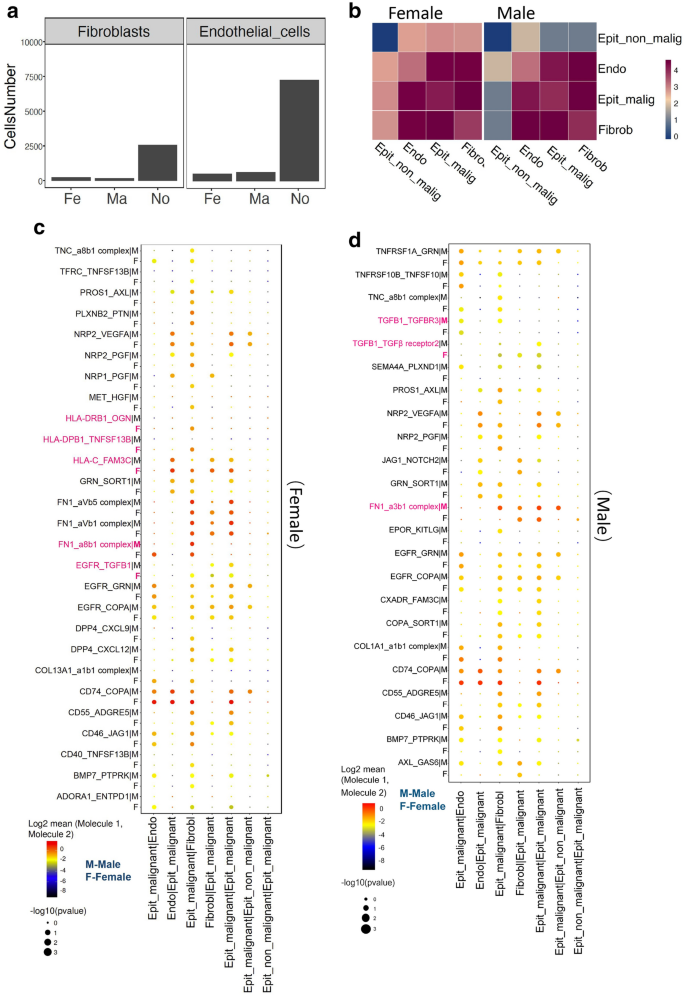
3.4 恶性上皮细胞与近端细胞的互作分析
实验目的是解析恶性上皮细胞与成纤维细胞、内皮细胞的性别特异性互作模式。
方法细节:基于配体-受体对的表达强度,用Spearman相关系数分析细胞互作网络。
结果:女性PTC中,恶性上皮细胞与成纤维细胞/内皮细胞的互作主要依赖HLA家族及其受体(如HLA-DRA与CD4),提示免疫调节为主;男性中主要依赖TGFB1及其受体(如TGFB1与TGFBR1),提示细胞增殖为主。
产品关联:领域常规使用CellPhoneDB工具分析细胞互作,本文未提及具体产品。
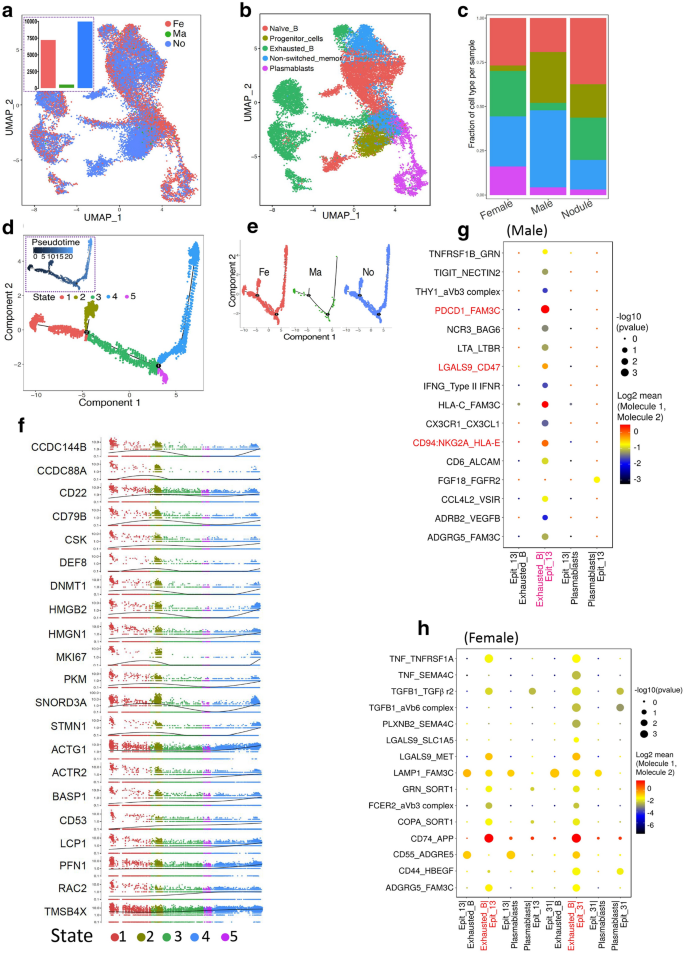
3.5 肿瘤浸润淋巴细胞的性别差异分析
实验目的是解析B、T淋巴细胞的性别特异性浸润特征。
方法细节:用UMAP算法对B、T细胞进行聚类,伪时间分析其分化轨迹,基于配体-受体对分析与恶性细胞的互作。
结果:(1)B细胞层面:男性PTC的B细胞数量显著少于女性(5% vs 12%,n=4 vs n=7,P<0.05),且耗竭B细胞、浆母细胞比例更低;伪时间分析显示,女性B细胞的分化节点(状态2→状态4)更完整,男性缺乏该轨迹;(2)T细胞层面:性别差异不显著,仅vd2_gd_T、NK细胞比例略有不同(无统计学意义);(3)互作差异:男性恶性细胞与耗竭B细胞的PDCD1、CD47互作更强(P<0.05),提示男性B细胞的免疫抑制更显著。
产品关联:UMAP工具、Monocle软件。
4. Biomarker研究及发现成果解析
本文的 Biomarker 类型为性别特异性细胞集群及基因集,包括女性恶性上皮细胞的HLA家族基因、男性的RPS4Y1/S100A4,以及B细胞的分化状态。筛选逻辑遵循“scRNA-seq差异分析→通路富集→功能验证”:首先通过scRNA-seq筛选差异基因(log2FC>0.585,P<0.05),然后进行KEGG富集分析(如男性富集focal adhesion通路,女性富集抗原处理提呈通路),最终通过伪时间分析验证基因与细胞分化的关联。
研究过程详述
- Biomarker 来源:PTC组织的单细胞转录组数据;
- 验证方法:scRNA-seq差异表达分析(Student’s t-test)、KEGG富集分析(Benjamini-Hochberg校正)、伪时间分化分析;
- 特异性与敏感性:女性恶性上皮细胞中HLA-DRA、HLA-DPB1的表达水平显著高于男性(log2FC分别为1.2、1.5,n=7 vs n=4,P<0.05);男性中RPS4Y1、S100A4的表达显著高于女性(log2FC分别为2.0、1.8,n=4 vs n=7,P<0.05);B细胞分化状态中,女性耗竭B细胞比例为8% vs 男性为2%(n=7 vs n=4,P<0.05)。
核心成果提炼
- 女性PTC的免疫调节 Biomarker:HLA-DRA、HLA-DPB1高表达提示女性恶性细胞的抗原提呈能力更强,可能与更优预后相关;
- 男性PTC的增殖/侵袭 Biomarker:RPS4Y1、S100A4高表达提示男性恶性细胞的增殖、侵袭能力更强,与更侵袭性表型一致;
- B细胞分化状态 Biomarker:男性PTC的低耗竭B细胞比例提示免疫抑制更显著,可作为预后不良的标志。
这些 Biomarker 的创新性在于首次在单细胞层面揭示PTC的性别特异性分子特征,为PTC的性别分层诊断(如男性患者重点检测RPS4Y1)和治疗(如女性患者靶向HLA通路增强免疫)提供了潜在靶点。
总结:本文通过单细胞转录组学解析了PTC的性别差异,为理解性别对PTC的影响提供了单细胞层面的证据,也为PTC的精准治疗(如性别分层的免疫治疗)提供了新方向。
