1. 领域背景与文献引入
文献英文标题:Expression of expanded GGC repeats within NOTCH2NLC causes cardiac dysfunction in mouse models;发表期刊:Cell & Bioscience;影响因子:7.1;研究领域:神经退行性疾病(神经元核内包涵体病,NIID)的心脏受累机制。
神经元核内包涵体病(NIID)是一类罕见神经退行性疾病,核心病理特征为神经系统及多内脏器官的p62、泛素阳性核内包涵体。2019年,多项研究独立发现NOTCH2NLC基因5"非翻译区(UTR)的GGC重复序列扩张是NIID的致病因素——扩张的GGC序列可翻译为毒性NOTCH2NLC-聚甘氨酸(polyG)蛋白,形成核内包涵体干扰细胞功能。NIID临床表型高度异质,以认知障碍、小脑共济失调等神经系统症状为主,但近年越来越多证据显示非神经系统受累,其中心脏异常(如心肌病、瓣膜反流、舒张功能障碍)的报道逐渐增多:1991年即有NIID患者心肌细胞发现核内包涵体的报道,近年NOTCH2NLC相关眼咽远端肌病3型(OPDM3)患者也出现严重心脏表现。然而,这些临床证据均缺乏体内实验验证GGC重复扩张与心脏功能障碍的直接关联,机制仍未明确。
本研究针对这一空白,通过构建全身(EIIa-tg)和心肌细胞特异性(Myh6-tg)两种转基因小鼠模型(表达NOTCH2NLC-(GGC)₉₈),首次在体内验证GGC重复扩张对心脏的直接损伤作用,并揭示线粒体功能障碍的关键机制,填补了NIID心脏受累的机制空白。
2. 文献综述解析
文献综述围绕“NIID的病理与病因→临床表型的非神经受累→心脏异常的临床证据→现有研究的局限性”展开核心评述:
- 病理与病因:NIID以神经元及内脏细胞的p62、泛素阳性核内包涵体为特征;2019年的病因突破证实,NOTCH2NLC基因5"UTR的GGC重复扩张是致病根源,后续研究进一步明确其毒性机制——扩张的GGC序列通过核糖体移码翻译为毒性polyG蛋白,形成包涵体干扰细胞功能。
- 非神经受累的临床证据:NIID患者常出现循环、呼吸等系统受累,其中心脏异常是重要表现:1991年报道NIID患者心肌细胞存在核内包涵体及心肌病,近年OPDM3患者也出现严重左心室收缩功能障碍,但这些证据均为临床观察,缺乏体内实验验证因果关系。
- 现有研究的局限性:尽管已知NOTCH2NLC的GGC重复扩张通过polyG毒性导致神经系统损伤,但心脏受累的体内模型缺失,无法明确GGC重复扩张与心脏功能障碍的直接关联,机制研究也处于空白。
本研究的创新价值在于:首次利用转基因小鼠模型直接验证GGC重复扩张对心脏的损伤作用,并通过转录组及功能实验揭示线粒体功能障碍是关键机制,为NIID心脏受累的诊断与治疗提供了首个体内证据。
3. 研究思路总结与详细解析
本研究以“验证NOTCH2NLC的GGC重复扩张对心脏功能的直接影响及机制”为目标,围绕“GGC重复扩张→polyG包涵体→心肌细胞损伤→心脏功能障碍”的核心科学问题,采用“转基因模型构建→病理与功能评估→转录组分析→机制验证→临床关联”的闭环技术路线,系统解析GGC重复扩张导致心脏功能障碍的机制。
3.1 转基因小鼠模型构建与polyG包涵体验证
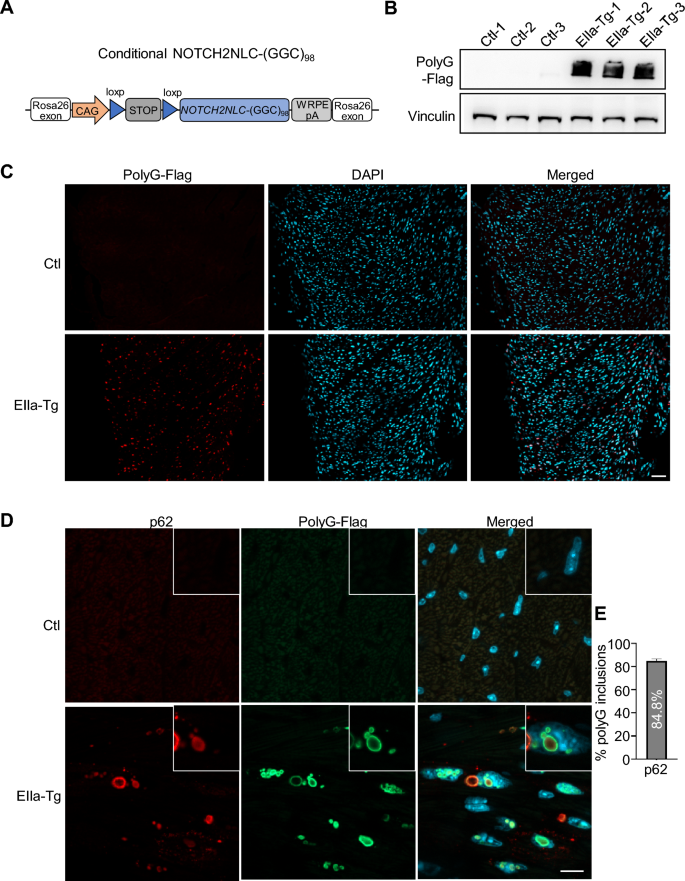
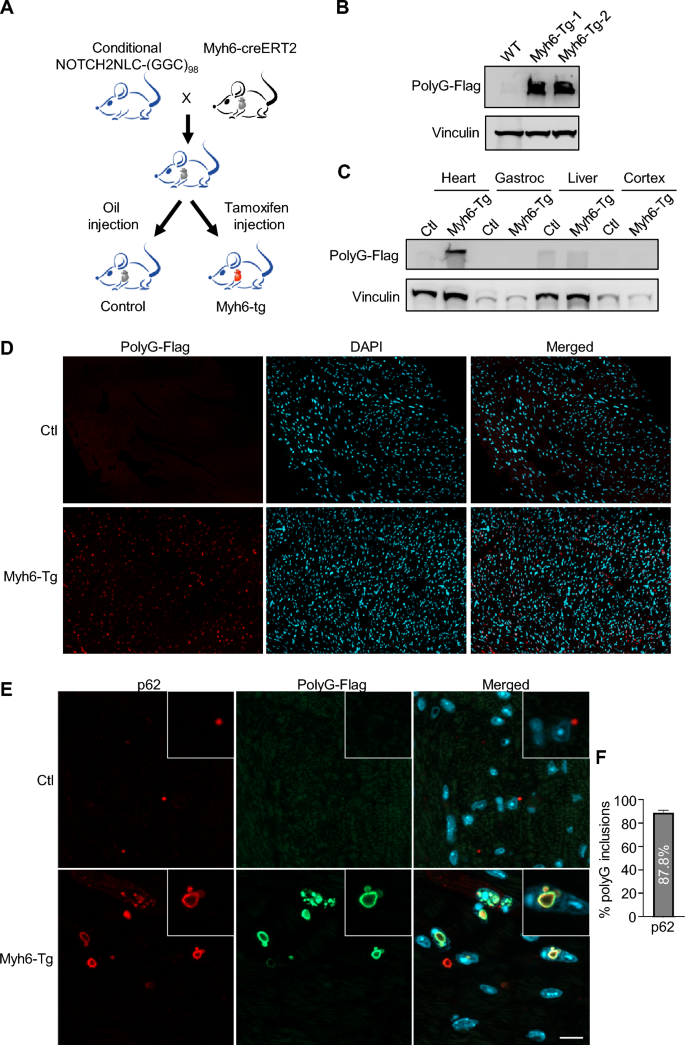
实验目的:构建表达NOTCH2NLC-(GGC)₉₈的转基因小鼠模型,验证心肌细胞中polyG蛋白的表达及核内包涵体形成。
方法细节:将携带loxP-stop-loxP-NOTCH2NLC-(GGC)₉₈的载体插入小鼠Rosa26位点,构建条件性转基因小鼠;与EIIa-Cre小鼠杂交获得全身胚胎期表达的EIIa-tg小鼠,与Myh6-creERT2小鼠杂交获得成年期心肌特异性表达(P60时腹腔注射他莫昔芬75mg/kg,每2天1次共3次)的Myh6-tg小鼠。通过抗Flag抗体的Western blot检测心肌组织中polyG蛋白聚集,免疫荧光染色(抗Flag、抗p62抗体)观察包涵体定位及共定位情况。
结果解读:Western blot显示,EIIa-tg(P30)和Myh6-tg(P90)小鼠心肌组织中均存在polyG蛋白聚集(条带位于堆积胶,提示不溶性聚集),对照小鼠无信号;免疫荧光显示polyG蛋白广泛分布于心肌细胞核内及核周,形成大型包涵体;共染p62显示,EIIa-tg小鼠约84.8%的polyG包涵体为p62阳性,Myh6-tg小鼠为87.8%,与NIID患者的病理特征一致。
产品关联:实验所用关键抗体包括Flag(Sigma-Aldrich,货号F1804;Cell Signaling Technology,货号14793S)、p62(Abcam,货号AB56416)、vinculin(Sigma-Aldrich,货号V9131);他莫昔芬为常规试剂(文献未提及具体品牌)。
3.2 心脏病理与功能评估
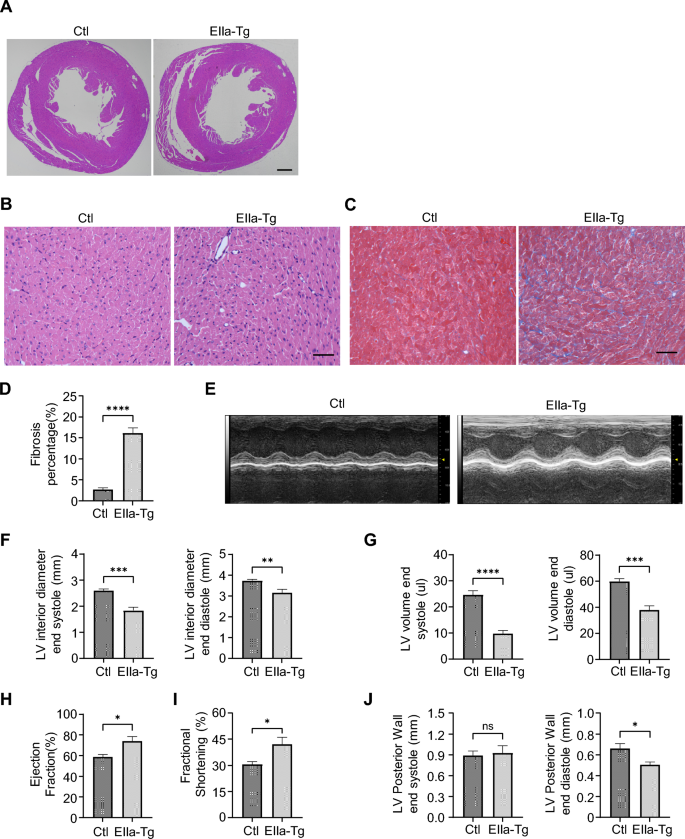
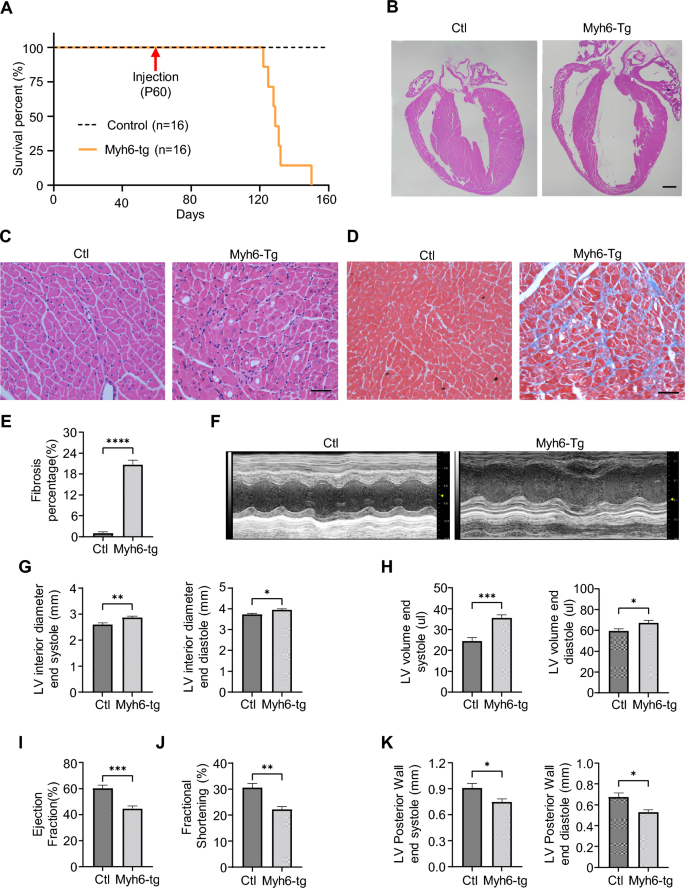
实验目的:评估转基因小鼠的心脏病理变化及功能状态,明确polyG表达对心脏结构与功能的影响。
方法细节:对EIIa-tg(P30)和Myh6-tg(P90)小鼠进行心脏病理分析(HE染色观察细胞浸润,Masson染色评估纤维化);通过Vevo 2100超声心动图系统检测左心室结构指标(舒张末期内径LVID;d、收缩末期内径LVID;s、舒张末期容积LVV;d、收缩末期容积LVV;s、舒张末期后壁厚度LVPW;d、收缩末期后壁厚度LVPW;s)及功能指标(射血分数EF、短轴缩短率FS)。
结果解读:EIIa-tg小鼠HE染色显示心肌轻度炎性细胞浸润,Masson染色显示间质纤维化面积增加;超声心动图显示LVID;d、LVID;s、LVV;d、LVV;s降低(提示心室缩小),EF、FS升高(收缩代偿),LVPW;d降低。Myh6-tg小鼠HE染色显示心脏扩张、室间隔变薄、炎性细胞浸润及空泡变性,Masson染色显示纤维化加重;超声心动图显示LVID;d、LVID;s、LVV;d、LVV;s显著增加(心脏扩张),EF、FS显著降低(收缩功能障碍),LVPW;d、LVPW;s降低。两种模型均出现心脏病理改变,但Myh6-tg的功能障碍更严重。
产品关联:超声心动图使用Vevo 2100系统(VisualSonics);HE及Masson染色试剂为常规病理试剂(文献未提及具体品牌)。
3.3 转录组测序与分子机制分析
实验目的:通过转录组测序解析polyG表达导致心脏功能障碍的分子通路变化。
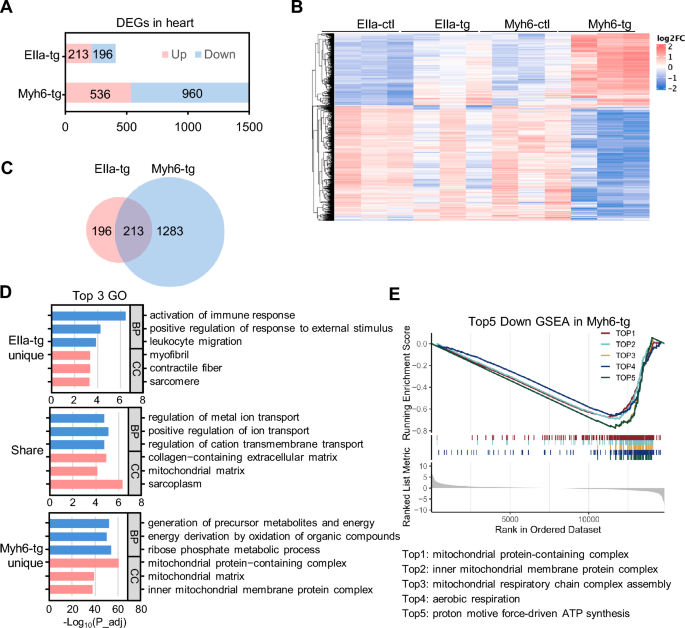
方法细节:收集EIIa-tg(P30)、Myh6-tg(P90)及对照小鼠的心脏组织,提取总RNA进行RNA-seq(Illumina NovaSeq平台,150bp双端测序);通过DESeq2分析差异表达基因(DEGs,P_adj<0.01且|FoldChange|≥2),并进行GO、KEGG富集及基因集富集分析(GSEA)。
结果解读:EIIa-tg小鼠有409个DEGs,Myh6-tg有1496个DEGs(后者是前者的3倍以上,提示心肌特异性模型的分子变化更显著)。GO富集显示:EIIa-tg的独特DEGs富集于免疫反应调控;两者的共同DEGs富集于离子转运、细胞外基质及线粒体相关通路;Myh6-tg的独特DEGs显著富集于线粒体通路及能量代谢。GSEA进一步显示,Myh6-tg小鼠的线粒体呼吸链、有氧呼吸、ATP合成等通路显著下调。这些结果提示,离子转运异常是共同机制,而线粒体功能障碍是Myh6-tg模型心脏功能障碍的关键分子变化。
产品关联:RNA-seq文库构建使用NEB Next UltraTM RNA Library Prep Kit(NEB);测序平台为Illumina NovaSeq(Illumina)。
3.4 线粒体功能验证
实验目的:验证转录组提示的线粒体功能障碍是否真实存在及与polyG表达的关联。
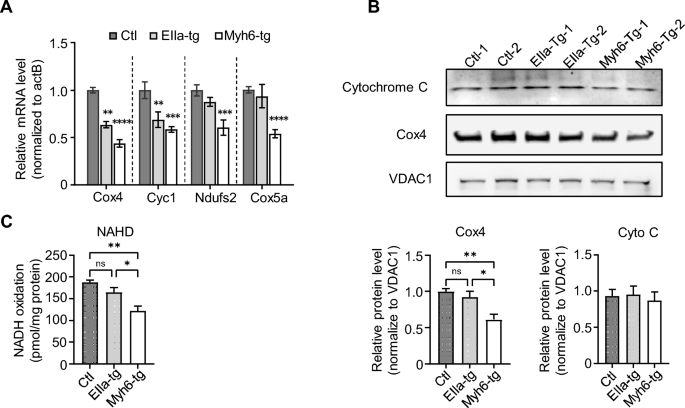
方法细节:从RNA-seq的DEGs中筛选线粒体相关基因(Cox4、Cyc1、Ndufs2、Cox5a),通过qPCR验证其mRNA水平;采用Western blot检测线粒体复合物IV亚基Cox4的蛋白水平;分离小鼠心室线粒体,使用Solarbio BC0630试剂盒检测NADH氧化酶活性(反映线粒体呼吸链功能)。
结果解读:qPCR显示,Cox4和Cyc1的mRNA水平在EIIa-tg和Myh6-tg小鼠中均降低,Ndufs2和Cox5a仅在Myh6-tg中降低;Western blot显示Myh6-tg小鼠Cox4蛋白水平显著降低(n=4,P<0.05);NADH氧化酶活性检测显示Myh6-tg小鼠的NADH消耗率显著降低(n=4,P<0.05),而EIIa-tg无显著变化。这些结果证实,polyG表达导致线粒体相关基因下调及呼吸链功能障碍,且心肌特异性模型的损伤更严重。
产品关联:qPCR使用Power SYBR Green PCR Master Mix(Thermo Fisher Scientific);线粒体分离试剂盒为常规试剂(文献未提及具体品牌);NADH氧化酶活性检测试剂盒为Solarbio BC0630。
3.5 NIID患者心脏异常回顾分析
实验目的:关联小鼠模型结果与临床患者,验证NIID患者的心脏异常情况。
方法细节:回顾性分析中南大学湘雅医院51例NIID患者的心脏相关检查结果(心肌酶、心电图、超声心动图),统计异常比例及类型。
结果解读:51例患者中66.7%(34例)有心脏异常:11.8%(6例)肌酸激酶升高,9.8%(5例)肌酸激酶MB同工酶升高(提示心肌损伤);64.7%(33例)心电图异常(包括心律失常、缺血性ST-T改变);7例接受超声心动图的患者均有异常,包括室间隔增厚(2例)、瓣膜反流(二尖瓣6例、三尖瓣7例)、舒张功能障碍(5例E/A<1)。这些结果与小鼠模型的心脏病理一致,支持NOTCH2NLC的GGC重复扩张与人类NIID患者心脏异常的关联。
产品关联:临床检查使用常规设备(如心电图机、超声心动图仪,文献未提及具体品牌)。
4. Biomarker研究及发现成果解析
本研究涉及三类Biomarker:病理Biomarker(polyG包涵体)、功能Biomarker(线粒体相关基因及酶活性)、临床Biomarker(心脏结构与功能指标),形成“病理-功能-临床”的完整链条。
Biomarker定位与筛选逻辑
- 病理Biomarker:polyG包涵体是NIID的核心病理特征,用于验证模型的病理一致性;筛选逻辑为“转基因模型构建→Western blot检测蛋白聚集→免疫荧光验证包涵体定位”。
- 功能Biomarker:线粒体相关基因(Cox4、Cyc1)及NADH氧化酶活性反映线粒体功能障碍,是心脏功能障碍的关键机制;筛选逻辑为“RNA-seq筛选DEGs→qPCR验证mRNA→Western blot验证蛋白→酶活性验证功能”。
- 临床Biomarker:心脏结构(LVID、LVV、室间隔厚度)与功能指标(EF、FS、E/A比)用于评估患者心脏异常;筛选逻辑为“临床检查→超声心动图验证”。
研究过程与核心成果
- 病理Biomarker:转基因小鼠心肌组织中,polyG蛋白通过Flag抗体Western blot检测到聚集,免疫荧光显示其形成核内/核周包涵体,且与p62的共定位率高达84.8%(EIIa-tg)~87.8%(Myh6-tg),与NIID患者的病理特征完全一致,证明模型的可靠性。
- 功能Biomarker:Myh6-tg小鼠的Cox4 mRNA水平降低(n=3,P<0.05),Cox4蛋白水平降低(n=4,P<0.05),NADH氧化酶活性降低(n=4,P<0.05),证实线粒体功能障碍是心脏功能障碍的关键机制。
- 临床Biomarker:NIID患者中66.7%有心脏异常,7例超声心动图患者均有结构或功能异常(如5例舒张功能障碍),直接关联小鼠模型结果与人类疾病。
创新性与学术价值
本研究首次建立了“GGC重复扩张→polyG包涵体→线粒体功能障碍→心脏功能障碍”的Biomarker链条,为NIID心脏受累的诊断(如polyG包涵体检测)、机制研究(如线粒体通路)及治疗靶点(如线粒体保护)提供了新依据。其中,polyG包涵体可作为NIID心脏受累的病理诊断标志,线粒体相关基因(如Cox4)可作为功能干预的靶点,临床心脏指标(如E/A比)可用于患者的心脏功能监测。
综上,本研究通过体内模型与临床关联,明确了NOTCH2NLC的GGC重复扩张对心脏功能的直接损伤作用及线粒体功能障碍的关键机制,填补了NIID心脏受累的研究空白,为这类罕见病的多器官受累机制研究提供了范例。
