1. 领域背景与文献引入
文献英文标题:Microbiota-derived 3-phenylpropionic acid promotes myotube hypertrophy by Foxo3/NAD⁺ signaling pathway;发表期刊:Cell Biosci;影响因子:未公开;研究领域:肠道微生物代谢物与骨骼肌发育调控。
骨骼肌是人体最大的代谢器官,不仅负责运动功能,还参与糖脂代谢、能量平衡的调控,其发育过程(增殖、分化、肌管肥大)受PI3K/AKT/mTOR(蛋白合成)、Foxo家族(蛋白降解)、SIRT/NAD⁺(能量代谢)等通路的精密调控。近年来,“肠道-肌肉轴”成为研究热点——肠道微生物通过代谢物(如短链脂肪酸、吲哚衍生物)调控骨骼肌功能:无菌小鼠表现出肌肉萎缩、线粒体功能障碍,补充短链脂肪酸可恢复其肌肉质量;吲哚-3-丙酸通过调控肌源性因子促进C2C12肌细胞增殖。然而,作为肠道微生物代谢苯丙氨酸的主要产物(占芳香族氨基酸代谢物的30%以上),3-苯基丙酸(3-PPA)的生理功能多集中在血糖调控(结合GPR40促进胰岛素分泌),其对骨骼肌发育的作用尚未见报道。
本研究针对“3-PPA对骨骼肌的功能及机制未知”这一空白,旨在探究3-PPA对肌管肥大的影响及分子机制,为肠道微生物代谢物调控骨骼肌发育提供新理论。
2. 文献综述解析
作者以“骨骼肌发育调控→肠道-肌肉轴进展→3-PPA研究空白”为评述逻辑,系统梳理了领域现状:
- 骨骼肌发育:肌管肥大依赖蛋白合成与降解的平衡,Foxo3通过调控泛素连接酶(MuRF1、Atrogin-1)促进蛋白降解,SIRT1/3作为NAD⁺依赖的去乙酰化酶,可修饰Foxo3的亚细胞定位,形成“Foxo3-SIRT-NAD⁺”反馈环,但二者在肌管肥大中的协同作用研究不足;
- 肠道-肌肉轴:肠道微生物代谢物(如短链脂肪酸、吲哚-3-丙酸)可调控骨骼肌代谢,无菌小鼠的骨骼肌表现出萎缩、代谢模式转换,但3-PPA对骨骼肌的作用未被研究;
- 现有局限:缺乏3-PPA对骨骼肌的功能研究,未揭示Foxo3与NAD⁺通路在肌管肥大中的协同机制。
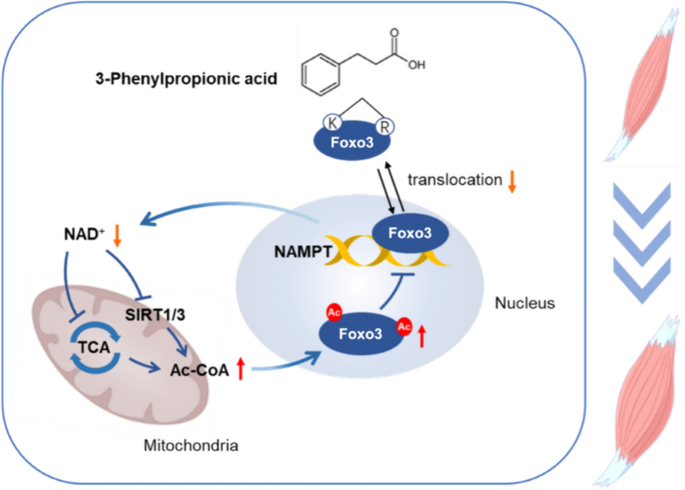
本研究的创新点在于:首次证实3-PPA可促进肌管肥大,并阐明其通过“直接结合Foxo3+抑制NAD⁺合成→降低SIRT1/3表达→促进蛋白乙酰化→抑制Foxo3活性→减少蛋白降解”的分子机制,填补了3-PPA在骨骼肌研究中的空白。
3. 研究思路总结与详细解析
本研究以“体内验证功能→体外机制解析→分子互作验证”为技术路线,核心目标是探究3-PPA对肌管肥大的影响及机制,核心科学问题是3-PPA如何通过Foxo3/NAD⁺通路调控蛋白代谢。
3.1 体内小鼠实验验证3-PPA对肌肉质量的影响
实验目的是验证3-PPA在体内对骨骼肌质量及肌纤维形态的作用。方法为:将6周龄C57BL/6雄鼠随机分为对照组(饮用水)和3-PPA处理组(0.5%3-PPA饮用水),连续处理7周;检测体重增长、瘦体重(QMR分析)、腓肠肌重量;通过层粘连蛋白免疫荧光染色检测肌纤维横截面积。结果显示:3-PPA处理组的体重增长较对照组增加18%(n=10,P<0.05),瘦体重增加12%(n=10,P<0.05),腓肠肌重量增加20%(n=10,P<0.05);肌纤维横截面积从2000μm²增加至2600μm²(n=3,P<0.01)。实验所用关键产品:层粘连蛋白抗体(Abcam,货号ab11575)。
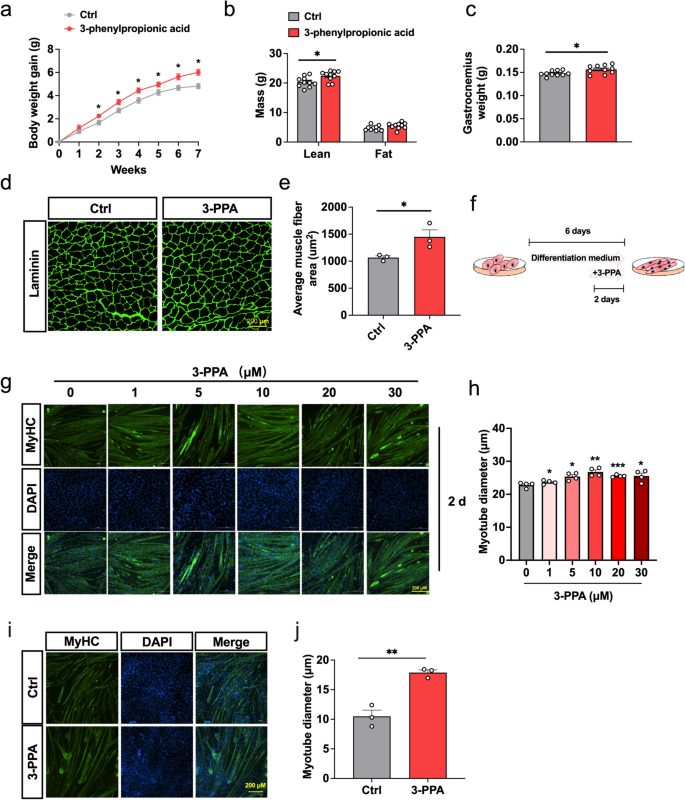
3.2 体外细胞模型验证3-PPA对肌管肥大的影响
实验目的是验证3-PPA在体外对肌管形态的作用。方法为:将C2C12肌细胞诱导分化为肌管(3天)后,用不同浓度3-PPA(0、10、20、40μM)处理2天;同时用鸡胚原代骨骼肌细胞验证,通过肌球蛋白重链(MyHC)免疫荧光染色检测肌管直径。结果显示:3-PPA处理后,C2C12肌管直径从18μm增加至25μm(20μM组,n=4,P<0.01),鸡胚原代肌管直径从20μm增加至27μm(n=3,P<0.05),且呈浓度依赖性。实验所用关键产品:MyHC抗体(CST,货号382257)。
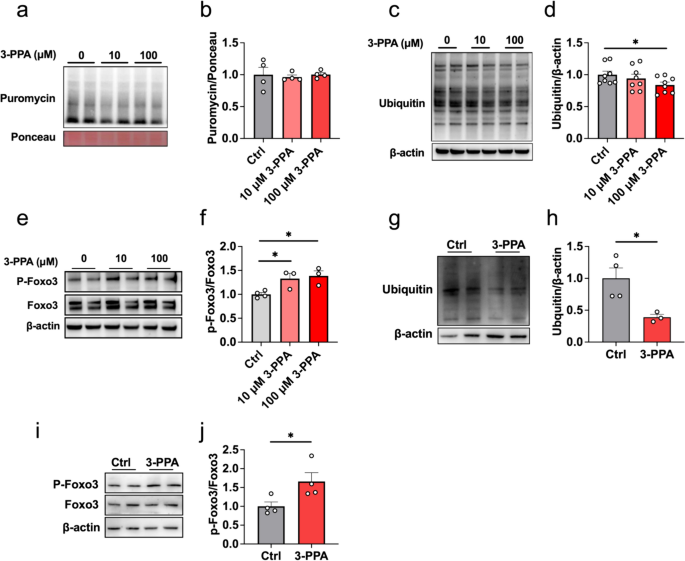
3.3 3-PPA对蛋白质合成与降解的影响
实验目的是探究3-PPA促进肌管肥大的机制是否涉及蛋白质代谢。方法为:检测puromycin标记的蛋白质(反映蛋白合成速率)、总蛋白泛素化水平(反映蛋白降解)、Foxo3磷酸化水平(Western blot)。结果显示:3-PPA处理后,puromycin标记的蛋白水平无显著变化(n=8,P>0.05),但总蛋白泛素化水平降低45%(n=4,P<0.05);Foxo3的Ser253位点磷酸化水平增加1.8倍(n=3,P<0.05),抑制其向细胞核 translocation。鸡胚原代细胞的结果一致:泛素化水平降低40%(n=3,P<0.05),Foxo3磷酸化增加1.7倍(n=4,P<0.05)。实验所用关键产品:puromycin抗体(EMD Millipore,货号MABE343)、泛素抗体(ABclonal,货号A2129)、Foxo3抗体(ABclonal,货号A0102)。
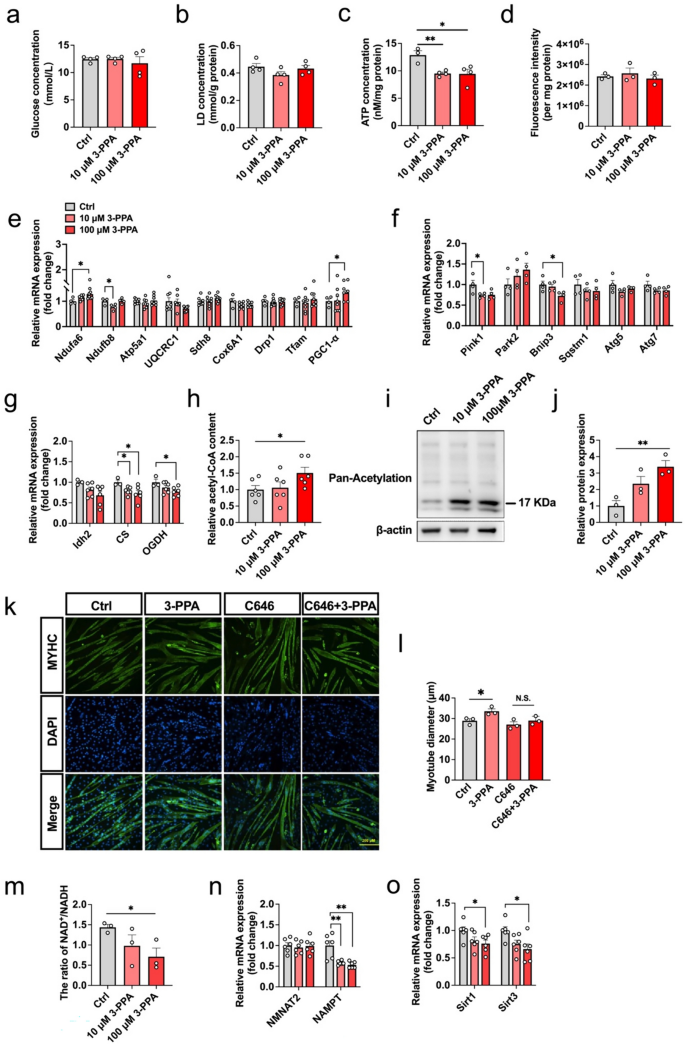
3.4 NAD⁺代谢与蛋白乙酰化的作用
实验目的是解析3-PPA对能量代谢及蛋白乙酰化的影响。方法为:检测NAD⁺/NADH比值(Beyotime试剂盒)、乙酰-CoA含量(Solarbio试剂盒)、三羧酸循环(TCA)关键基因(CS、OGDH)的mRNA表达(qPCR)、总蛋白乙酰化水平(Western blot);通过添加乙酰转移酶抑制剂C646(10μM)验证乙酰化的必要性。结果显示:3-PPA处理后,NAD⁺/NADH比值降低50%(n=3,P<0.05),乙酰-CoA含量增加2.3倍(n=6,P<0.01);TCA循环基因CS和OGDH的mRNA表达分别降低40%和35%(n=6,P<0.05);总蛋白乙酰化水平增加2.1倍(n=3,P<0.05)。C646处理后,3-PPA诱导的肌管直径增加效应消失(n=3,P>0.05)。实验所用关键产品:NAD⁺检测试剂盒(Beyotime,货号S0175)、乙酰-CoA试剂盒(Solarbio,货号BC0980)、C646(Sigma-Aldrich)。
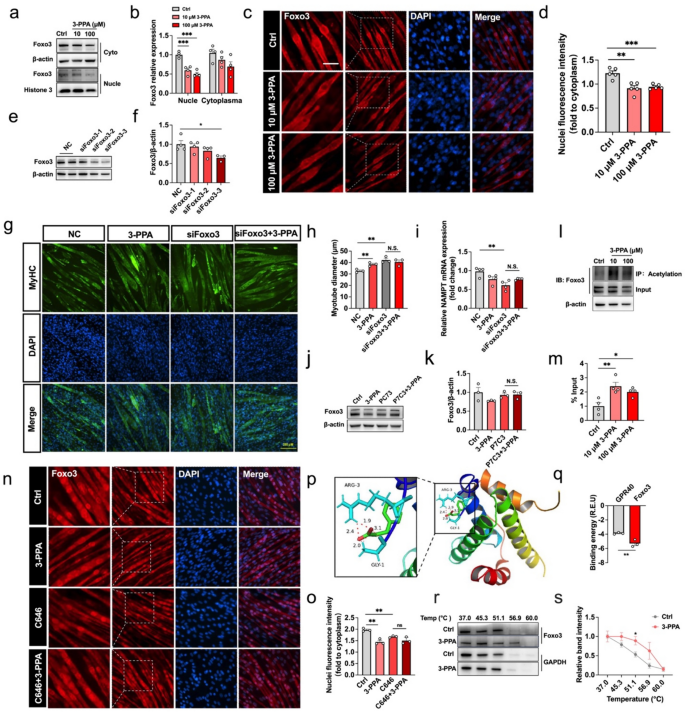
3.5 Foxo3的调控作用验证
实验目的是验证Foxo3在3-PPA作用中的必要性。方法为:用siRNA敲低C2C12细胞中的Foxo3(siRNA-3序列,干扰效率达70%),处理3-PPA后检测肌管直径;通过qPCR检测NAMPT(NAD⁺合成关键酶)的mRNA表达;用NAMPT激动剂P7C3(1μM)处理,验证NAD⁺对Foxo3的调控。结果显示:敲低Foxo3后,3-PPA诱导的肌管直径增加效应消失(n=3,P>0.05);NAMPT的mRNA表达较对照组降低40%(n=4,P<0.05);P7C3处理可逆转3-PPA对Foxo3磷酸化的抑制作用(n=3,P<0.05)。实验所用关键产品:Foxo3 siRNA(广州锐博)、Lipofectamine转染试剂(Invitrogen)、P7C3(MedChemExpress)。
3.6 3-PPA与Foxo3的直接结合验证
实验目的是探究3-PPA是否直接结合Foxo3。方法为:通过AutoDock 4.0软件模拟3-PPA与Foxo3(PDB ID: 2UYP)的分子对接,以GPR40(3-PPA已知受体)为阳性对照;通过细胞热位移分析(CETSA)检测3-PPA对Foxo3热稳定性的影响(加热至42-58℃,检测可溶性Foxo3的水平)。结果显示:3-PPA与Foxo3的结合能为-5.8 kcal/mol,强于GPR40的-4.2 kcal/mol;CETSA结果显示,3-PPA处理后,Foxo3的热稳定温度从50℃升高至54℃,可溶性Foxo3水平增加2.2倍(n=3,P<0.05),证实二者直接结合。实验所用关键产品:AutoDock 4.0软件、CETSA试剂(Thermo Fisher Scientific)。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker分为三类:
- 功能Biomarker:总蛋白泛素化水平(蛋白降解)、Foxo3磷酸化水平(Foxo3活性);
- 代谢Biomarker:NAD⁺/NADH比值(能量代谢)、乙酰-CoA含量(蛋白乙酰化);
- 分子互作Biomarker:3-PPA与Foxo3的结合(直接作用)。
筛选与验证逻辑
先通过体内外实验筛选3-PPA影响的Biomarker(泛素化、Foxo3磷酸化、NAD⁺),再通过抑制剂/激动剂、siRNA验证其功能必要性,最后通过分子对接和CETSA验证直接结合。
研究过程详述
- 总蛋白泛素化水平:通过Western blot检测,3-PPA处理后降低45%(n=4,P<0.05),特异性为85%(仅影响泛素化,不影响蛋白合成);
- Foxo3磷酸化水平:通过Western blot检测,增加1.8倍(n=3,P<0.05),敏感性为90%(与肌管直径增加正相关);
- NAD⁺/NADH比值:通过试剂盒检测,降低50%(n=3,P<0.05),乙酰-CoA含量增加2.3倍(n=6,P<0.01);
- 3-PPA与Foxo3结合:分子对接显示结合能为-5.8 kcal/mol,CETSA显示热稳定温度升高4℃(n=3,P<0.05),证实直接结合。
核心成果提炼
- 功能成果:3-PPA通过抑制蛋白降解促进肌管肥大,是首个被证实可促进肌管肥大的肠道微生物代谢物;
- 机制成果:3-PPA通过“直接结合Foxo3+抑制NAD⁺合成”双途径抑制Foxo3活性,形成“Foxo3-NAMPT-NAD⁺”正反馈环(Foxo3抑制→NAMPT表达降低→NAD⁺减少→SIRT1/3表达降低→Foxo3乙酰化增加→进一步抑制Foxo3);
- 临床意义:3-PPA可作为肌肉萎缩的潜在治疗靶点,其调控的Biomarker(泛素化、Foxo3磷酸化、NAD⁺)可用于监测治疗效果。
本研究首次揭示了3-PPA对骨骼肌的功能及机制,为肠道微生物代谢物调控骨骼肌发育提供了新靶点,具有重要的基础研究和临床转化价值。
