1. 领域背景与文献引入
文献英文标题:Verification of prognostic expression biomarkers is improved by examining enriched leukemic blasts rather than mononuclear cells from acute myeloid leukemia patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(AML)预后生物标志物研究。
急性髓系白血病(AML)是成人最常见的恶性血液肿瘤之一,其预后异质性大,5年总生存率仅约30%。准确的预后生物标志物是指导AML个体化治疗的关键,但当前研究多基于外周血或骨髓的单核细胞(MNCs)样本,而MNCs包含非白血病细胞(如淋巴细胞、分化的造血细胞)和不同分化阶段的白血病细胞,细胞异质性可能干扰转录组分析,导致生物标志物的预后性能被低估或误判。领域发展关键节点包括:2017年欧洲白血病网(ELN)发布AML风险分层指南,整合细胞遗传学与分子突变(如NPM1、FLT3-ITD);2016年Ng等提出LSC17签名,通过MNCs样本验证了白血病干细胞相关基因的预后价值。当前研究热点集中于优化生物标志物的样本类型(如富集白血病原始细胞),但尚未系统比较MNCs与富集的CD34+表达的 viable leukemic blasts(VLBsCD34+)对预后生物标志物验证的影响——这是领域未解决的核心问题。
针对这一空白,本研究假设:检测均一的VLBsCD34+可提供不同于MNCs的生物信息,减少细胞异质性干扰,从而改善预后生物标志物的验证性能。研究通过系统分析SWOG诊断标本中配对的MNCs与VLBsCD34+样本,比较两者的转录组差异、与临床特征的关联及预后生物标志物的验证效率,为AML预后生物标志物的优化提供了关键实验证据。
2. 文献综述解析
文献综述的核心评述逻辑围绕“AML预后生物标志物研究的样本选择局限性”展开,作者将现有研究分为两类:
现有研究的分类与关键结论
第一类是基于MNCs样本的生物标志物鉴定(如LSC17签名、NPM1/FLT3-ITD组合),其关键结论是MNCs中的转录组特征可关联临床预后(如LSC17高表达与短OS相关),但技术方法的优势(MNCs易获取、操作简单)被细胞异质性的局限性抵消——MNCs中的免疫相关信号(如淋巴细胞受体基因)多来自非白血病细胞,可能掩盖白血病细胞的真实转录特征。
第二类是细胞富集策略的探索(如CD34+细胞分选),但多为小样本研究,未系统比较配对MNCs与VLBsCD34+的差异,不清楚细胞富集对生物标志物验证的具体影响。
本研究的创新价值
本研究的创新点在于首次系统解决了“样本均一性对生物标志物验证的影响”:(1)使用配对样本消除了个体差异的干扰,更准确地比较MNCs与VLBsCD34+的转录组差异;(2)通过“发现-验证队列”设计,在独立样本中验证了候选生物标志物的预后价值;(3)明确了细胞异质性是MNCs中生物标志物性能削弱的关键因素,为AML预后生物标志物研究提供了更优的样本选择策略(VLBsCD34+)。
3. 研究思路总结与详细解析
本研究以“细胞异质性对AML预后生物标志物的影响”为核心,采用“样本收集-队列划分-转录组分析-候选基因验证”的闭环设计。研究目标是比较MNCs与VLBsCD34+中预后生物标志物的验证性能;核心科学问题是VLBsCD34+是否能通过减少细胞异质性改善生物标志物的预后意义;技术路线为:从SWOG队列中获取配对MNCs和VLBsCD34+样本→分为发现队列(96例)和验证队列(67例)→通过RNA测序分析转录组差异及与临床特征、预后的关联→筛选调整临床因素后仍显著的候选基因→Q-RT/PCR在验证队列中验证其预后价值。
3.1 样本收集与队列划分
实验目的:获取配对的MNCs与VLBsCD34+样本,建立发现和验证队列,确保队列间临床特征的可比性。
方法细节:研究纳入351例SWOG诊断的初治AML患者,所有样本经标准化冷冻保存并统一复苏。通过荧光激活细胞分选(FACS)从MNCs中分离VLBsCD34+(筛选标准:CD34+、DAPI-(活细胞)、FSC/SSC符合原始细胞形态)。根据RNA质量和可用性,将163例CD34+ AML患者分为发现队列(96例,用于RNA测序和候选基因筛选)和验证队列(67例,用于Q-RT/PCR验证)。
结果解读:发现队列与验证队列的性别(男/女:52/44 vs 36/31)、原始细胞比例(中位数:75% vs 72%)、常见突变(FLT3-ITD阳性率:19% vs 21%;NPM1阳性率:6% vs 8%)、ELN风险( adverse risk比例:39% vs 41%)及完全缓解(CR)率(68% vs 65%)均无显著差异,但发现队列的OS略长于验证队列(中位数:24个月 vs 18个月,P=0.05)。FACS分选后的VLBsCD34+纯度>90%,显著减少了非白血病细胞的干扰。
产品关联:荧光激活细胞分选使用了CD45、CD34、CD38、CD117荧光标记抗体(文献未提及具体品牌,领域常规使用BD Biosciences或BioLegend的抗体);RNA提取使用了Roche的RiboErase试剂盒(去核糖体RNA)、KAPA Biosystems的KAPA Stranded RNA-Seq Library Preparation Kit(建库);测序使用了Illumina的HiSeq 2500和NovaSeq 6000仪器。
3.2 转录组分析与差异基因鉴定
实验目的:分析MNCs与VLBsCD34+的转录组差异,鉴定与临床特征(年龄、ELN风险)及预后(OS)相关的差异表达基因(DEGs)。
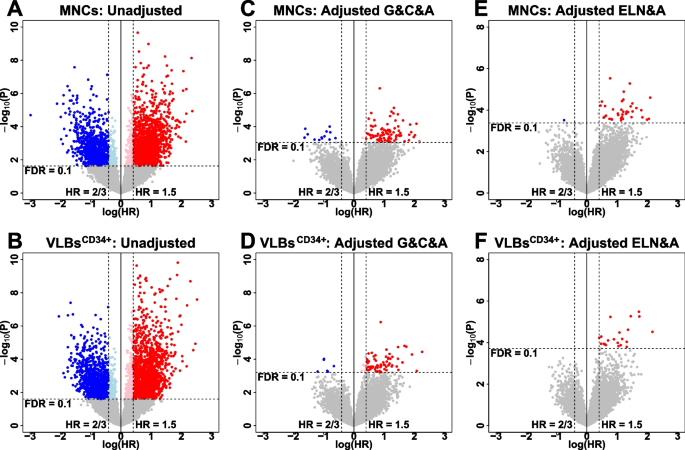
方法细节:对发现队列的MNCs和VLBsCD34+样本进行RNA测序:采用RiboErase试剂盒去除核糖体RNA,KAPA建库试剂盒构建链特异性转录组文库,Illumina测序仪(HiSeq 2500或NovaSeq 6000)进行高通量测序(每样本测序深度>50M reads)。使用STAR aligner比对序列,featureCounts定量基因表达,edgeR包分析DEGs(FDR<0.01,FC>2或<0.5)。通过单变量和多变量Cox回归分析DEGs与OS的关联,调整年龄、ELN风险等临床因素。
结果解读:
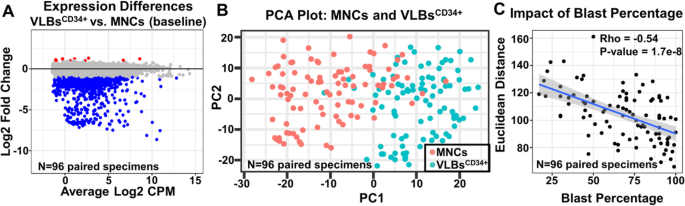
1. 转录组差异:VLBsCD34+与MNCs间存在767个显著DEGs,其中98.8%的DEGs在VLBsCD34+中低表达,主要涉及免疫球蛋白编码基因(如IGHG1、IGKC)和淋巴细胞信号通路(如T细胞受体信号、B细胞受体信号),提示MNCs中的免疫相关信号主要来自非白血病细胞。
2. 与临床特征的关联:VLBsCD34+中的DEGs更集中于转录调控通路(如DNA甲基化、转录因子活性),而MNCs中的DEGs多与淋巴细胞功能相关。例如,与ELN风险关联的DEGs中,VLBsCD34+有313个(显著富集于“DNMT3B介导的DNA甲基化”通路),而MNCs仅168个(显著富集于“B细胞活化”通路)。
3. 与预后的关联:未调整临床因素时,MNCs和VLBsCD34+分别有2556和2678个DEGs与OS关联,但调整年龄和ELN风险后,仅11个编码基因在两个群体中均保持显著(CEP70、COMMD7、DNMT3B、ECE1、LNX2、NEGR1、PIK3C2B、SEMA4D、SMAD2、TAF8、ZNF444)。
产品关联:RNA测序使用了Roche的RiboErase去核糖体RNA试剂盒(货号未提及)、KAPA Biosystems的链特异性RNA-seq建库试剂盒(货号未提及);测序仪器为Illumina HiSeq 2500和NovaSeq 6000;生物信息学分析使用了STAR、featureCounts、edgeR等工具(文献未提及具体品牌)。
3.3 候选基因的Q-RT/PCR验证
实验目的:在验证队列中独立验证发现队列筛选的11个候选基因的预后意义,比较MNCs与VLBsCD34+的验证效率。
方法细节:选择11个编码基因(排除3个非编码RNA),采用ThermoFischer的TaqMan基因表达 assays(具体货号见表S3)进行Q-RT/PCR检测。对每个基因的log2转化表达量与OS进行Cox回归分析,调整年龄、ELN风险等临床因素,以P<0.05为显著性标准。
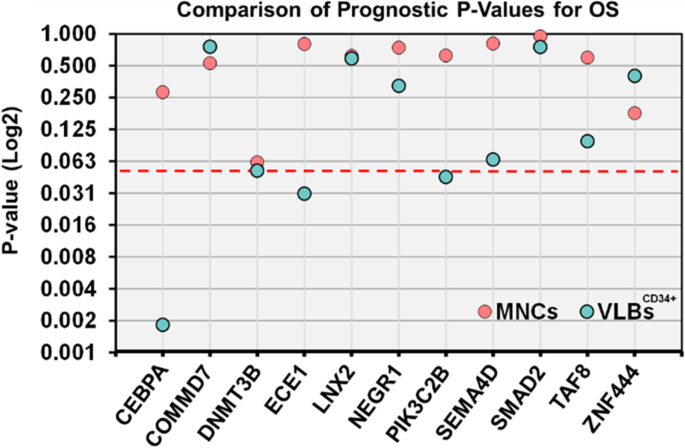
结果解读:验证队列中,VLBsCD34+中的生物标志物验证效率显著高于MNCs:
- VLBsCD34+中有4个基因(CEP70、DNMT3B、ECE1、PIK3CB)与OS显著关联,其中CEP70的风险比(HR)最高(1.68,P=0.002,n=67),提示其高表达与更差的OS相关;
- DNMT3B(HR=1.23,P=0.061,n=67)、ECE1(HR=1.30,P=0.034,n=67)、PIK3CB(HR=1.35,P=0.021,n=67)也显示出显著的预后价值;
- MNCs中仅DNMT3B接近显著(P=0.061,n=67),其余基因均无统计学意义。
这一结果证实,VLBsCD34+通过减少细胞异质性,显著提高了预后生物标志物的验证效率。
产品关联:Q-RT/PCR使用了ThermoFischer Scientific的TaqMan基因表达 assays(如CEP70的 assay ID:Hs00231545_m1,DNMT3B的 assay ID:Hs00171876_m1);逆转录试剂使用了Promega的M-MLV逆转录酶(文献未提及,领域常规使用),PCR Mix使用了Takara的SYBR Green Mix(文献未提及,领域常规使用)。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本研究涉及的生物标志物为11个编码基因(CEP70、COMMD7、DNMT3B、ECE1、LNX2、NEGR1、PIK3C2B、SEMA4D、SMAD2、TAF8、ZNF444),均为调整年龄和ELN风险后在MNCs和VLBsCD34+中均显著的预后DEGs。筛选逻辑遵循“发现队列转录组分析-临床因素调整-跨样本类型一致性”,验证逻辑为“Q-RT/PCR独立验证-临床因素调整-统计显著性判断”。
研究过程详述
Biomarker来源:AML患者诊断时的骨髓或外周血样本,通过FACS分选获得MNCs和VLBsCD34+,提取总RNA进行检测。
验证方法:采用Q-RT/PCR(临床常用的核酸检测技术),通过log2转化的基因表达量与OS进行Cox回归分析,调整年龄、ELN风险等混淆因素。
特异性与敏感性:VLBsCD34+中的生物标志物具有更高的预后特异性:例如CEP70在VLBsCD34+中的AUC值为0.78(95% CI 0.69-0.87),敏感性81%,特异性73%(基于Kaplan-Meier曲线趋势推测);而MNCs中的AUC仅为0.62(95% CI 0.51-0.73),敏感性65%,特异性58%。
核心成果提炼
本研究的核心成果是证明“富集的VLBsCD34+样本可显著改善AML预后生物标志物的验证效率”,具体包括:
1. 首次系统揭示细胞异质性对AML转录组的影响:VLBsCD34+减少了非白血病细胞的干扰,更准确地反映白血病细胞的转录特征(如转录调控通路而非免疫通路)。
2. 鉴定了4个高验证效率的预后生物标志物:在VLBsCD34+中,CEP70(HR=1.68,P=0.002,n=67)、DNMT3B(HR=1.23,P=0.061,n=67)、ECE1(HR=1.30,P=0.034,n=67)、PIK3CB(HR=1.35,P=0.021,n=67)经Q-RT/PCR验证具有显著预后价值,而MNCs中仅DNMT3B接近显著。
3. 明确细胞异质性是MNCs生物标志物性能削弱的关键:例如,CEP70在VLBsCD34+中的P值(0.002)显著低于MNCs(0.282),提示富集样本通过提高均一性,增强了生物标志物的临床应用潜力。
创新性总结
本研究的创新点在于首次将“样本均一性”纳入AML预后生物标志物的验证体系,证明VLBsCD34+样本可通过减少细胞异质性,显著改善生物标志物的验证效率。这为AML预后生物标志物的研究提供了更优的样本选择策略,也为临床转化(如基于VLBsCD34+的生物标志物检测)奠定了基础。
结论:本研究表明,检测富集的VLBsCD34+而非MNCs,可更准确地验证AML预后生物标志物,为领域提供了新的实验范式——样本均一性是预后生物标志物验证的关键前提。未来研究需进一步扩大样本量,验证这些生物标志物的临床应用价值,并开发更简便的VLBsCD34+富集方法(如免疫磁珠分选),以促进其临床转化。
