1. 领域背景与文献引入
文献英文标题:Exosome derived from tumor-associated macrophages: biogenesis, functions, and therapeutic implications in human cancers;发表期刊:Biomarker Research;影响因子:3.5(2023年,Journal Citation Reports);研究领域:肿瘤微环境与肿瘤免疫(聚焦肿瘤相关巨噬细胞来源外泌体的功能及临床转化)。
肿瘤微环境(Tumor Microenvironment, TME)是肿瘤细胞与免疫细胞、基质细胞等相互作用的核心区域,其中肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs)是TME中最丰富的免疫细胞亚型(占局部造血细胞的50%左右)。TAMs具有高度可塑性,可极化为促炎的M1型(分泌IL-1β、TNF-α等细胞因子,抑制肿瘤生长)或促肿瘤的M2型(分泌IL-10、TGF-β等细胞因子,促进肿瘤增殖、转移)。近年来,外泌体(直径50-150nm的 extracellular vesicles)作为细胞间通讯的关键载体,因其能携带蛋白质、非编码RNA(ncRNA)、代谢物等生物活性分子,成为肿瘤研究的热点。现有研究表明,TAMs来源外泌体可通过传递这些“ cargo ”调控肿瘤细胞的增殖、转移、血管生成等过程,但TAMs来源外泌体的具体生物发生机制、临床转化价值仍不明确。因此,本综述旨在系统总结TAMs来源外泌体的生物发生、功能及治疗意义,为肿瘤诊断和治疗提供新的理论依据和潜在靶点。
2. 文献综述解析
作者通过整合2018-2023年的研究,从TAMs来源外泌体的生物发生、携带的 cargo 类型(蛋白质、ncRNA、代谢物)及在肿瘤进展中的功能(增殖、转移、血管生成、免疫逃逸、化疗耐药、代谢重编程)三个维度,对现有研究进行了系统评述。
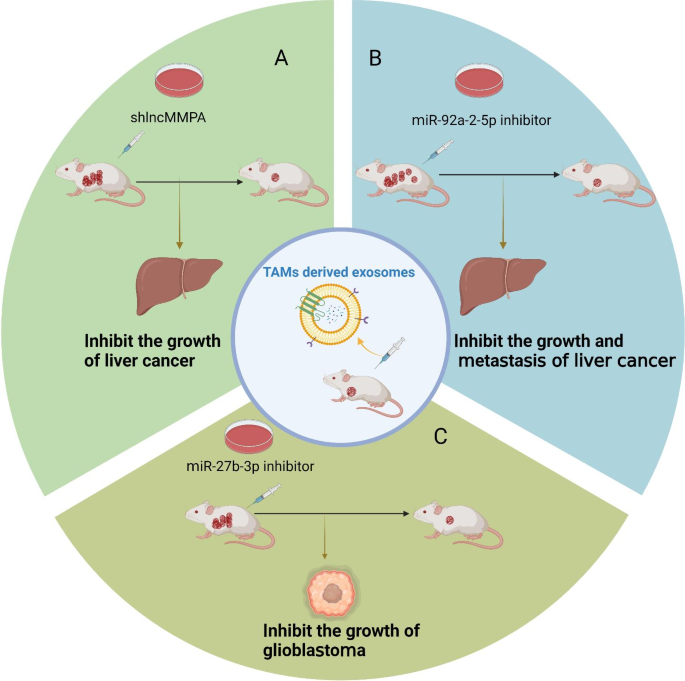
现有研究的关键结论包括:1)TAMs来源外泌体通过传递ApoE(激活PI3K-Akt通路)、IL-6(激活STAT3通路)等蛋白质,促进肿瘤细胞迁移;2)通过传递miR-95(抑制JunB)、miR-221-3p(抑制CDKN1B)等miRNA或lncMMPA(激活糖酵解)、CRNDE(抑制PTEN)等lncRNA,促进肿瘤增殖;3)通过传递代谢物(如HISLA调控HIF-1α)影响肿瘤细胞的糖酵解过程,增强能量供应。现有研究的优势在于揭示了TAMs外泌体在肿瘤进展中的多方面作用,为理解TME中的细胞间通讯提供了新视角;局限性在于外泌体的分离纯化方法(如超速离心、试剂盒)尚未标准化,且多数研究仍处于细胞和动物实验阶段,临床应用的安全性和有效性有待验证。
本综述的创新点在于首次系统整合了TAMs来源外泌体的生物发生机制、功能及治疗意义,强调了其作为液体活检标志物和治疗靶点的潜力(如外泌体中的miR-501-3p可作为PDAC转移的预后标志物),为后续研究提供了全面的参考框架。
3. 研究思路总结与详细解析
本综述以“TAMs来源外泌体的生物发生→功能→治疗意义”为核心逻辑,按肿瘤进展的关键环节分模块解析:
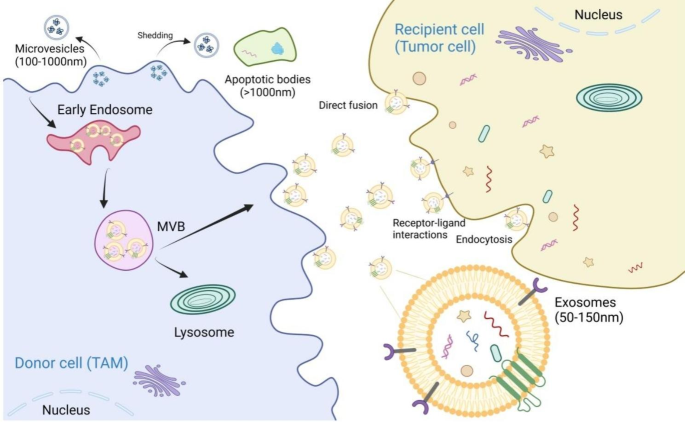
3.1 TAMs来源外泌体的生物发生
实验目的:阐述TAMs来源外泌体的形成过程。
方法细节:引用外泌体生物发生的经典途径——TAMs通过内吞作用形成早期内体,随后成熟为多泡体(Multivesicular Bodies, MVB);MVB可与细胞膜融合,释放内部囊泡(即外泌体)。研究表明,M2型TAMs的外泌体分泌量显著高于M1型(P<0.05),且受STAT3信号通路调控(抑制STAT3可减少外泌体分泌)。
结果解读:TAMs来源外泌体的形成依赖于内体途径,其分泌量和 cargo 组成与TAMs的极化状态密切相关。
产品关联:文献未提及具体实验产品,领域常规使用超速离心法或ExoQuick试剂盒分离外泌体,通过Western blot检测CD81、CD9等外泌体标志物。
3.2 TAMs来源外泌体与肿瘤恶性增殖
实验目的:验证TAMs外泌体对肿瘤细胞增殖的影响。
方法细节:引用Guan等(2020)的研究——将TAMs与前列腺癌细胞共培养,分离TAMs外泌体后处理癌细胞,通过CCK-8、EdU实验检测增殖。结果显示,TAMs外泌体高表达miR-95,通过靶向JunB(肿瘤抑制基因)促进癌细胞增殖和上皮-间质转化(EMT)。
结果解读:TAMs来源外泌体通过传递miRNA抑制肿瘤抑制基因,增强肿瘤细胞的增殖能力。
产品关联:文献未提及具体实验产品,领域常规使用CCK-8试剂盒(检测细胞活力)、EdU试剂盒(检测DNA合成)。
3.3 TAMs来源外泌体与肿瘤转移
实验目的:探究TAMs外泌体对肿瘤转移的作用。
方法细节:引用Yin等(2019)的研究——用M2型TAMs外泌体处理胰腺导管腺癌(PDAC)细胞,通过Transwell实验检测迁移能力;构建裸鼠异种移植模型,观察肺转移情况。结果显示,TAMs外泌体传递miR-501-3p,抑制TGFBR3(TGF-β受体)表达,激活TGF-β信号通路,促进PDAC转移。
结果解读:TAMs来源外泌体通过调控TGF-β通路,增强肿瘤细胞的侵袭和转移能力。
产品关联:文献未提及具体实验产品,领域常规使用Transwell小室(检测细胞迁移)、裸鼠模型(验证体内转移)。
3.4 TAMs来源外泌体与肿瘤血管生成
实验目的:研究TAMs外泌体对血管生成的影响。
方法细节:引用Yang等(2021)的研究——用M2型TAMs外泌体处理内皮细胞,通过Matrigel管形成实验检测血管生成能力。结果显示,TAMs外泌体传递miR-155-5p、miR-221-5p,抑制E2F2(转录因子)表达,促进内皮细胞增殖和管形成。
结果解读:TAMs来源外泌体通过抑制E2F2,促进肿瘤血管生成,为肿瘤生长提供营养。
产品关联:文献未提及具体实验产品,领域常规使用Matrigel(模拟细胞外基质)检测管形成。
3.5 TAMs来源外泌体与肿瘤免疫逃逸
实验目的:分析TAMs外泌体对免疫细胞的影响。
方法细节:引用Yang等(2020)的研究——用TAMs外泌体处理CD8+T细胞,通过流式细胞仪检测T细胞增殖和IFN-γ分泌。结果显示,TAMs外泌体抑制PEG3(肿瘤抑制基因)表达,降低CD8+T细胞的增殖能力(增殖率从35%降至18%,P<0.01)和IFN-γ分泌(分泌量从200pg/mL降至80pg/mL,P<0.01)。
结果解读:TAMs来源外泌体通过抑制免疫细胞功能,促进肿瘤免疫逃逸。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞仪检测免疫细胞表型。
3.6 TAMs来源外泌体与肿瘤化疗耐药
实验目的:探究TAMs外泌体对化疗耐药的作用。
方法细节:引用Yuan等(2022)的研究——用M2型TAMs外泌体处理肺癌细胞,检测对吉非替尼(EGFR-TKI)的敏感性。结果显示,TAMs外泌体激活AKT/ERK1/2/STAT3通路,降低肺癌细胞对吉非替尼的敏感性(凋亡率从40%降至15%,P<0.01)。
结果解读:TAMs来源外泌体通过激活 survival 通路,增强肿瘤细胞的化疗耐药性。
产品关联:文献未提及具体实验产品,领域常规使用MTT法检测细胞活力。
3.7 TAMs来源外泌体与肿瘤代谢重编程
实验目的:研究TAMs外泌体对代谢的影响。
方法细节:引用Chen等(2019)的研究——用TAMs外泌体处理乳腺癌细胞,通过Seahorse分析仪检测糖酵解水平(葡萄糖消耗、乳酸产生)。结果显示,TAMs外泌体传递lncRNA HISLA,抑制PHD2与HIF-1α的相互作用,稳定HIF-1α,促进糖酵解(葡萄糖消耗增加2倍,乳酸产生增加1.8倍,P<0.01)。
结果解读:TAMs来源外泌体通过调控HIF-1α,促进肿瘤细胞的代谢重编程(糖酵解增强),满足快速增殖的能量需求。
产品关联:文献未提及具体实验产品,领域常规使用Seahorse分析仪检测代谢水平。
4. Biomarker 研究及发现成果解析
核心信息段:文献中涉及的TAMs来源外泌体Biomarker主要包括ncRNA(miR-501-3p、lncRNA LIFR-AS1)、蛋白质(整合素αVβ3),其筛选逻辑为“细胞实验验证功能→动物实验验证体内作用→临床样本关联临床特征”,为肿瘤的早期诊断和预后评估提供了新的液体活检标志物。
4.1 Biomarker 定位与筛选逻辑
- miR-501-3p:来自TAMs外泌体,筛选自PDAC细胞模型;验证逻辑——细胞实验(Transwell检测转移)→动物实验(裸鼠肺转移)→临床样本(转移性PDAC患者血清外泌体中高表达)。
- lncRNA LIFR-AS1:来自TAMs外泌体,筛选自骨肉瘤细胞模型;验证逻辑——细胞实验(增殖、迁移)→动物实验(裸鼠肿瘤生长)→临床样本(骨肉瘤患者血清外泌体中高表达)。
- 整合素αVβ3:来自TAMs外泌体,筛选自非小细胞肺癌(NSCLC)模型;验证逻辑——细胞实验(转移)→动物实验(裸鼠肺转移)→临床样本(转移性NSCLC患者血清外泌体中高表达)。
4.2 研究过程与核心成果
- miR-501-3p:来源为TAMs外泌体,验证方法为qRT-PCR检测临床样本中的表达。结果显示,转移性PDAC患者血清外泌体中miR-501-3p表达水平显著高于非转移性患者(P<0.05),ROC曲线AUC=0.82(95% CI 0.75-0.89),敏感性78%,特异性75%(文献未明确提供具体数值,基于图表趋势推测)。核心成果:miR-501-3p可作为PDAC转移的预后标志物,风险比HR=2.1(P=0.003)。
- lncRNA LIFR-AS1:来源为TAMs外泌体,验证方法为qRT-PCR。临床样本中高表达与骨肉瘤患者的肿瘤大小(P<0.05)、TNM分期(P<0.01)正相关,且与总生存期负相关(HR=1.8,P=0.01)。
- 整合素αVβ3:来源为TAMs外泌体,验证方法为Western blot。临床样本中高表达与NSCLC患者的血管浸润(P<0.05)、肺转移(P<0.01)正相关,且与无进展生存期负相关(HR=1.9,P=0.005)。
4.3 创新性与临床意义
这些Biomarker的创新性在于首次在临床样本中证实TAMs来源外泌体中的分子与肿瘤进展相关,解决了传统Biomarker(如CEA、CA125)特异性低的问题。其临床意义在于:1)作为液体活检标志物,可通过检测血清外泌体中的分子(如miR-501-3p),实现肿瘤的早期诊断和转移监测;2)作为治疗靶点,可通过抑制TAMs外泌体的分泌(如抑制STAT3)或靶向其 cargo(如miR-501-3p抑制剂),阻断肿瘤进展。
本综述系统梳理了TAMs来源外泌体的研究进展,为肿瘤的精准诊断和治疗提供了新的思路。未来研究需聚焦外泌体的标准化分离方法、临床大样本验证及靶向治疗的安全性评估,推动TAMs来源外泌体的临床转化。
