1. 领域背景与文献引入
文献英文标题:NME6 is a phosphotransfer-inactive, monomeric NME/NDPK family member and functions in complexes at the interface of mitochondrial inner membrane and matrix;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:NME/NDPK家族蛋白的结构与功能(聚焦线粒体定位成员)
NME/NDPK(核苷二磷酸激酶)家族是调控细胞核苷酸稳态、信号转导及膜动力学的关键酶类,分为Group I(NME1-4)和Group II(NME5-9)。Group I成员为六聚体结构,通过催化位点组氨酸的磷酸化介导NDPK活性(将(d)NTP的γ-磷酸转移至(d)NDP或蛋白),参与肿瘤转移抑制(如NME1)、线粒体GTP供应(如NME4)等过程。相比之下,Group II成员的研究严重滞后,尤其是NME6——作为进化早期出现的成员,其结构、活性及功能存在诸多矛盾:早期研究报道NME6存在186aa和194aa两种异构体,部分研究用GST-NME6检测到低NDPK活性,却未排除标签对蛋白折叠的干扰;虽有报道NME6定位线粒体,但未明确其具体亚结构(外膜/内膜/基质);更缺乏对其生理功能的直接证据。这些矛盾限制了对Group II NME蛋白“非经典功能”(不依赖磷酸转移活性)的理解,尤其是线粒体定位的NME成员如何参与氧化磷酸化等核心过程。
本文的研究初衷是通过整合生物化学、细胞生物学及蛋白质组学方法,系统解决以下问题:(1) NME6的异构体组成与寡聚化状态;(2) NME6是否具有NDPK活性;(3) NME6的线粒体亚结构定位;(4) NME6对线粒体功能的影响及分子机制。研究结果将填补Group II NME蛋白的研究空白,为理解线粒体定位NME成员的功能提供新范式。
2. 文献综述解析
作者对现有研究的分类维度基于NME家族分组及NME6的研究矛盾:
- Group I的核心特征:需形成同源/异源六聚体才能发挥NDPK活性,该活性依赖催化位点组氨酸的磷酸化(如NME1-2调控胞质信号,NME3-4参与线粒体膜动力学)。
- Group II的研究局限:(1) 结构与活性矛盾:早期研究中,Tsuiki等用GST-NME6检测到低NDPK活性,但GST标签可能干扰蛋白寡聚化;Mehus等预测NME6的Kpn环插入会影响六聚体形成,却未实验验证;(2) 定位不明确:虽有报道NME6定位线粒体,但未通过亚线粒体分馏明确具体亚结构;(3) 功能未知:缺乏NME6与线粒体过程(如氧化磷酸化)的直接关联证据。
现有研究的关键结论包括:NME6在多种组织中广泛表达,存在两种异构体,但关于其寡聚化、酶活性及定位的结论不一致。作者认为,矛盾的根源在于实验方法差异(如标签蛋白的使用、检测技术的灵敏度)及对NME6结构-功能关系的理解不足。
本文的创新价值在于:(1) 用无标签/His标签重组NME6明确其单体结构,排除标签干扰;(2) 用质谱和细胞分馏明确NME6的线粒体基质/内膜定位;(3) 发现NME6与RCC1L(线粒体核糖体组装蛋白)的稳定相互作用,揭示其调控线粒体翻译的非经典功能;(4) 通过过表达/沉默实验,首次证明NME6表达水平与氧化磷酸化效率负相关。这些结果不仅解决了早期研究的矛盾,更拓展了NME家族的功能边界——NME蛋白可通过非磷酸转移机制参与线粒体生理。
3. 研究思路总结与详细解析
本文的研究框架为“结构解析→定位验证→功能干预→相互作用研究”的闭环,以下分实验环节详细解析:
3.1 NME6异构体的表达与鉴定
实验目的:明确内源性NME6的异构体组成及丰度。
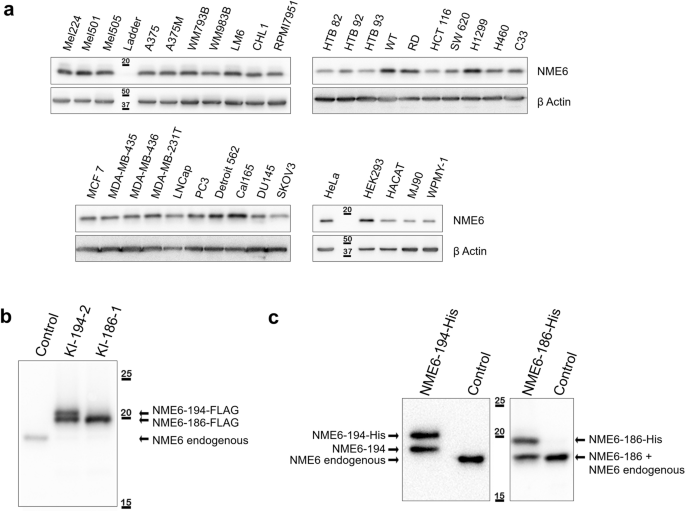
方法细节:(1) 用anti-NME6抗体(Sigma-Aldrich HPA017909)对31种癌细胞系和4种正常细胞系进行Western blot;(2) 构建NME6-186-FLAG和NME6-194-FLAG稳定细胞系,对比内源性与外源性蛋白的迁移率;(3) 用LC-MS分析HeLa和MDA-MB-231T细胞的内源性NME6,检测两种异构体的特征肽段(194aa的MTQNLGSEMASILR、186aa的MASILR)。
结果解读:(1) 所有细胞系中内源性NME6主要为186aa条带(与重组NME6-186-His迁移一致);(2) 过表达NME6-194-FLAG出现两条带(194aa和186aa),而过表达NME6-186-FLAG仅出现186aa条带,且内源性NME6表达下调(负反馈调节);(3) 质谱检测到两种异构体的特征肽段,但186aa的丰度远高于194aa(Western blot未检测到194aa条带)。
产品关联:实验所用关键抗体包括anti-NME6(Sigma-Aldrich HPA017909)、anti-FLAG(Sigma-Aldrich F1804);质谱分析使用Agilent 1290 Infinity LC System和6460 Triple Quad Mass Spectrometer。
3.2 重组NME6的寡聚化与酶活性分析
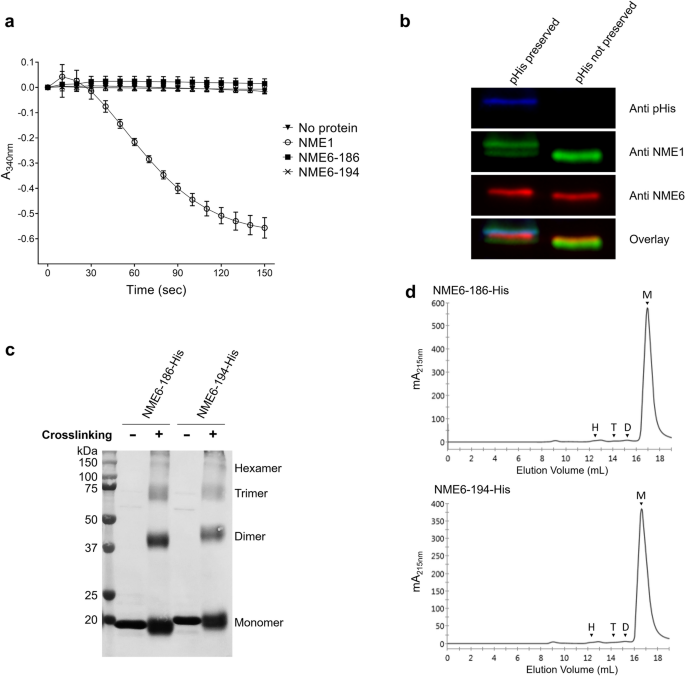
实验目的:验证NME6的寡聚化状态及NDPK活性。
方法细节:(1) 纯化His标签的重组NME6-186/194;(2) 戊二醛交联实验检测寡聚化(0.075%戊二醛孵育15min,SDS-PAGE染色);(3) 尺寸排阻色谱(Superdex 200 Increase 10/300 GL)分析分子量;(4) NDPK活性测定(丙酮酸激酶-乳酸脱氢酶偶联法,dTDP为底物,NME1-His为阳性对照);(5) 内源性NME6的磷酸组氨酸(pHis)检测(保留pHis的Western blot,用anti-pHis抗体)。
结果解读:(1) 交联实验显示重组NME6主要为单体(仅痕量二聚体),无六聚体;(2) 尺寸排阻色谱中,NME6的洗脱体积对应17kDa(单体);(3) NME6无NDPK活性(NME1-His活性为155 U/mg,NME6吸光度无变化);(4) 内源性NME6无pHis信号(催化位点组氨酸未磷酸化)。
产品关联:重组蛋白纯化用Ni-NTA亲和树脂(Takara 635502)、Amicon超滤管(Merck UFC901024);活性测定用丙酮酸激酶(Sigma-Aldrich P7768)、乳酸脱氢酶(Sigma-Aldrich L1254)。
3.3 NME6的线粒体亚结构定位
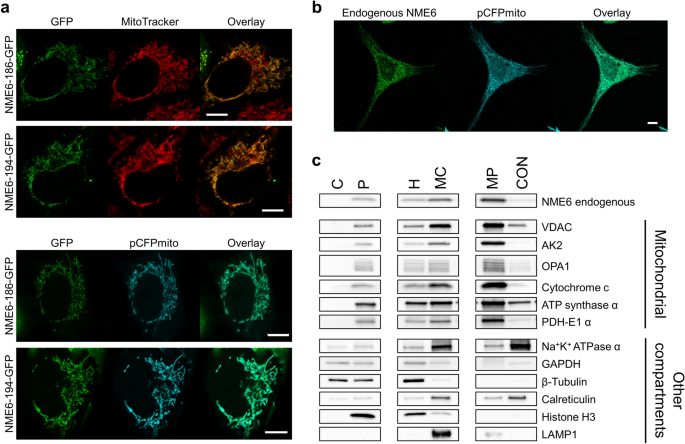
实验目的:明确NME6的线粒体亚结构分布。
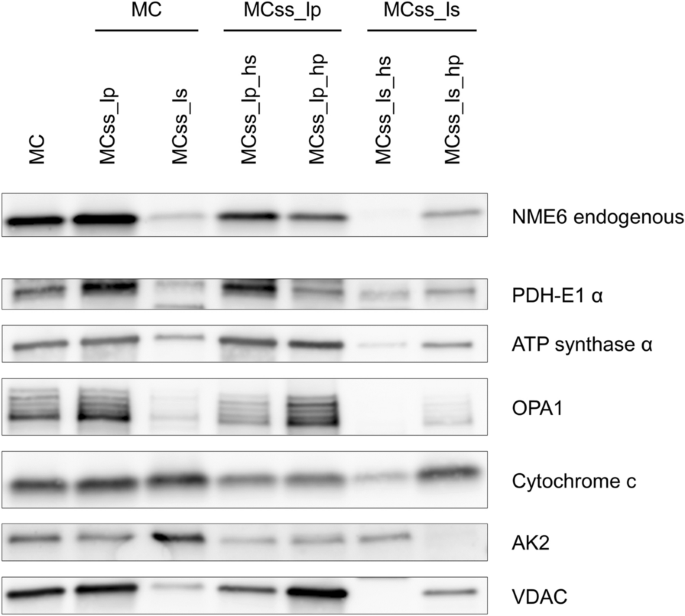
方法细节:(1) 共聚焦显微镜:活细胞中,NME6-186-GFP/NME6-194-GFP与MitoTracker Deep Red或CFPmito共转染;固定细胞中,anti-NME6与CFPmito共染;(2) 细胞分馏(Abcam ab109719试剂盒)分离胞质、线粒体、核组分,Western blot检测标记蛋白(ATP synthase α(线粒体)、GAPDH(胞质)、Histone H3(核));(3) 线粒体亚分馏(肿胀-收缩法)分离内膜/外膜/基质/膜间隙,检测NME6与标记蛋白(ATP synthase α(MIM/基质)、VDAC(MOM)、AK2(IMS))的分布。
结果解读:(1) 共聚焦显示NME6-GFP与线粒体标记完全重叠,时间 lapse(24h)验证定位稳定;(2) 细胞分馏中,NME6仅存在于线粒体组分(与ATP synthase α共定位);(3) 亚线粒体分馏中,NME6主要存在于内膜/基质组分(低速离心沉淀,与ATP synthase α、PDH-E1 α共定位)。
产品关联:共聚焦用MitoTracker Deep Red(Invitrogen M22426)、CFPmito质粒(Clontech);分馏试剂盒为Abcam ab109719;抗体包括anti-ATP synthase α(Abcam ab110415)、anti-VDAC(Dr. Marco Colombini馈赠)。
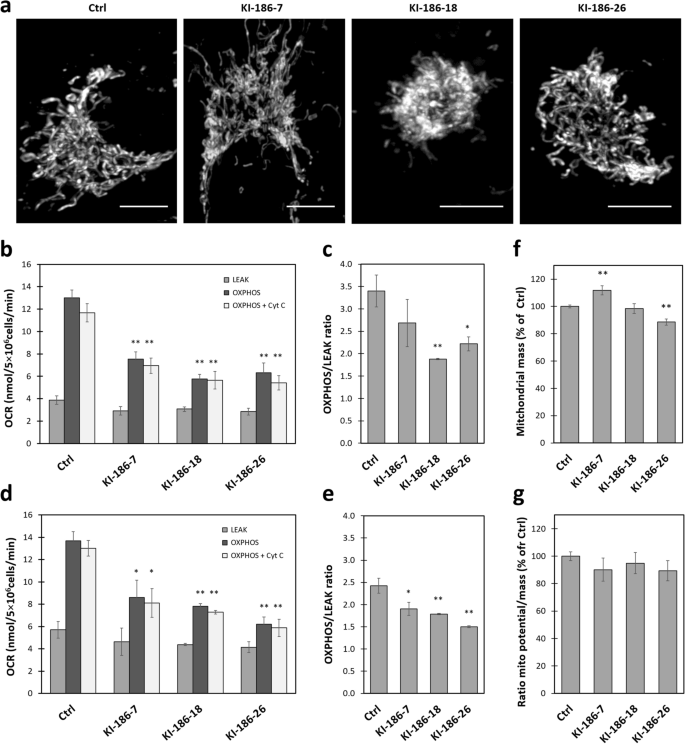
3.4 NME6对线粒体氧化磷酸化的影响
实验目的:探究NME6表达水平对线粒体功能的影响。
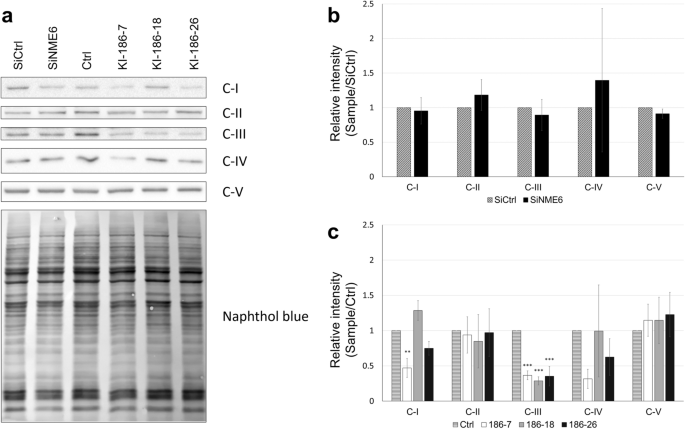
方法细节:(1) 构建NME6-186-FLAG稳定过表达细胞系(KI-186-7、-18、-26),siRNA沉默NME6(Dharmacon L-006755-00-0005);(2) 氧耗率(OCR)测定(Digitonin permeabilized细胞,检测谷氨酸/苹果酸(复合物I)或琥珀酸(复合物II)刺激的LEAK/OXPHOS呼吸);(3) 线粒体质量(Mitotracker Green)、膜电位(TMRM,校正质量)检测;(4) OXPHOS复合物表达(anti-OXPHOS cocktail,Abcam ab110412)。
结果解读:(1) 过表达NME6显著降低OXPHOS呼吸(谷氨酸/苹果酸底物下,KI-186-18的OCR为12 nmol O2/min/5×10^6细胞,对照为17 nmol,P<0.01);(2) OXPHOS/LEAK比值降低(ATP合成效率下降);(3) 线粒体质量和膜电位无变化;(4) 过表达细胞中复合物III丰度降低40%(P<0.01),复合物I/IV有下调趋势,复合物II(全核编码)无变化;(5) 沉默NME6后,OXPHOS呼吸轻微上升(与过表达相反)。
产品关联:siRNA为Dharmacon ON-TARGETplus;OCR测定用Strathkelvin MS200A Oxygraph;OXPHOS抗体为Abcam ab110412。
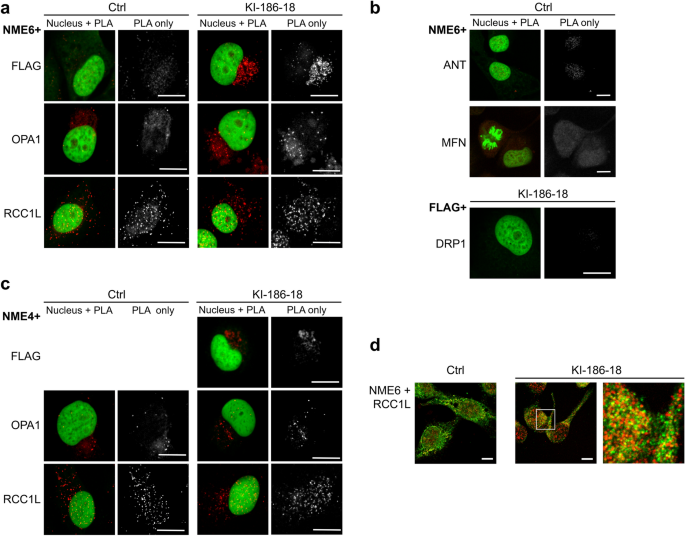
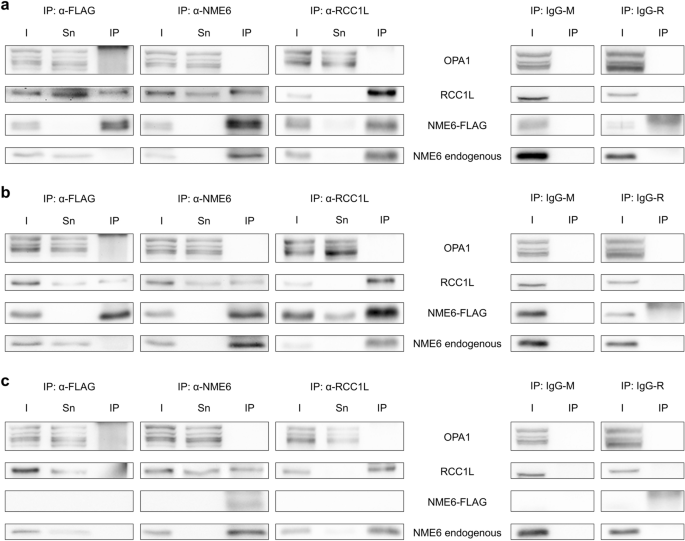
3.5 NME6与线粒体蛋白的相互作用
实验目的:筛选NME6的相互作用蛋白,揭示功能机制。
方法细节:(1) 邻近连接实验(PLA):用anti-NME6与线粒体候选蛋白(OPA1、RCC1L、NME4、ANT、MFN、DRP1)的抗体组合,检测细胞中的相互作用(信号点数量反映proximity);(2) 免疫沉淀(IP):FLAG-agarose沉淀NME6-186/194-FLAG,或anti-RCC1L沉淀RCC1L,Western blot检测共沉淀蛋白;(3) 共聚焦共定位(anti-NME6与anti-RCC1L共染)。
结果解读:(1) PLA显示NME6与RCC1L、OPA1、NME4有显著信号点,与ANT/MFN/DRP1无信号;(2) IP实验中,FLAG-NME6可共沉淀RCC1L,反之亦然(稳定相互作用);但NME6与OPA1无共沉淀(仅proximity);(3) 共聚焦显示NME6与RCC1L在基质/内膜区共定位。
产品关联:PLA试剂盒为Sigma-Aldrich Duolink;IP用FLAG-agarose(Sigma-Aldrich A2220)、Dynabeads Protein G(Invitrogen 10003D);抗体包括anti-RCC1L(Sigma-Aldrich SAB1401860)、anti-OPA1(BD Biosciences 612607)。
4. Biomarker研究及发现成果解析
本文未直接开展疾病Biomarker的临床验证,但通过细胞实验揭示了NME6作为线粒体功能调控标志物的潜在价值:
4.1 Biomarker定位与筛选逻辑
NME6的“Biomarker特性”体现在与线粒体氧化磷酸化的强关联:
- 来源:NME6是线粒体基质/内膜蛋白,可通过线粒体分馏或组织匀浆中的线粒体组分检测;
- 筛选逻辑:过表达/沉默实验发现NME6表达水平与OXPHOS呼吸效率、复合物III丰度负相关,提示其可作为线粒体功能(尤其是复合物III活性)的调控标志物;
- 验证方法:Western blot检测细胞/组织中的NME6丰度,结合氧耗率或OXPHOS复合物表达分析,验证其与线粒体功能的关联。
4.2 研究过程详述
作者通过细胞实验提供了以下关键数据:
- 表达水平:NME6在多种癌细胞系(如MDA-MB-231T、HeLa)中高表达(Western blot检测到清晰条带);
- 功能关联:过表达NME6导致OXPHOS呼吸下降(谷氨酸/苹果酸底物下,KI-186-18的OCR比对照低30%,P<0.01)、复合物III丰度降低40%(P<0.01);
- 机制关联:NME6与RCC1L(线粒体核糖体组装蛋白)稳定相互作用,而RCC1L是OXPHOS必需基因(genome-wide筛选证实),提示NME6通过调控线粒体翻译影响OXPHOS。
4.3 核心成果提炼
- 功能关联:NME6是线粒体功能的负调控因子,其表达水平与OXPHOS效率负相关;
- 创新性:首次发现NME6作为无磷酸转移活性的NME成员,通过与RCC1L相互作用参与线粒体翻译调控;
- 潜在价值:NME6可能作为线粒体功能障碍(如复合物III缺陷)的生物标志物,尤其在肿瘤细胞中(肿瘤常依赖Warburg效应,OXPHOS下降)。需后续临床研究验证其与癌症、线粒体病的关联。
本文通过系统解析NME6的结构-功能关系,揭示了Group II NME蛋白的非经典功能,为线粒体定位NME成员的研究提供了新方向。未来研究需聚焦NME6-RCC1L复合物调控线粒体翻译的分子机制,及NME6作为疾病Biomarker的临床价值。
