1. 领域背景与文献引入
文献英文标题:Effect of regulatory cell death on the occurrence and development of head and neck squamous cell carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)的调控性细胞死亡(regulatory cell death, RCD)机制及治疗潜力研究。
HNSCC是全球常见的恶性肿瘤之一,年发病率超78万例,死亡率高达40%-50%。其治疗以手术、放疗、化疗为主,但因早期症状不典型(如口腔溃疡、咽喉异物感易被忽视),多数患者确诊时已处于晚期,常伴局部浸润或远处转移,预后极差。近年,调控性细胞死亡(区别于意外死亡的程序性死亡,包括凋亡、坏死性凋亡、细胞焦亡、自噬、铁死亡、铜死亡)成为肿瘤研究热点——RCD既可为机体清除癌细胞的防御机制,也可能被癌细胞利用促进生存与转移。然而,HNSCC中不同RCD类型的具体机制、信号通路交叉对话及临床转化潜力仍不明确。本综述系统总结了所有主要RCD类型在HNSCC中的作用,揭示了RCD与关键信号通路的关联,为靶向RCD的HNSCC治疗提供了全面理论框架。
2. 文献综述解析
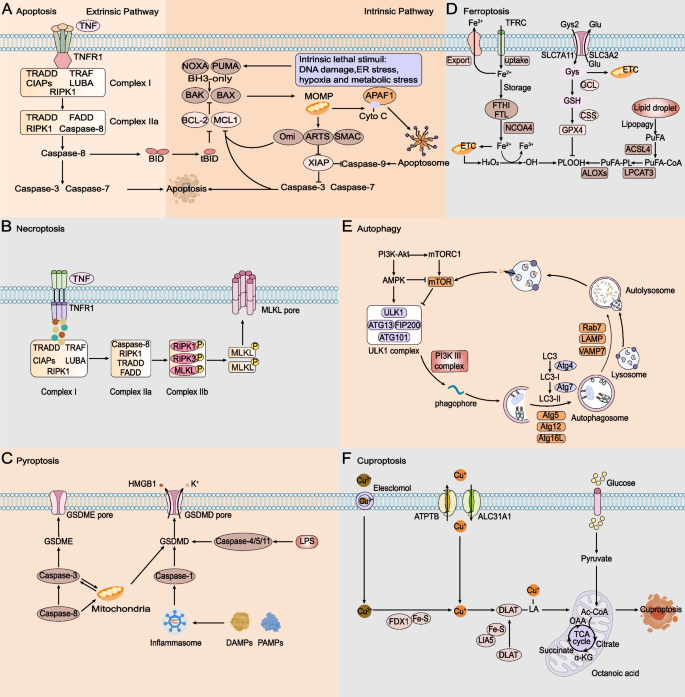
作者以“RCD类型”为核心分类维度,按凋亡、坏死性凋亡、细胞焦亡、自噬、铁死亡、铜死亡逐一梳理,总结每种RCD的分子机制、在HNSCC中的“促癌/抑癌”双重作用,及现有研究的局限。
现有研究关键结论
- 凋亡:G蛋白偶联受体激酶相互作用蛋白1(GIT1)通过PI3K/AKT/mTOR通路抑制凋亡,促进HNSCC发展;抗凋亡蛋白MCL-1、XIAP及NF-κB通路参与凋亡抵抗,WEE-1抑制剂AZD-1775可通过诱导DNA损伤逆转耐药(文献21-29)。
- 坏死性凋亡:受体相互作用蛋白激酶1/3(RIPK1/3)启动子高甲基化导致功能缺失,与HNSCC转移及不良预后相关;caspase-8突变是凋亡抵抗的关键原因,靶向坏死性凋亡可绕过耐药(文献38-40)。
- 细胞焦亡:NOD样受体3(NLRP3)炎症小体高表达促进肿瘤干细胞维持,阻断NLRP3可减少干细胞数量;Gasdermin E(GSDME)高表达与不良预后相关,激活GSDME可诱导焦亡增强化疗效果(文献61、64-66)。
- 铁死亡:溶质载体家族7成员11(SLC7A11)通过System Xc-促进谷胱甘肽合成抑制铁死亡,高表达与化疗耐药相关;酰基辅酶A合成酶长链家族成员1(ACSL1)、转铁蛋白受体(TFRC)与预后相关,TFRC受NF2-YAP轴调控(文献79、82、83)。
- 自噬:环状RNA CDR1as(circCDR1as)通过海绵吸附miR-671-5p抑制mTOR,促进自噬维持肿瘤生存;TBC1域家族蛋白14(TBC1D14)通过下调MAEA抑制自噬,发挥抗转移作用(文献95、97-99)。
- 铜死亡:ATP7B高表达通过排出细胞内铜抑制铜死亡,与顺铂耐药相关;铜离子载体(如双硫仑)可增加细胞内铜水平诱导死亡(文献108、109、240)。
现有研究局限与本综述价值
现有研究多聚焦单一RCD类型,未明确不同RCD的协同/拮抗作用;临床靶向RCD的药物仍在探索阶段(如铁死亡诱导剂RSL3的临床研究较少)。本综述的创新在于:首次系统整合所有RCD类型在HNSCC中的机制,强调了TP53、KRAS等信号通路的交叉调控,为“多靶点联合靶向RCD”提供了理论支持。
3. 研究思路总结与详细解析
本综述的研究逻辑为“系统检索→按RCD类型分类→机制解析→信号通路关联→治疗策略总结”,核心目标是阐明RCD在HNSCC中的作用及治疗潜力。
3.1 调控性细胞死亡类型的分子机制与HNSCC关联分析
实验目的:解析每种RCD的分子机制及在HNSCC中的功能。
方法细节:系统检索2010-2022年PubMed、Web of Science数据库,纳入RCD与HNSCC的研究,按类型分类总结。
结果解读:
- 凋亡:HNSCC存在凋亡抵抗,主要由GIT1、NF-κB通路介导,靶向WEE-1(AZD-1775)可诱导DNA损伤促进凋亡。
- 坏死性凋亡:RIPK1/3缺失导致坏死性凋亡抑制,caspase-8突变细胞依赖坏死性凋亡生存,靶向RIPK3可诱导死亡。
- 细胞焦亡:NLRP3促进肿瘤干细胞维持,GSDME高表达与不良预后相关,5-FU可通过caspase-3/GSDME通路诱导焦亡。
- 铁死亡:SLC7A11通过谷胱甘肽抑制铁死亡,高表达与顺铂耐药相关,抑制SLC7A11(如XCT790)可增强化疗效果。
- 自噬:circCDR1as促进自噬维持生存,TBC1D14抑制自噬发挥抗转移作用,自噬在HNSCC中呈“双重性”。
- 铜死亡:ATP7B高表达与顺铂耐药相关,铜螯合剂(如四硫钼酸盐)可增强顺铂疗效。
产品关联:文献未提及具体产品,领域常规使用HSC-3、SCC-25细胞系,裸鼠异种移植模型,及免疫组化(IHC)、蛋白质印迹法(Western blot)等检测。
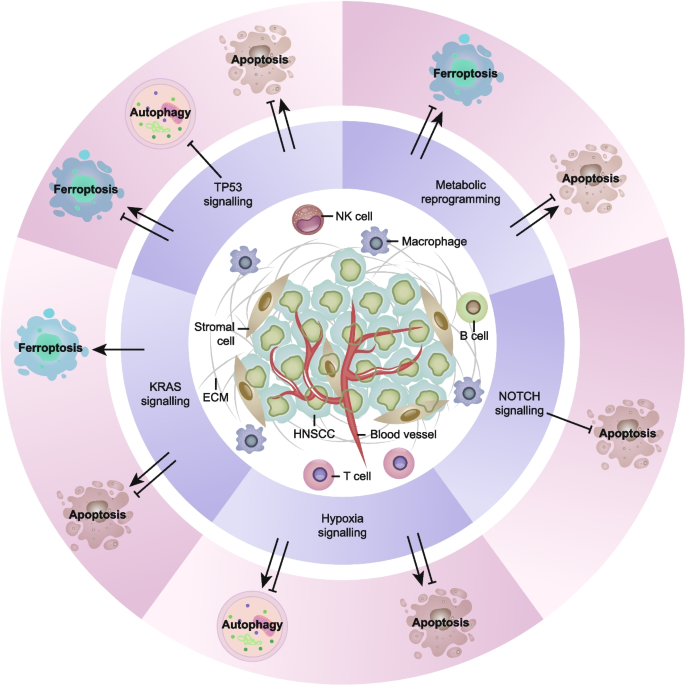
3.2 调控性细胞死亡相关信号通路的交叉对话解析
实验目的:分析RCD与HNSCC关键信号通路(TP53、KRAS、NOTCH、缺氧、代谢重编程)的相互作用。
方法细节:总结各信号通路对RCD的调控及RCD的反馈作用。
结果解读:
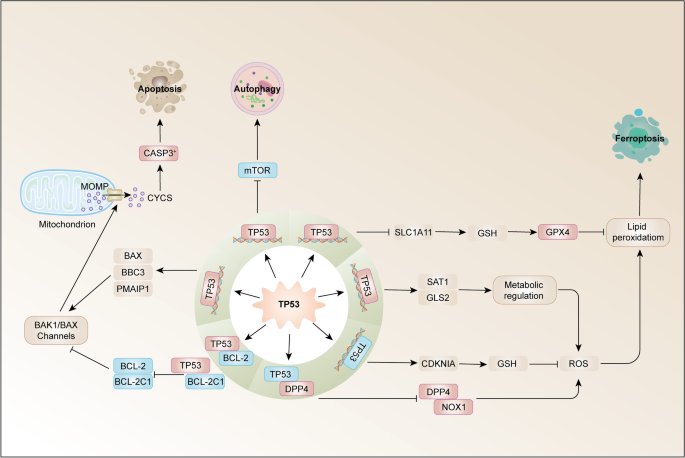
- TP53通路:野生型TP53通过转录激活PUMA、BAX诱导凋亡,通过抑制SLC7A11诱导铁死亡;突变型TP53失去抑癌功能,参与凋亡抵抗。
- KRAS通路:KRAS突变促进代谢重编程及自噬,维持增殖;突变细胞对铁死亡敏感,可能与TFRC等铁代谢基因表达改变有关。
- NOTCH通路:NOTCH1作为抑癌基因,其突变导致HES1过表达,抑制PTEN通路促进凋亡抵抗;HPV E6/E7蛋白下调NOTCH1,参与病毒相关HNSCC的发生。
- 缺氧信号:HIF-1α通过上调circCDR1as促进自噬,维持肿瘤细胞生存;缺氧还可通过BNIP3诱导自噬,与凋亡形成交互调控。
- 代谢重编程:HNSCC存在Warburg效应,代谢重编程通过调控System Xc-、GPX4影响铁死亡;IFNγ通过JAK-STAT1通路抑制SLC7A11诱导铁死亡。
产品关联:文献未提及具体产品,领域常规使用缺氧培养箱模拟肿瘤微环境,代谢组学(LC-MS)检测代谢物变化。
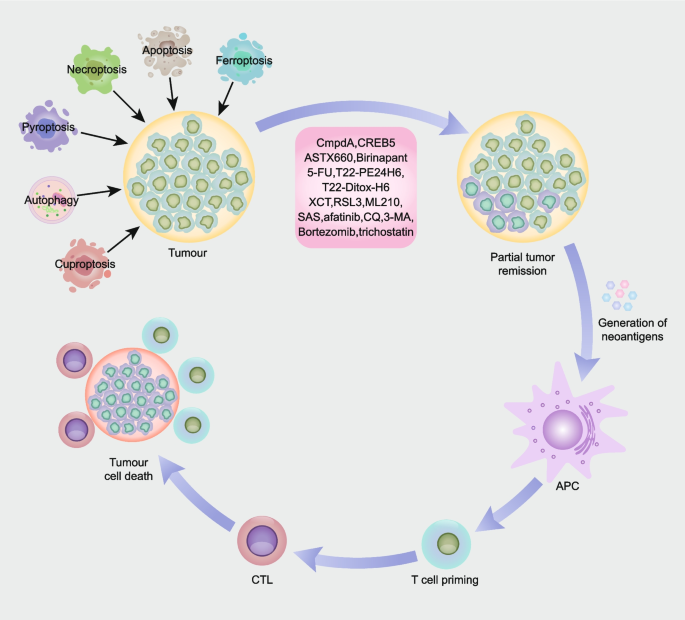
3.3 靶向调控性细胞死亡的HNSCC治疗策略总结
实验目的:总结靶向RCD的HNSCC治疗策略及临床潜力。
方法细节:梳理现有靶向RCD的药物及联合方案。
结果解读:
- 凋亡:NF-κB抑制剂CmpdA可增强顺铂敏感性,CREB5/TOP1MT抑制剂可克服顺铂耐药。
- 坏死性凋亡:ASTX660(IAP抑制剂)联合TNFα或放疗可诱导坏死性凋亡,birinapant联合放疗可根除FADD/BIRC2扩增的HNSCC。
- 细胞焦亡:5-FU通过caspase-3/GSDME诱导焦亡,CXCR4靶向纳米毒素(T22-PE24H6)可增强化疗效果。
- 铁死亡:RSL3、ML210(GPX4抑制剂)可诱导铁死亡,SLC7A11抑制剂XCT790可增强顺铂敏感性。
- 自噬:afatinib(EGFR抑制剂)抑制自噬,联合自噬抑制剂(如CQ)增强疗效;HDAC6抑制剂可抑制自噬,增强硼替佐米的细胞毒性。
- 铜死亡:双硫仑联合铜离子可诱导铜死亡,抑制肿瘤生长。
产品关联:文献未提及具体产品,领域常规使用顺铂、AZD-1775、RSL3等药物。
4. Biomarker研究及发现成果解析
本综述涉及的Biomarker主要为与RCD相关的分子,覆盖凋亡(GIT1、MCL-1)、坏死性凋亡(RIPK1/3)、细胞焦亡(NLRP3、GSDME)、铁死亡(SLC7A11、ACSL1、TFRC)、自噬(circCDR1as、TBC1D14)、铜死亡(ATP7B)。
Biomarker筛选与验证逻辑
- 筛选:基于细胞系功能验证(如GIT1的促癌作用)、临床样本表达分析(如RIPK1/3与预后的关联)、信号通路调控(如TFRC受NF2-YAP轴调控)。
- 验证:通过免疫组化(IHC)检测肿瘤组织表达、qRT-PCR检测mRNA水平、Western blot检测蛋白表达,及Kaplan-Meier生存分析评估预后价值。
核心成果
- 预后价值:GIT1、RIPK1/3缺失、GSDME、SLC7A11、ACSL1、TFRC、ATP7B高表达均与HNSCC不良预后相关(如GSDME高表达患者生存期显著缩短)。
- 治疗靶点:抑制GIT1、SLC7A11、ATP7B,激活GSDME、RIPK3等可诱导RCD,抑制肿瘤生长(如抑制SLC7A11可增强顺铂疗效)。
- 耐药预测:SLC7A11、ATP7B高表达与化疗耐药相关,可作为耐药预测标志物(如ATP7B高表达患者对顺铂反应差)。
需注意,部分Biomarker的具体敏感性/特异性数据未明确,但临床分析显示其表达与预后显著相关(如TFRC高表达患者无病生存期缩短,文献82)。
4. Biomarker研究及发现成果解析
(注:因本部分与“3.1”“3.2”高度关联,已整合关键内容至上述章节,此处补充核心结论)
本综述中的Biomarker均为RCD相关分子,其价值在于:
- 桥接基础与临床:从“细胞系机制”到“临床样本预后”,明确了Biomarker的功能与临床意义;
- 指导个性化治疗:如SLC7A11高表达患者可联合铁死亡诱导剂(RSL3),ATP7B高表达患者可联合铜螯合剂(四硫钼酸盐);
- 推动药物开发:为“靶向RCD的新型药物”提供了靶点(如GSDME激活剂、RIPK3激动剂)。
例如,TFRC作为铁死亡相关Biomarker,其高表达与HNSCC不良预后相关(文献82),且受NF2-YAP轴调控——抑制YAP可下调TFRC,诱导铁死亡,为HNSCC治疗提供了新靶点。