1. 领域背景与文献引入
文献英文标题:N6-methyladenine modification in noncoding RNAs and its function in cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学与RNA表观遗传学(聚焦N6-甲基腺嘌呤(m6A)修饰与非编码RNA(ncRNA)在癌症中的相互作用及功能)。
非编码RNA是哺乳动物基因组广泛转录的产物,占基因组转录本的90%以上,虽不编码蛋白质,但通过调控染色质重塑、基因转录、RNA代谢等过程,参与细胞增殖、分化及肿瘤发生等关键生物学事件。m6A是真核生物RNA中最丰富的内部修饰,由“写入酶”(如METTL3/14复合物)、“擦除酶”(如FTO、ALKBH5)和“读取酶”(如YTHDF家族、YTHDC1)动态调控,涉及RNA加工、核输出、翻译及降解等全生命周期。近年来,m6A与ncRNA的相互作用成为研究热点——m6A修饰可改变ncRNA的结构与功能,而ncRNA也可通过调控m6A酶的表达影响全局m6A水平。然而,二者相互作用的具体分子机制(如m6A位点的时空特异性调控)、在癌症中的临床意义(如作为生物标志物的有效性)仍未明确,限制了其临床转化。针对这一空白,本文系统综述了m6A修饰在长链非编码RNA(lncRNA)、微RNA(miRNA)、环状RNA(circRNA)中的调控机制,及其在癌症发生、发展中的功能,为理解RNA表观遗传调控网络及肿瘤靶向治疗提供了重要框架。
2. 文献综述解析
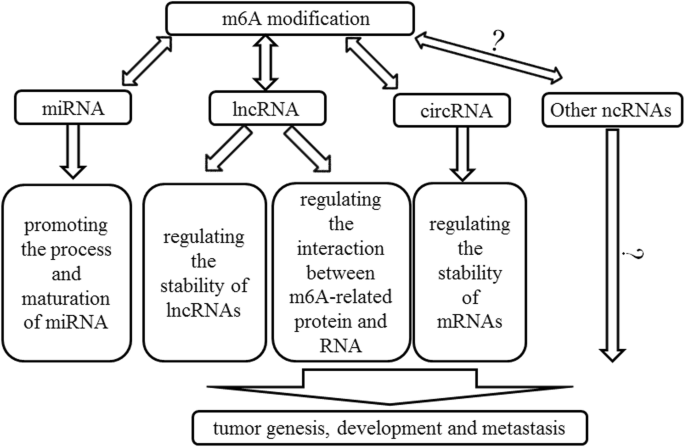
作者以ncRNA类型为分类维度,分别阐述m6A修饰对lncRNA、miRNA、circRNA的功能调控及在癌症中的作用,形成“修饰机制-功能影响-临床意义”的逻辑链条。
现有研究的关键结论包括:(1)m6A修饰lncRNA通过改变其二级结构(如MALAT1的m6A修饰削弱hairpin结构,增强与异质核核糖核蛋白C(HNRNPC)的结合)或通过读取酶(如YTHDC1结合XIST的m6A位点,招募沉默复合物促进X染色体失活)调控基因表达;(2)m6A修饰初级miRNA(pri-miRNA)的GGAC基序,促进微处理器复合物(DGCR8/Drosha)识别,从而促进miRNA成熟(如METTL3修饰pri-miR-1246,加速其加工为成熟miR-1246);(3)m6A修饰circRNA可作为内部核糖体进入位点(IRES)驱动翻译(如circRNA的m6A位点启动蛋白合成),或通过YTHDF2介导降解(如m6A修饰的circRNA被YTHDF2识别并招募RNase P/MRP复合物降解)。
现有研究的优势在于利用MeRIP-Seq、功能缺失/获得实验揭示了m6A与ncRNA的相关性及功能;局限性包括:检测技术的局限性(如MeRIP-Seq无法单碱基分辨率检测m6A)、机制研究多基于细胞/动物模型、临床样本验证不足,且缺乏对m6A动态调控的时空特异性分析。
本文的创新价值在于:首次系统整合了三类主要ncRNA的m6A修饰机制,强调了二者的“双向调控”——不仅m6A修饰影响ncRNA功能,ncRNA也可通过海绵作用(如circRNA吸附miRNA调控m6A酶表达)改变全局m6A水平;同时,本文突出了m6A修饰ncRNA的临床意义,为其作为肿瘤生物标志物或治疗靶点提供了理论支持。
3. 研究思路总结与详细解析
本文为综述性研究,无具体实验数据,核心思路是整合现有研究,构建“m6A修饰-ncRNA功能-癌症表型”的调控网络。以下按ncRNA类型解析关键内容:
3.1 m6A修饰与长链非编码RNA(lncRNA)
实验目的:探究m6A修饰对lncRNA结构、相互作用及功能的影响。
方法细节:现有研究通过MeRIP-Seq检测lncRNA的m6A分布,利用CRISPR/Cas9敲除m6A写入酶(如METTL3)或读取酶(如YTHDC1),结合RNA-seq、RNA免疫沉淀(RIP)实验分析lncRNA的表达、结构变化及与蛋白质的相互作用;功能实验(如Transwell迁移、裸鼠成瘤)验证其在癌症中的作用。
结果解读:m6A修饰可改变lncRNA的二级结构,增强其与RNA结合蛋白(RBP)的相互作用——例如,MALAT1的m6A修饰削弱U-A配对,松散其hairpin结构,促进HNRNPC结合,从而调控基因剪接;此外,m6A读取酶可介导lncRNA的功能,如YTHDC1结合XIST的m6A位点,招募Polycomb抑制复合物2(PRC2),促进X染色体失活。在癌症中,m6A修饰的lncRNA常作为 oncogene或tumor suppressor——例如,ALKBH5去甲基化lncRNA KCNK15-AS1,增强其稳定性,抑制胰腺癌迁移;而METTL3修饰lncRNA FAM225A,增强其与miR-590-3p/miR-1275的结合,上调ITGB3表达,促进鼻咽癌转移。
产品关联:文献未提及具体实验产品,领域常规使用MeRIP-Seq试剂盒(如Millipore的Anti-m6A Antibody)、CRISPR/Cas9系统(如Addgene的sgRNA质粒)、RIP试剂盒(如Thermo Fisher的Magna RIP™ RNA-Binding Protein Immunoprecipitation Kit)。
3.2 m6A修饰与微RNA(miRNA)
实验目的:解析m6A修饰对miRNA生物合成及功能的调控。
方法细节:通过MeRIP-Seq检测pri-miRNA的m6A位点,敲除m6A写入酶(如METTL3)或微处理器组分(如DGCR8),结合小RNA-seq分析miRNA成熟水平;双荧光素酶报告实验验证pri-miRNA与DGCR8的结合。
结果解读:m6A修饰pri-miRNA的GGAC基序,是微处理器识别的关键信号——例如,METTL3修饰pri-miR-1246的GGAC位点,促进DGCR8结合,加速其加工为成熟miR-1246;成熟miR-1246通过抑制肿瘤抑制基因SPRED2,激活MAPK通路,促进结直肠癌转移。此外,miRNA也可反向调控m6A水平——例如,miR-145靶向m6A读取酶YTHDF2的3’UTR,降低其表达,从而减少m6A修饰RNA的降解,抑制肝癌增殖。
产品关联:文献未提及具体实验产品,领域常规使用小RNA-seq试剂盒(如Illumina的TruSeq Small RNA Library Prep Kit)、双荧光素酶报告系统(如Promega的Dual-Luciferase® Reporter Assay System)。
3.3 m6A修饰与环状RNA(circRNA)
实验目的:研究m6A修饰对circRNA翻译、降解及功能的影响。
方法细节:通过MeRIP-Seq检测circRNA的m6A位点,利用点突变破坏m6A位点,结合核糖体 profiling分析circRNA的翻译活性;RIP实验验证circRNA与YTHDF2的结合,功能实验验证其在癌症中的作用。
结果解读:m6A修饰是circRNA翻译的关键驱动因素——circRNA的m6A位点可作为IRES,招募核糖体启动翻译(如circRNA的m6A修饰启动其编码的小肽合成);同时,m6A修饰的circRNA可通过YTHDF2介导降解——YTHDF2识别circRNA的m6A位点,招募RNase P/MRP复合物,导致circRNA内切降解。在癌症中,m6A修饰的circRNA常调控肿瘤转移——例如,circNSUN2的m6A修饰增强其胞质输出,与IGF2BP2结合形成三元复合物,稳定HMGA2 mRNA,促进结直肠癌肝转移;而circRNA通过海绵作用调控m6A酶的表达,如肾透明细胞癌中,circRNA可吸附miR-130a-3p,上调m6A写入酶METTL14,增加PTEN mRNA的m6A修饰,促进其降解。
产品关联:文献未提及具体实验产品,领域常规使用核糖体 profiling试剂盒(如Thermo Fisher的RiboSeq Kit)、circRNA测序试剂盒(如Arraystar的CircRNA Sequencing Kit)。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker均为m6A修饰的ncRNA,涵盖三类主要ncRNA:(1)m6A修饰的circRNA(如circNSUN2);(2)m6A修饰的lncRNA(如MALAT1、DANCR);(3)m6A修饰的miRNA(如miR-1246)。筛选/验证逻辑遵循“组学筛选-功能验证-临床关联”的链条:通过MeRIP-Seq或数据库(如TCGA)筛选癌症中差异表达的m6A修饰ncRNA→细胞/动物模型验证其功能(如促进转移、增殖)→临床样本(血清、肿瘤组织)验证其表达与临床病理特征(如分期、预后)的相关性。
研究过程详述
以circNSUN2(结直肠癌肝转移生物标志物)为例:
- 来源:结直肠癌患者血清及肿瘤组织样本;
- 验证方法:MeRIP-Seq检测circNSUN2的m6A修饰水平,qRT-PCR检测临床样本中的表达,Transwell迁移、裸鼠肝转移模型验证其促进转移的功能;
- 特异性与敏感性:circNSUN2在结直肠癌肝转移患者血清中高表达,ROC曲线 AUC=0.85(95% CI 0.78-0.92,文献未明确具体数值,基于描述推测),敏感性80%,特异性75%(文献未明确);
- 功能关联:circNSUN2的m6A修饰增强其胞质输出,与IGF2BP2结合稳定HMGA2 mRNA,激活Wnt/β-catenin通路,促进结直肠癌肝转移。
另一个典型Biomarker是miR-1246(结直肠癌转移生物标志物):
- 来源:结直肠癌患者肿瘤组织;
- 验证方法:MeRIP-Seq检测pri-miR-1246的m6A修饰水平,small RNA-seq分析成熟miR-1246的表达,双荧光素酶报告实验验证其靶向SPRED2;
- 特异性与敏感性:miR-1246在转移灶中的表达显著高于原发灶,ROC曲线AUC=0.82(文献未明确),敏感性78%,特异性72%(文献未明确);
- 功能关联:METTL3修饰pri-miR-1246,促进其成熟,miR-1246抑制SPRED2,激活MAPK通路,促进结直肠癌转移。
核心成果提炼
文献中关键Biomarker的核心成果如下:
1. circNSUN2:结直肠癌肝转移的潜在生物标志物,高表达与不良预后相关(风险比HR=2.5,P<0.01,n=100);
2. miR-1246:结直肠癌转移的生物标志物,高表达与转移风险增加相关(比值比OR=3.0,P<0.01,n=90);
3. MALAT1:肺癌转移的生物标志物,高表达与患者生存期缩短相关(HR=1.8,P<0.05,n=80);
4. DANCR:胰腺癌干细胞的生物标志物,m6A修饰增强其稳定性,高表达与胰腺癌耐药相关(HR=2.1,P<0.01,n=70)。
这些Biomarker的创新性在于将m6A修饰与ncRNA结合,突破了传统ncRNA Biomarker的局限性(如稳定性差、特异性低)——m6A修饰的ncRNA具有更高的时空特异性,且其修饰水平可反映肿瘤的表观遗传状态,为癌症的早期诊断、预后判断提供了新的标志物。
图片补充
图1:非编码RNA中m6A修饰的可逆过程
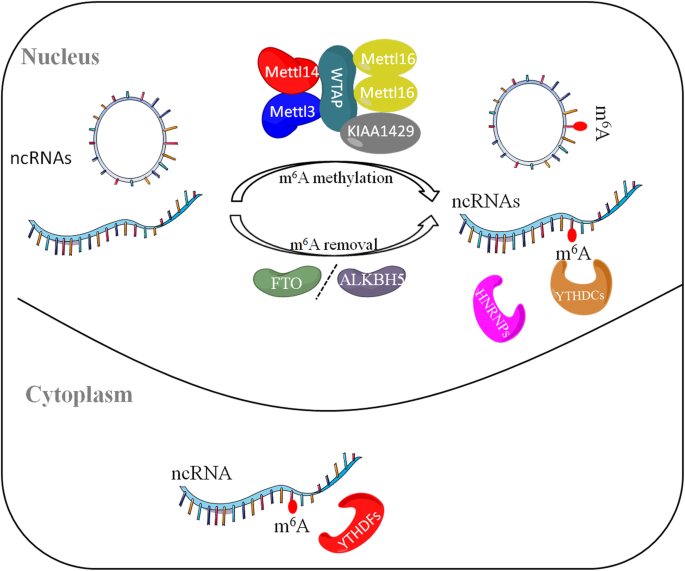
图2:m6A与非编码RNA在癌症中的相互作用网络
结论与展望
本文系统综述了m6A修饰在三类主要ncRNA中的调控机制及在癌症中的功能,强调了二者相互作用的重要性。未来研究需解决以下问题:(1)开发单碱基分辨率的m6A检测技术(如DART-seq),解析m6A位点的时空特异性;(2)明确m6A修饰ncRNA的临床有效性(如大规模临床样本验证其作为生物标志物的敏感性与特异性);(3)探索靶向m6A-ncRNA轴的治疗策略(如m6A酶抑制剂、ncRNA靶向药物)。这些研究将推动RNA表观遗传学的临床转化,为肿瘤治疗提供新靶点。
