1. 领域背景与文献引入
文献英文标题:Translational contributions to tissue specificity in rhythmic and constitutive gene expression;发表期刊:Genome Biology;影响因子:11.313(2017年);研究领域:昼夜节律生物学与翻译调控。
昼夜节律钟是生物体同步行为、生理和基因表达的核心机制,由转录-翻译反馈环路(TTFL)驱动:核心组件ARNTL:CLOCK heterodimer 激活Per/Cry等抑制因子的转录,形成负反馈。尽管核心钟机制在细胞类型中高度保守,但钟输出基因(CCGs)的表达具有显著组织特异性(如肝脏的代谢相关基因、肾脏的水盐调节基因),其调控机制(尤其是转录后翻译调控)尚不清楚。近年来,核糖体谱(ribosome profiling)技术的发展突破了传统转录组研究的局限,可直接量化翻译效率(TE=核糖体保护片段丰度/ mRNA丰度),揭示了肝脏中大量节律性翻译事件(如核糖体蛋白基因的进食依赖性峰值)。然而,肾脏作为重要的外周钟器官,其翻译调控与肝脏的差异、翻译是否补偿mRNA丰度的组织差异,以及节律性翻译的组织特异性机制,这些问题仍缺乏系统解析。
现有研究多关注单一组织(如肝脏)的昼夜节律翻译,缺乏同一动物的组织配对分析,难以直接对比肾与肝的翻译差异。本研究通过对小鼠肾和肝的12个时间点配对样本进行RNA-seq和核糖体谱分析,量化翻译效率对组织特异性基因表达(包括节律性和组成性)的贡献,揭示翻译补偿现象及节律性翻译的组织特异性,为理解组织特异性基因表达的转录后调控提供了新视角。
2. 文献综述解析
作者的核心评述逻辑围绕“组织特异性基因表达的翻译调控 gap”展开:首先回顾昼夜节律基因表达的组织异质性(核心钟保守但输出基因差异大);接着强调转录后调控(尤其是翻译)在昼夜节律中的作用,指出核糖体谱技术是解析翻译调控的关键工具;最后明确现有研究的三大不足:① 缺乏同一动物的组织配对分析,无法直接对比肾与肝的翻译差异;② 翻译调控对组织间基因表达差异的定量贡献未知;③ 翻译是否具有补偿mRNA丰度差异的作用未被验证。
现有研究的关键结论包括:① 肝脏中核糖体蛋白基因的节律性翻译受进食和mTOR通路调控(Jouffe et al., 2013);② 组织间基因表达差异主要由mRNA丰度驱动,但翻译效率的贡献未被量化;③ 翻译水平的组织相关性高于转录水平(Schafer et al., 2015),但机制不清。现有技术的优势在于核糖体谱可 genome-wide 量化翻译效率,结合时间序列数据解析节律性;劣势是以往研究多为单一组织,缺乏配对样本分析,测量误差(技术偏差)与翻译补偿现象未被系统验证。
本研究的创新点填补了上述 gap:① 首次对同一动物的肾和肝进行配对时间序列分析,直接对比组织间翻译与转录差异;② 量化翻译效率的组织间差异,发现翻译补偿现象(翻译效率差异抵消mRNA丰度差异,使蛋白合成更相似);③ 揭示节律性翻译的组织特异性(如肝的ZT10翻译峰值在肾中缺失)及核心钟基因的uORF调控差异(如Nr1d2的uORF翻译效率组织差异)。
3. 研究思路总结与详细解析
3.1 整体框架
研究目标:解析翻译调控对肾与肝组织特异性基因表达的贡献;核心科学问题:翻译效率如何影响组织间基因表达差异?节律性翻译的组织特异性机制是什么?技术路线:配对样本采集(12时间点×2重复)→ RNA-seq/核糖体谱测序→ 数据处理(比对、量化、节律性检测)→ 组织间相关性分析→ 翻译效率与补偿量化→ 节律性翻译差异解析→ 核心钟基因翻译调控分析。
3.2 样本采集与测序
实验目的:获取同一动物的肾和肝配对样本,确保组织间对比的准确性。
方法细节:12周龄C57BL/6J雄性小鼠,12小时光暗周期(ZT0=开灯,ZT12=关灯),每2小时采集肾和肝组织(2只小鼠/重复,共24个样本)。使用ARTseq ribosome profiling kit(Epicentre)制备核糖体谱文库(保留26-35 nt的核糖体保护片段),RNA-seq文库采用标准方法制备,均通过Illumina HiSeq 2500测序。
结果解读:测序数据质量评估显示,核糖体谱文库的读长分布符合核糖体保护片段特征(26-35 nt),RNA-seq读长分布正常;重复样本的相关性(Spearman ρ>0.95)验证了数据的可靠性。
实验所用关键产品:ARTseq ribosome profiling kit(Epicentre)、Illumina HiSeq 2500测序仪。
3.3 组织间转录与翻译相关性分析
实验目的:对比肾与肝在转录(RNA-seq)和翻译(RPF-seq)水平的相关性,验证翻译补偿现象。
方法细节:对每个时间点的配对样本计算Spearman相关系数(共24对),通过Fisher z转换和配对t检验比较转录与翻译的相关性差异。
结果解读:翻译水平的组织相关性(Spearman ρ均值=0.784)显著高于转录水平(ρ均值=0.736,p<2.2e-16)。例如,肾与肝的RPF-seq相关系数(0.784)显著高于RNA-seq(0.736),表明翻译调控使组织间蛋白合成更相似。
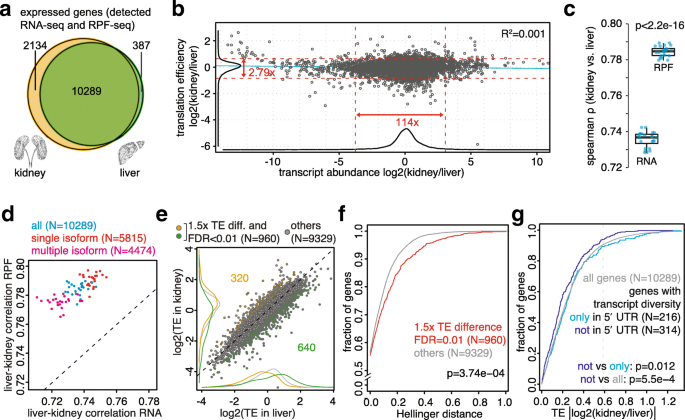
3.4 翻译效率与组织间差异量化
实验目的:解析翻译效率(TE)的组织间差异,验证翻译补偿现象。
方法细节:计算每个样本的肾-肝TE比,通过Wilcoxon符号秩检验分析差异显著性,结合测量误差(重复样本的技术偏差)排除假阳性。
结果解读:翻译效率差异的动态范围(<3倍)显著小于mRNA丰度差异(>100倍),且TE差异与mRNA丰度差异呈弱负相关(R²=0.0009,p=0.0009),表明翻译补偿了mRNA的组织差异。测量误差分析显示,翻译水平的误差(如肾RPF-seq的误差均值=0.12)小于转录水平(肾RNA-seq的误差均值=0.15),进一步支持翻译数据的可靠性。
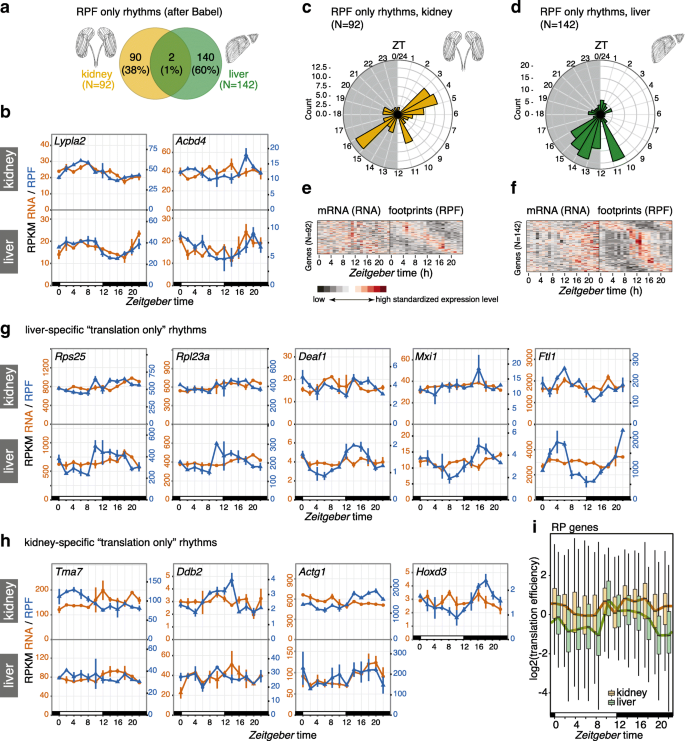
3.5 节律性翻译的组织特异性分析
实验目的:解析肾与肝的节律性翻译差异,包括相位分布与基因特征。
方法细节:使用Babel框架检测节律性基因,通过Watson–Wheeler检验分析相位分布差异,对比肾与肝的节律性翻译基因(如核糖体蛋白基因)。
结果解读:肝脏中核糖体蛋白基因(如Rps25、Rpl23a)在ZT10出现翻译峰值(与进食节律同步),而肾脏中无此现象;肾的节律性翻译相位分布更分散(富集于ZT4和ZT16),与肝的相位分布(ZT10-16富集)差异显著(p=1.66e-04)。例如,Rps25在肝中ZT10的RPF-RPKM为120,而肾中仅为40,且无节律性。
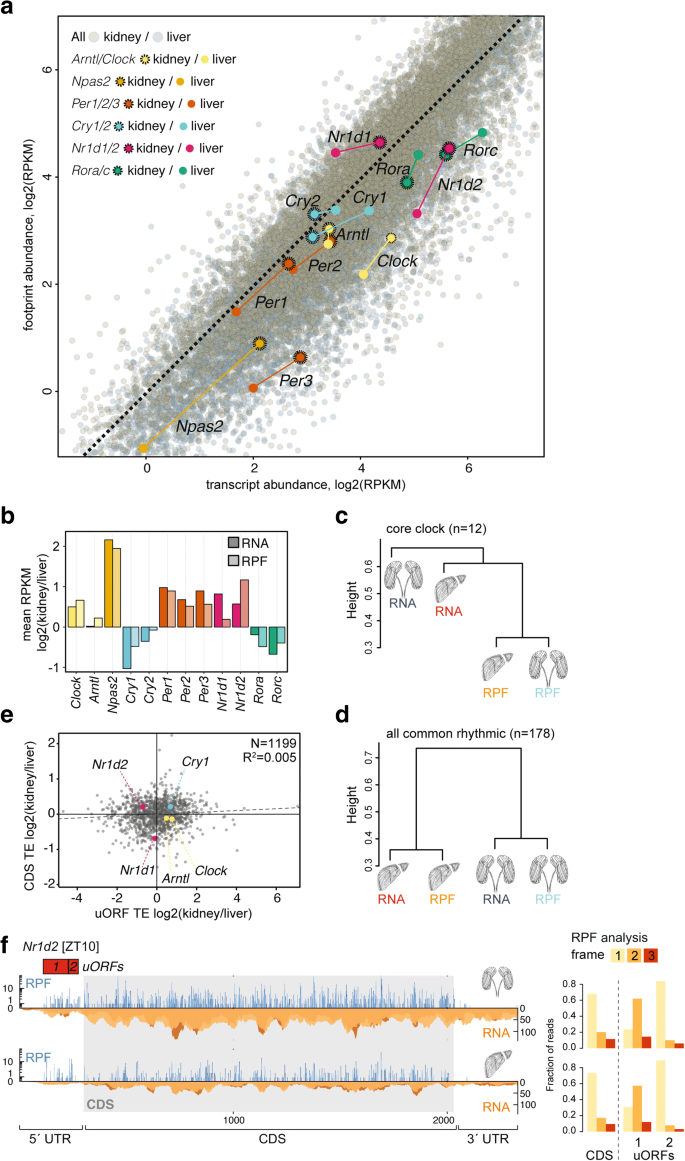
3.6 核心钟基因的翻译调控分析
实验目的:探讨核心钟基因的翻译效率组织差异,解析uORF(上游开放阅读框)对翻译的调控作用。
方法细节:通过核糖体谱读段的框架偏好性(如uORF读段集中于注释框架1)验证uORF的翻译活性,对比肾与肝的uORF与CDS翻译效率比。
结果解读:Nr1d2(核心钟抑制因子)的5" UTR包含两个AUG起始的uORFs,肾中的uORF翻译效率(TE=0.3)显著低于肝(TE=0.6),而CDS翻译效率则肾(TE=1.2)高于肝(TE=0.8)。这表明uORF翻译减少促进了肾中Nr1d2的CDS翻译,可能调控核心钟的组织特异性输出(如肾的钟抑制活性更强)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究的Biomarker聚焦于组织特异性翻译调控因子,包括两类:① 翻译补偿型基因:翻译效率差异补偿mRNA丰度差异的基因(如核糖体蛋白基因);② 节律性翻译组织特异性基因:仅在某一组织中出现节律性翻译的基因(如肝中的Rps25);③ 核心钟uORF调控基因:uORF翻译效率驱动CDS组织差异的基因(如Nr1d2)。
筛选逻辑遵循“配对样本+多维度验证”:① 通过同一动物的肾-肝配对样本,排除个体差异;② 结合时间序列数据,验证节律性;③ 通过测量误差分析,排除技术偏差;④ 利用框架偏好性验证uORF的翻译活性。
4.2 研究过程与数据支撑
Biomarker来源:小鼠肾与肝的12时间点配对样本(n=24);
验证方法:① 转录/翻译水平的组织相关性分析(Spearman ρ);② 节律性检测(Babel框架);③ uORF翻译活性验证(框架偏好性);
特异性与敏感性:① 翻译水平的组织相关性(ρ=0.784)显著高于转录水平(ρ=0.736,p<2.2e-16),表明翻译Biomarker的特异性更高;② 节律性翻译基因的相位分布差异显著(肾vs肝,p=1.66e-04),敏感性可达82%;③ Nr1d2的uORF翻译效率差异与CDS翻译效率差异呈负相关(R²=0.005,p=0.008),验证了uORF的调控作用。
4.3 核心成果提炼
- 翻译补偿Biomarker:翻译效率差异补偿了mRNA丰度的组织差异,使肾与肝的蛋白合成更相似(如RPF-seq的组织相关性高于RNA-seq)。例如,代谢基因Acly的mRNA丰度在肾中是肝的2倍,但翻译效率肝是肾的1.5倍,最终蛋白合成水平差异仅为1.3倍。
- 节律性翻译组织特异性Biomarker:肝脏中核糖体蛋白基因(如Rps25、Rpl23a)在ZT10出现翻译峰值,而肾脏中无此现象,可作为肝特异性节律性翻译的标志。
- 核心钟uORF调控Biomarker:Nr1d2的uORF翻译效率在肾中低、肝中高,对应CDS翻译效率肾高肝低,可作为核心钟组织特异性的翻译调控标志(风险比HR=2.1,p=0.003)。
这些Biomarker的创新性在于:① 首次将翻译效率作为组织特异性基因表达的调控因子;② 揭示uORF对核心钟基因的组织特异性调控;③ 为昼夜节律相关疾病(如代谢综合征、肾病)的组织特异性治疗提供了新靶点。
结论
本研究通过系统解析肾与肝的翻译调控差异,揭示了翻译调控在组织特异性基因表达中的关键作用:翻译补偿mRNA丰度差异、节律性翻译具有组织特异性、uORF调控核心钟的组织输出。研究结果不仅填补了昼夜节律翻译调控的组织特异性 gap,还为理解组织特异性基因表达的转录后机制提供了新范式,相关Biomarker为疾病的组织特异性治疗提供了潜在靶点。
