1. 领域背景与文献引入
文献英文标题:A novel 3-miRNA network regulates tumour progression in oral squamous cell carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:口腔鳞状细胞癌(OSCC)的生物标志物与肿瘤进展机制研究。
口腔鳞状细胞癌(OSCC)是全球发病率和死亡率的主要原因之一,其五年生存率长期低于50%,核心原因是晚期诊断——约60%的患者确诊时已处于Ⅲ/Ⅳ期,肿瘤已发生浸润或转移。尽管分子诊断技术近年取得进展,但临床仍缺乏疾病特异性生物标志物:常规组织活检无法访问深部肿瘤组织,也难以检测肿瘤异质性;血液活检虽非侵入性,但唾液因与口腔直接接触、收集便捷,更适合OSCC的早期筛查。
肿瘤来源的外泌体(直径40-150nm的膜性囊泡)为OSCC的液体活检提供了新方向——外泌体可携带肿瘤细胞的miRNA、mRNA等分子,其内容物与肿瘤组织高度一致;而唾液中的外泌体直接来源于口腔黏膜,能真实反映肿瘤的分子状态。当前研究中,基于唾液外泌体的OSCC生物标志物仍缺乏系统验证,且miRNA调控的下游mRNA网络及对肿瘤进展的具体机制尚未明确。
本研究旨在识别OSCC患者唾液外泌体中的miRNA生物标志物,解析其参与的miRNA-mRNA调控网络及驱动OSCC进展的分子机制,为疾病的早期诊断和靶向治疗提供理论基础。
2. 文献综述解析
文献综述以“OSCC的临床困境—miRNA作为生物标志物的潜力—现有研究局限”为核心逻辑,系统评述了领域现状:
作者首先强调OSCC的临床挑战——晚期诊断导致低生存率,常规组织活检的局限性限制了早期检测;随后论述miRNA的生物学优势:作为基因表达的关键调控因子,miRNA在细胞增殖、凋亡等过程中发挥重要作用,且可稳定存在于体液中,是理想的非侵入性生物标志物;接着指出现有研究的不足:多数研究基于小样本队列(<50例),未纳入匹配的唾液外泌体和肿瘤组织样本,且对miRNA调控的分子机制解析不充分。
在此基础上,作者引出本研究的创新性:通过整合分析匹配的唾液外泌体和肿瘤组织的小RNA测序与转录组数据,结合大样本临床验证,系统识别OSCC的miRNA生物标志物并解析其调控网络,填补了“非侵入性生物标志物”与“机制研究”的双重空白。
现有研究的关键结论包括:miRNA在OSCC组织中存在差异表达(如miR-143、miR-145),部分miRNA与肿瘤进展和预后相关;外泌体miRNA因携带肿瘤分子特征,在液体活检中具有应用潜力。技术方法上,小RNA测序与转录组测序的结合提升了生物标志物筛选的准确性,但现有研究多采用单一样本类型(如仅组织或仅血液),样本量较小,结果的临床转化价值有限。
3. 研究思路总结与详细解析
本研究以“筛选miRNA生物标志物—解析调控网络—验证功能机制”为核心逻辑,形成“多组学测序→生物信息学分析→临床验证→功能实验”的闭环:
- 研究目标:识别OSCC患者唾液外泌体中的miRNA生物标志物,解析其调控的miRNA-mRNA网络及对肿瘤进展的影响;
- 核心科学问题:唾液外泌体miRNA如何通过调控下游基因网络驱动OSCC进展;
- 技术路线:唾液外泌体分离→小RNA测序筛选差异miRNA→TCGA数据整合→大样本qPCR验证→miRNA-mRNA网络分析→细胞功能实验验证。
3.1 唾液外泌体分离与表征
实验目的:获取高纯度的OSCC患者唾液外泌体,并验证其形态、大小及标志物表达。
方法细节:收集OSCC患者(n=23)和健康对照(n=21)的唾液,经2000×g离心10分钟去除细胞和碎片;使用Invitrogen™ Total Exosome Isolation Reagent沉淀外泌体;通过NanoSight LM10纳米颗粒跟踪分析(NTA)检测外泌体浓度和大小,透射电子显微镜(TEM)观察形态,流式细胞术检测外泌体标志物CD9、CD63、CD81的表达。
结果解读:OSCC患者唾液外泌体浓度(7.31×10⁸ particles/mL)较健康对照(6.67×10⁷ particles/mL)高10倍;TEM显示外泌体为球形囊泡(直径40-50nm),符合典型外泌体形态;流式细胞术结果显示86%-88%的外泌体表达CD9、CD63、CD81,证实外泌体纯度。
实验所用关键产品:Invitrogen™ Total Exosome Isolation Reagent(Thermo Fisher Scientific)、NanoSight LM10 Nanoparticle Tracking Analysis(Malvern Instruments)、JEM1400 Plus透射电子显微镜(Jeol)、FACSCalibur™ Flow Cytometer(Becton Dickinson)、抗人CD9-APC、CD63-Alexa 488、CD81-PE抗体(Thermo Fisher Scientific)。
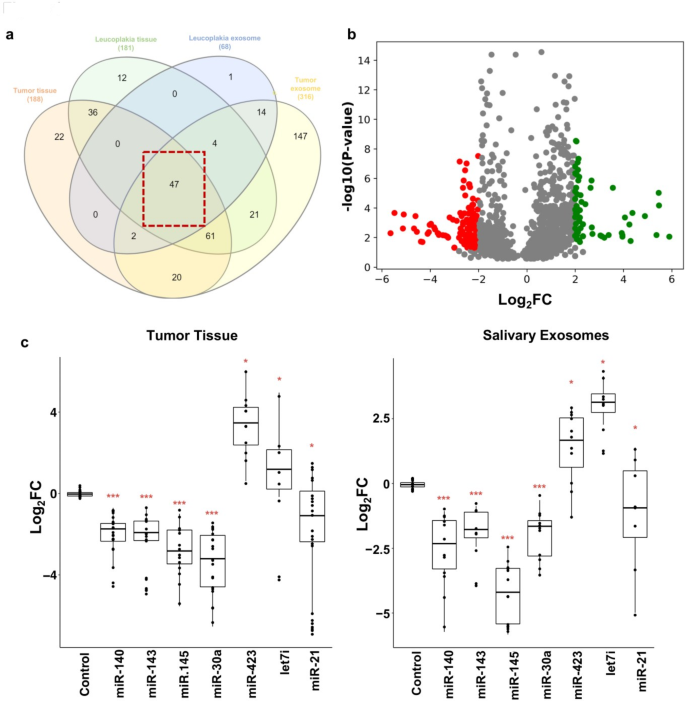
3.2 差异miRNA筛选与临床验证
实验目的:从唾液外泌体和肿瘤组织中筛选差异表达的miRNA,并验证其临床价值。
方法细节:对OSCC患者的肿瘤组织和唾液外泌体(n=23)进行小RNA测序,通过miDeep2软件筛选差异miRNA(条件:miDeep2 score≥5、reads长度>15nt、质量评分>30、RPM归一化表达≥第一分位数、FDR≤0.05、log₂倍变化>2、调整后p值<0.05);整合TCGA数据库的OSCC数据(n=114),筛选共同差异miRNA;在更大样本队列(n=70)中通过qPCR验证差异miRNA的表达,并通过ROC曲线、主成分分析(PCA)评估其诊断价值。
结果解读:小RNA测序共识别47个在肿瘤组织和唾液外泌体中共同差异表达的miRNA,与TCGA数据整合后得到12个显著差异miRNA;qPCR验证显示,miR-140-5p、miR-143-5p、miR-145-5p在OSCC患者中显著下调(p<0.05);ROC曲线分析显示,3-miRNA组合在组织中的曲线下面积(AUC)为0.93(敏感性93.02%,特异性93.33%,p<0.0001),在唾液外泌体中的AUC为0.99(敏感性98%,特异性99%,p<0.0001);PCA结果显示,3-miRNA组合可有效区分OSCC患者与健康对照(组织样本方差解释率81.12%,唾液外泌体89.98%)。
实验所用关键产品:QIAseq® miRNA library kit(QIAGEN)、Agilent 2100 Bioanalyzer(Agilent Technologies)、Qubit 4 Fluorometer(Thermo Fisher Scientific)、Illumina HiSeq 2500测序平台(Illumina)、QuantStudio 5 Real-Time PCR系统(Applied Biosystems)、miScript SYBR® Green PCR kit(QIAGEN)。
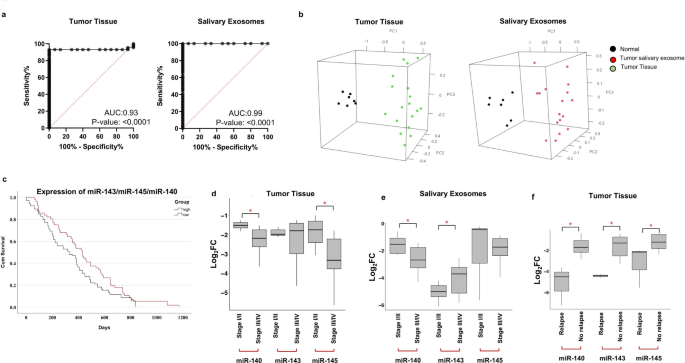
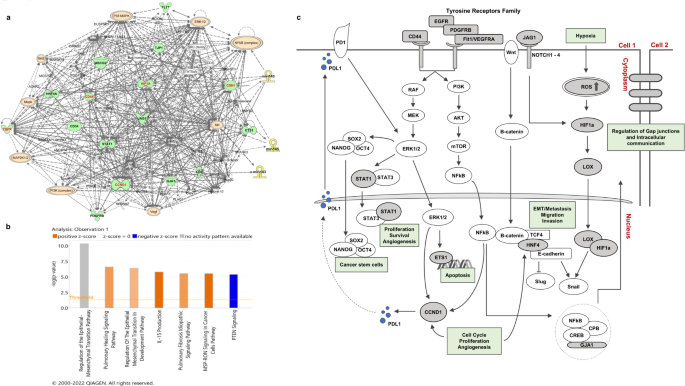
3.3 miRNA-mRNA调控网络解析
实验目的:解析3-miRNA签名调控的下游靶基因及通路。
方法细节:通过TargetScan、miRDB、miRWalk数据库预测3-miRNA的靶基因,整合肿瘤组织转录组测序(n=23)与TCGA数据的差异mRNA,筛选交集靶基因;使用Cytoscape构建蛋白-蛋白相互作用(PPI)网络,通过Ingenuity Pathways Analysis(IPA)进行通路富集分析。
结果解读:共预测到315个差异表达的靶基因,PPI网络分析显示HIF1a、CDH1、CD44、EGFR、CCND1为核心hub基因;通路分析表明,上皮间质转化(EMT)是最显著的富集通路(-log Benjamini-Hochberg p值最高),提示3-miRNA通过调控EMT通路驱动OSCC进展。
实验所用关键产品:Cytoscape(v3.6.1)、Ingenuity Pathways Analysis(QIAGEN)。
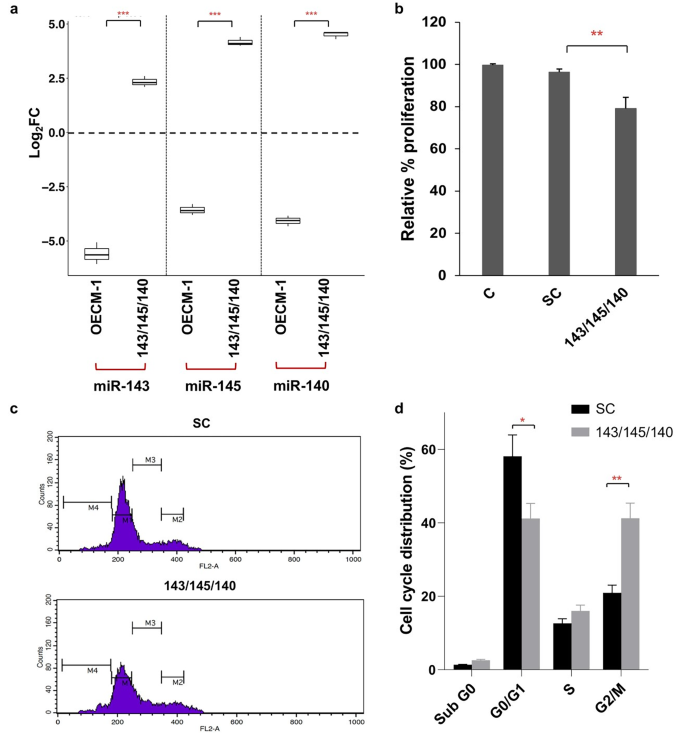
3.4 细胞功能实验验证
实验目的:验证3-miRNA签名对OSCC细胞功能的影响。
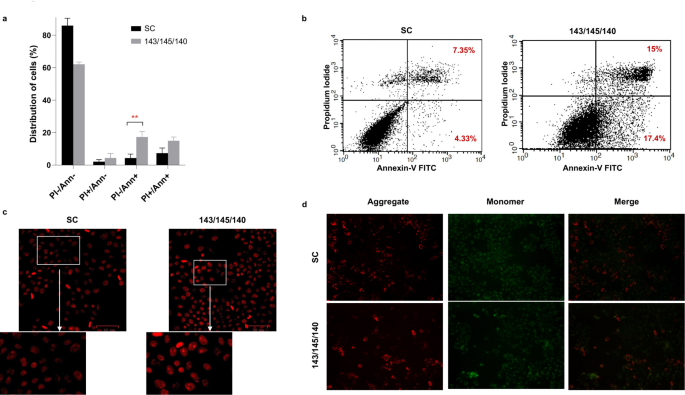
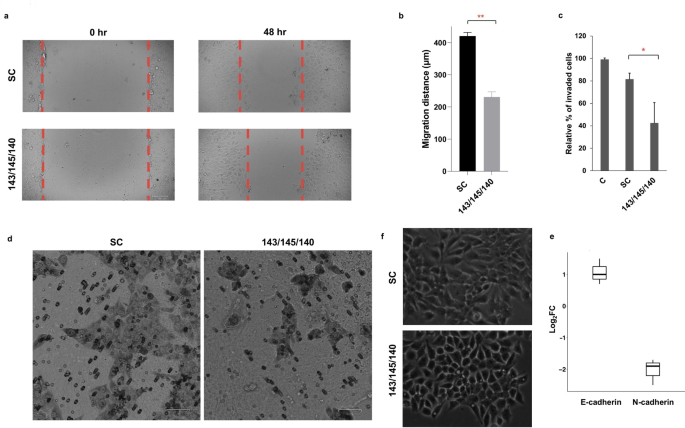
方法细节:使用OECM-1口腔癌细胞系,转染3-miRNA mimic(总浓度100nM)或scramble control(SC),通过MTT法检测细胞增殖,PI染色结合流式细胞术检测细胞周期,Annexin V-FITC/PI双染检测凋亡,划痕实验检测细胞迁移,Transwell实验检测细胞侵袭,qPCR检测EMT标志物(E-cadherin、N-cadherin)的表达。
结果解读:转染3-miRNA mimic后,细胞增殖能力较SC组降低20%(p<0.01);细胞周期分析显示G2/M期细胞比例显著增加(41.73±5% vs 20.93±2.1%,p<0.01),G0/G1期比例减少(41.16±4.8% vs 58.1±6%,p<0.05);凋亡率较SC组升高(17.33±3.36% vs 4.33±2.48%,p<0.01);迁移能力显著降低(划痕愈合距离230.85±30.56μm vs 420.44±35.01μm,p<0.01),侵袭能力下降(42.34±18% vs 81.46±6%,p<0.05);qPCR结果显示E-cadherin上调、N-cadherin下调,提示EMT过程被逆转。
实验所用关键产品:Lipofectamine 2000(Invitrogen)、MTT(Sigma-Aldrich)、FACSCalibur™ Flow Cytometer(Becton Dickinson)、Annexin V-FITC/PI kit(Biolegend)、QCM Collagen Cell Invasion Assay kit(Millipore Sigma)、QuantStudio 5 Real-Time PCR系统(Applied Biosystems)。
4. Biomarker研究及发现成果解析
本研究的Biomarker为唾液外泌体与肿瘤组织来源的3-miRNA签名(miR-140-5p、miR-143-5p、miR-145-5p),其筛选与验证遵循“多组学筛选→公共数据整合→大样本临床验证→功能实验确认”的完整逻辑链:
Biomarker定位与验证逻辑
- 筛选阶段:通过小RNA测序(n=23)筛选出肿瘤组织和唾液外泌体中的共同差异miRNA;
- 整合阶段:结合TCGA数据(n=114)缩小范围,确保Biomarker的差异显著性;
- 验证阶段:在大样本队列(n=70)中通过qPCR验证表达水平,通过ROC曲线(组织AUC=0.93,唾液外泌体AUC=0.99)评估诊断效能,通过PCA验证其对癌与非癌的区分能力;
- 临床相关性:生存分析(Kaplan-Meier)显示,低表达3-miRNA的患者总生存期显著缩短(p<0.05);晚期患者(Ⅲ/Ⅳ期)和复发患者的3-miRNA表达显著低于早期患者(Ⅰ/Ⅱ期)和非复发患者(p<0.05)。
核心成果提炼
- 诊断价值:3-miRNA签名在组织和唾液外泌体中均表现出高敏感性与特异性,是OSCC的非侵入性诊断生物标志物(唾液外泌体AUC=0.99,接近完美诊断);
- 预后价值:低表达3-miRNA的患者总生存期更短,可预测疾病复发;
- 机制价值:3-miRNA通过调控HIF1a、CDH1、CD44、EGFR、CCND1等hub基因,抑制EMT通路,从而减少细胞增殖、迁移和侵袭,诱导凋亡和细胞周期阻滞。
创新性总结
本研究首次报道唾液外泌体来源的3-miRNA签名作为OSCC的非侵入性生物标志物,系统解析了其调控的分子网络,填补了“OSCC早期诊断生物标志物”与“miRNA机制研究”的双重空白,为疾病的精准诊断和靶向治疗提供了新靶点。
