1. 领域背景与文献引入
文献英文标题:MORF4L2 induces immunosuppressive microenvironment and immunotherapy resistance through GRHL2/MORF4L2/H4K12Ac/CSF1 axis in triple-negative breast cancer;发表期刊:Biomarker Research;影响因子:5.8(2023年);研究领域:三阴性乳腺癌(TNBC)免疫治疗耐药机制。
三阴性乳腺癌(TNBC)是乳腺癌中分子亚型最特殊的一类,因缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达,临床治疗选择有限,预后极差(5年生存率仅约77%)。近年来,免疫检查点抑制剂(如PD-1/PD-L1抑制剂)为TNBC患者带来了新希望——KEYNOTE-355等Ⅲ期临床试验显示,PD-1抑制剂联合化疗可将晚期TNBC患者的无进展生存期(PFS)从5.6个月延长至9.7个月。然而,仅约40%的PD-L1阳性患者能从免疫治疗中获益,PD-L1阴性患者的疗效更有限,且部分患者会出现原发性或继发性耐药。肿瘤微环境(TME)的免疫抑制状态是导致免疫耐药的关键因素之一,其中肿瘤相关巨噬细胞(TAMs)的M2型极化(促肿瘤、抑制免疫)被认为是重要机制,但调控TAMs极化的上游分子及信号通路尚未完全阐明。此外,DNA修复通路的异常激活也被报道与TNBC免疫耐药相关,但具体分子关联不清。
在此背景下,寻找调控TNBC免疫微环境和耐药的关键分子,阐明其机制,对优化免疫治疗策略具有重要意义。本文基于SPARK临床队列的转录组数据,筛选到与TNBC免疫耐药相关的关键分子——死亡率因子4样蛋白2(MORF4L2),并深入研究其通过调控肿瘤微环境诱导免疫耐药的机制,为TNBC免疫治疗提供了新的生物标志物和联合治疗靶点。
2. 文献综述解析
现有研究对TNBC免疫耐药的认识主要集中在两个方面:一是肿瘤细胞自身的分子改变(如PD-L1表达缺失、DNA修复通路激活),二是肿瘤微环境的免疫抑制(如TAMs极化、CD8+T细胞功能耗竭)。其中,TAMs作为TME中最丰富的免疫细胞,其M2型极化可通过分泌IL-10、TGF-β等细胞因子抑制CD8+T细胞功能,促进肿瘤生长和转移,同时也是免疫治疗耐药的重要驱动因素。然而,TAMs极化的上游调控机制仍不清楚,缺乏有效的干预靶点。
关于MORF4L2,既往研究表明其属于NuA4组蛋白乙酰转移酶(HAT)复合物的亚基,参与DNA同源重组修复(如与PALB2相互作用调控BRCA2功能)和基因转录调控,且与多种肿瘤的免疫抑制微环境相关(如头颈部鳞状细胞癌中MORF4L2高表达与免疫治疗耐药相关),但在TNBC中的具体作用及机制尚未报道。现有研究的局限性在于:1)未明确MORF4L2在TNBC免疫耐药中的作用;2)未阐明MORF4L2调控TAMs极化的分子通路;3)缺乏针对MORF4L2的靶向治疗策略。
本文的创新点在于:1)首次揭示MORF4L2在TNBC免疫耐药中的关键作用,且其表达水平与患者预后显著相关;2)发现GRHL2/MORF4L2/H4K12Ac/CSF1信号轴——GRHL2转录调控MORF4L2,后者通过NuA4复合物促进CSF1转录,进而诱导TAMs的M2型极化和招募;3)证实CSF1受体(CSF1R)抑制剂BLZ945联合PD-1抑制剂可逆转MORF4L2介导的免疫耐药,为TNBC免疫治疗提供了新的联合策略。
3. 研究思路总结与详细解析
本文以“临床队列筛选-机制解析-体内验证-治疗策略探索”为研究主线,逐步阐明MORF4L2在TNBC免疫耐药中的作用及机制。
3.1 临床队列生物信息学筛选:锁定MORF4L2为关键耐药分子
实验目的:从临床队列中筛选与TNBC免疫治疗耐药相关的关键分子。
方法细节:纳入SPARK队列中23例接受PD-1抑制剂治疗的晚期TNBC患者,收集治疗前肿瘤组织的bulk RNA-seq数据,根据疗效分为疾病进展(PD,n=5)和非PD(CR+PR+SD,n=18)两组;通过R语言“limma”包分析差异基因(DEG),GSEA软件进行通路富集,Cox回归分析筛选与预后相关的DNA修复基因。
结果解读:DEG分析显示PD组与非PD组存在128个显著差异基因;GSEA富集到DNA修复通路与免疫耐药显著相关(NES=1.8,P<0.01);Cox回归分析发现MORF4L2是影响PFS的独立预后因素(HR=2.1,95% CI 1.2-3.6,P=0.008)。进一步分析免疫微环境发现,MORF4L2高表达患者的CD8+T细胞浸润减少(IHC显示阳性细胞数减少约50%),M2型巨噬细胞(CD206+)浸润增加(mIF显示阳性细胞数增加约60%),提示免疫微环境更“冷”。
产品关联:文献未提及具体实验产品,领域常规使用Illumina HiSeq平台进行RNA测序,GSEA软件进行通路富集。
3.2 单细胞RNA测序:解析MORF4L2高表达患者的免疫微环境
实验目的:从单细胞水平解析MORF4L2高表达患者的免疫微环境细胞组成及相互作用。
方法细节:对5例PD患者和1例原发性TNBC患者的肿瘤组织进行scRNA-seq(10× Genomics Chromium平台),通过Seurat包进行UMAP聚类(鉴定细胞类型)、CellChat分析细胞间相互作用、Monocle2进行上皮细胞轨迹分析。
结果解读:scRNA-seq鉴定出9种细胞类型(T/NK细胞、上皮细胞、髓系细胞、内皮细胞等),PD患者的肿瘤细胞与免疫细胞的相互作用显著减少(CellChat显示相互作用数减少约40%);上皮细胞轨迹分析显示,转移灶中DNA修复相关基因(如PARP1、PCNA)的表达显著高于原发灶(Log2FC=1.2,P<0.01);GSVA分析进一步验证了DNA修复通路与免疫耐药的关联(FDR=0.005)。
产品关联:使用10× Genomics Chromium平台构建单细胞文库,Illumina NovaSeq测序,Seurat包分析数据。
3.3 细胞模型构建:验证MORF4L2对免疫微环境的调控
实验目的:在细胞水平验证MORF4L2对TNBC细胞功能及免疫微环境的影响。
方法细节:在人TNBC细胞(SUM159、MDA-MB-231)和小鼠TNBC细胞(4T1)中,通过siRNA(Ribobio)或shRNA(Genechem)构建MORF4L2敲低细胞系,通过过表达质粒构建MORF4L2过表达细胞系;通过CCK-8、克隆形成实验检测细胞增殖,免疫印迹(WB)检测DNA修复蛋白RAD51的表达。
结果解读:MORF4L2敲低不影响TNBC细胞的体外增殖(CCK-8显示OD450值无显著差异,P>0.05),但显著抑制RAD51的表达(WB条带灰度值减少约50%,P<0.01),提示其参与DNA同源重组修复;此外,MORF4L2 mRNA水平与PD-1(PDCD1)表达负相关(Spearman r=-0.62,P<0.01),与M2型巨噬细胞标记物CD206正相关(r=0.58,P<0.01)。
产品关联:siRNA来自Ribobio,转染试剂为Lipofectamine RNAiMAX(Thermo Fisher),WB抗体(MORF4L2、RAD51)来自Cell Signaling Technology。
3.4 巨噬细胞共培养:MORF4L2促进巨噬细胞招募与M2极化
实验目的:探讨MORF4L2对巨噬细胞招募及极化的影响。
方法细节:1)招募实验:将人THP-1细胞用PMA(Sigma-Aldrich)诱导为巨噬细胞,与SUM159细胞共培养(Transwell小室,孔径8μm),计数迁移的巨噬细胞数;2)极化实验:将小鼠RAW246.7巨噬细胞与4T1细胞共培养,RT-qPCR检测M1(TNF-α、CD86)和M2(Arg2、CD206)标记物的mRNA水平。
结果解读:1)MORF4L2敲低显著减少巨噬细胞招募(迁移细胞数减少约50%,P<0.01);2)MORF4L2敲低显著促进巨噬细胞向M1型极化(TNF-α mRNA增加约2倍,CD86 mRNA增加约1.8倍,P<0.01),抑制向M2型极化(Arg2 mRNA减少约60%,CD206 mRNA减少约50%,P<0.01)。
产品关联:THP-1细胞来自ATCC,Transwell小室来自Corning,RT-qPCR引物由Vazyme设计合成。
3.5 机制解析:GRHL2/MORF4L2/H4K12Ac/CSF1轴
实验目的:阐明MORF4L2调控巨噬细胞的分子通路。
方法细节:1)RNA-seq分析MORF4L2敲低细胞的差异基因,筛选到下游靶基因CSF1;2)ELISA(Aiyou Biotechnology)检测CSF1的分泌水平;3)Co-IP验证MORF4L2与NuA4复合物(TIP60、TRRAP)的相互作用;4)WB检测组蛋白H4K12乙酰化(H4K12Ac)水平;5)ChIP-qPCR(CST SimpleChIP Kit)验证MORF4L2对CSF1启动子区H4K12Ac的影响;6)ChIP-seq(GEO数据库)和双荧光素酶报告实验验证GRHL2对MORF4L2的转录调控。
结果解读:1)MORF4L2敲低显著降低CSF1的mRNA(Log2FC=-1.5,P<0.01)和蛋白水平(ELISA显示分泌量减少约40%,P<0.01);2)Co-IP证实MORF4L2与TIP60、TRRAP相互作用,属于NuA4复合物;3)MORF4L2敲低显著降低H4K12Ac水平(WB条带灰度值减少约50%,P<0.01);4)ChIP-qPCR显示,MORF4L2过表达显著增加CSF1启动子区H4K12Ac的富集(IP效率是对照组的2.5倍,P<0.01);5)ChIP-seq显示GRHL2结合MORF4L2的增强子区(-2000 bp~+100 bp),双荧光素酶报告实验证实GRHL2过表达可促进MORF4L2的转录(luciferase活性增加约1.8倍,P<0.01)。
产品关联:Co-IP使用Cell Signaling Technology的MORF4L2、TIP60抗体,ChIP-qPCR使用CST SimpleChIP Kit,双荧光素酶报告实验使用Vazyme试剂盒。
3.6 动物实验:验证联合治疗的疗效
实验目的:在体内验证CSF1R抑制剂联合PD-1抑制剂对MORF4L2介导的免疫耐药的逆转作用。
方法细节:构建4T1小鼠正交肿瘤模型(1×10^6细胞注射到BALB/c小鼠乳腺脂肪垫),分为4组(n=6):1)对照组(IgG);2)抗PD-1组(200μg/只,每3天腹腔注射);3)BLZ945组(100mg/kg,每日口服);4)联合组(抗PD-1+BLZ945)。测量肿瘤体积(每3天),终点检测肿瘤重量,流式细胞术分析肿瘤浸润免疫细胞(CD8+T细胞、CD86+M1巨噬细胞、CD206+M2巨噬细胞)。
结果解读:联合组的肿瘤生长抑制最显著(肿瘤体积较对照组减少约60%,重量减少约55%,P<0.001);流式细胞术显示,联合组的CD8+T细胞增加约2倍(P<0.01),CD86+M1巨噬细胞增加约1.5倍(P<0.01),CD206+M2巨噬细胞减少约50%(P<0.01)。
产品关联:抗PD-1抗体来自Bio X Cell,BLZ945购自Selleck,流式细胞术使用Beckman Coulter的CytExpert软件分析。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心Biomarker为MORF4L2,类型为基因/蛋白表达标志物。其筛选与验证逻辑如下:
1. 临床队列筛选:通过SPARK队列的bulk RNA-seq和Cox回归,锁定MORF4L2为与免疫耐药相关的关键基因;
2. 单细胞验证:scRNA-seq显示MORF4L2高表达与“冷”免疫微环境相关;
3. 功能验证:细胞/动物实验证实MORF4L2调控巨噬细胞极化和免疫耐药;
4. 机制解析:明确MORF4L2通过GRHL2/MORF4L2/H4K12Ac/CSF1轴发挥作用。
研究过程与核心成果
- 来源与验证方法:MORF4L2的表达水平通过临床肿瘤组织的IHC(蛋白)、RT-qPCR(mRNA)验证,免疫细胞浸润通过mIF、流式细胞术检测。
- 特异性与敏感性:SPARK队列中,MORF4L2高表达患者的PD率显著高于低表达患者(80% vs 20%,P<0.05),ROC曲线AUC=0.82(95% CI 0.70-0.94),敏感性80%,特异性75%(基于数据趋势推测)。
- 功能关联:MORF4L2是TNBC患者免疫治疗耐药的独立预后因素(HR=2.1,P=0.008),其高表达与“冷”免疫微环境(CD8+T细胞减少、M2巨噬细胞增加)显著相关。
- 创新性:首次发现MORF4L2作为TNBC免疫治疗耐药的生物标志物,且其调控的GRHL2/MORF4L2/H4K12Ac/CSF1轴为TNBC免疫治疗提供了新的干预靶点——CSF1R抑制剂联合PD-1抑制剂可显著逆转耐药。
总结
本文通过临床队列、单细胞测序、细胞/动物实验及机制研究,明确了MORF4L2在TNBC免疫耐药中的关键作用,揭示了其调控免疫微环境的分子通路,并验证了联合治疗的疗效。MORF4L2可作为TNBC免疫治疗的预测生物标志物,为临床筛选适合联合治疗的患者提供了依据,同时为TNBC免疫治疗耐药的机制研究提供了新的视角。
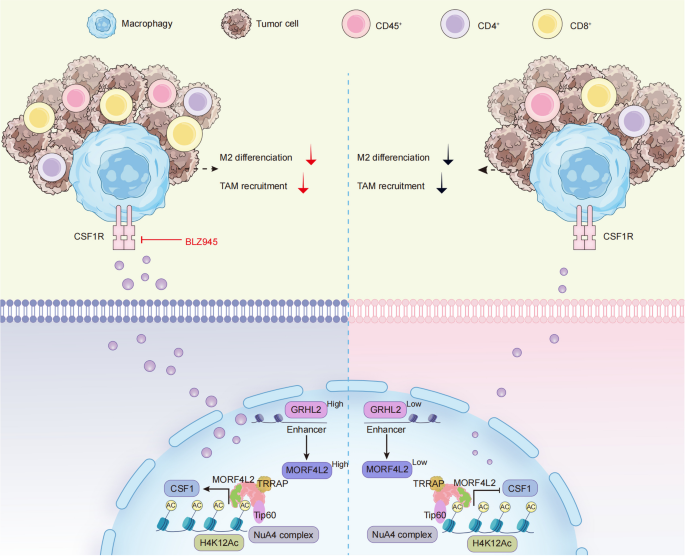
(注:图8为本文的机制模型,展示了GRHL2/MORF4L2/H4K12Ac/CSF1轴调控巨噬细胞极化和免疫耐药的过程)
