1. 领域背景与文献引入
文献英文标题:Detection of Epstein-Barr virus (EBV) in human lymphoma tissue by a novel microbial detection array;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(淋巴瘤与病毒病原体关联研究)。
感染相关癌症是全球癌症负担的重要组成部分,约20%的癌症由感染因素引起,其中10-15%与病毒相关。Epstein-Barr病毒(EBV)作为人类疱疹病毒4型(HHV-4),是B细胞淋巴瘤的重要致病因素之一,尤其在免疫抑制人群(如器官移植患者、HIV感染者)中,EBV相关淋巴瘤的发病率显著升高。现有研究已证实,EBV可通过潜伏感染驱动B细胞增殖,参与淋巴瘤的发生发展,但传统病原体检测技术存在明显局限:高通量测序虽能全面分析微生物谱,但成本高、耗时久;PCR技术虽快速敏感,但无法同时检测多种病原体,难以满足临床“一站式”筛查需求。在此背景下,开发一种全面、敏感且成本可控的病原体检测技术,对淋巴瘤的病因学研究及临床诊断具有重要意义。本研究基于劳伦斯利弗莫尔微生物检测芯片(LLMDA),系统验证其在淋巴瘤组织(包括福尔马林固定石蜡包埋(FFPE)样本)中EBV检测的可靠性,为临床病原体相关淋巴瘤的筛查提供新方法。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“感染与癌症的关联→EBV与淋巴瘤的关系→现有检测技术的局限性”展开。现有研究结论显示:①感染因素(尤其是病毒)是癌症的重要诱因,EBV与免疫抑制患者的B细胞淋巴瘤(如移植后淋巴增殖性疾病,PTLD)密切相关;②EBV在淋巴瘤中的检测主要依赖EBER原位杂交(临床金标准),但该方法仅能检测EBV编码的小RNA,无法同时分析其他病原体;③现有检测技术中,测序技术虽全面但成本高,PCR技术虽敏感但通量低,均无法满足临床对“多病原体同时检测”的需求。
本研究的创新价值在于:针对现有技术的局限,采用LLMDA芯片(可检测所有已测序的病毒、细菌和质粒),首次系统验证其在淋巴瘤EBV检测中的准确性,且突破了样本类型限制(可检测FFPE样本),为临床大规模筛查病原体相关淋巴瘤提供了“全面、敏感、经济”的替代方案。
3. 研究思路总结与详细解析
本研究的核心目标是验证LLMDA芯片检测淋巴瘤组织中EBV的可靠性,核心科学问题为“LLMDA能否准确区分EBV阳性与阴性淋巴瘤样本(包括FFPE样本、不同淋巴瘤亚型及PTLD样本)”,技术路线遵循“样本收集→DNA提取→LLMDA检测→EBER验证”的闭环逻辑。
3.1 样本收集与伦理审批
实验目的:获取符合伦理要求的淋巴瘤及对照样本,为后续检测提供材料。
方法细节:收集2010-2014年UC Davis医学中心58例淋巴瘤患者样本(30例B细胞淋巴瘤、2例T细胞淋巴瘤、2例NK/T细胞淋巴瘤、4例浆细胞瘤、8例良性淋巴组织)及Loma Linda大学10例PTLD患者样本;所有样本经病理形态学、免疫表型及细胞遗传学分类;部分样本冰冻保存(用于DNA提取),其余FFPE固定(用于FFPE样本检测验证);研究经UC Davis IRB伦理委员会批准,患者签署知情同意书。
结果解读:成功收集符合要求的68例样本(58例淋巴瘤+10例PTLD),覆盖不同淋巴瘤亚型及样本类型(冰冻/FFPE),为后续实验提供了多样化的验证材料。
产品关联:文献未提及具体样本收集产品,领域常规使用液氮罐(冰冻样本保存)、福尔马林(FFPE固定)。
3.2 样本DNA提取
实验目的:从FFPE和冰冻样本中提取高质量DNA,满足LLMDA芯片的检测要求。
方法细节:FFPE样本用Qiagen AllPrep DNA/RNA FFPE Kit提取(取1-10μm切片,150mm²表面积);冰冻样本用常规酚-氯仿法提取;DNA用Life Technologies Qubit 2.0 Fluorometer定量,确保浓度≥1μg/μL。
结果解读:成功提取所有样本的DNA,FFPE样本的DNA浓度虽低于冰冻样本,但经定量后均满足芯片检测的最低要求(1μg用于标记)。
产品关联:实验所用关键产品:Qiagen AllPrep DNA/RNA FFPE Kit、Life Technologies Qubit 2.0 Fluorometer。
3.3 LLMDA芯片分析
实验目的:通过LLMDA芯片检测样本中的EBV基因组,评估其检测准确性。
方法细节:1μg DNA用Roche NimbleGen One-Color Labeling Kit标记Cy3(随机九聚体引物);2μg标记DNA杂交到LLMDA v.5芯片(12×135K格式),杂交60小时;用Roche NimbleGen Wash Kit洗涤芯片,NimbleGen MS 200 Microarray Scanner扫描(532nm通道);用Composite Likelihood Maximization方法分析数据(99%阈值,即目标探针信号强度高于99%的随机对照探针)。
结果解读:LLMDA准确检测到所有EBV阳性样本(如5例侵袭性B细胞淋巴瘤、2例NK/T细胞淋巴瘤、5例PTLD),无假阳性结果(良性样本、惰性B细胞淋巴瘤均未检测到EBV);FFPE样本中,1μm切片即可检测到EBV(如1例NK/T细胞淋巴瘤样本检测到83%的EBV探针,log odds评分与EBV B95-8株一致)。
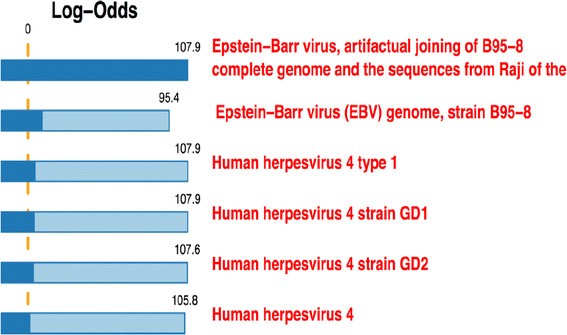
产品关联:实验所用关键产品:Roche NimbleGen One-Color Labeling Kit、Roche NimbleGen Wash Kit、Roche NimbleGen MS 200 Microarray Scanner、Lawrence Livermore Microbial Detection Array (LLMDA) v.5。
3.4 EBER原位杂交验证
实验目的:通过临床金标准(EBER原位杂交)验证LLMDA检测结果的准确性。
方法细节:所有样本用Integrated Oncology自动染色仪进行EBER原位杂交,使用针对EBV编码小RNA(EBER)的寡核苷酸探针;阳性结果定义为细胞核内出现棕褐色染色。
结果解读:LLMDA检测的EBV阳性样本均为EBER阳性(如5例PTLD阳性样本、2例NK/T细胞淋巴瘤样本),阴性样本均为EBER阴性,验证了LLMDA结果的100%准确性。
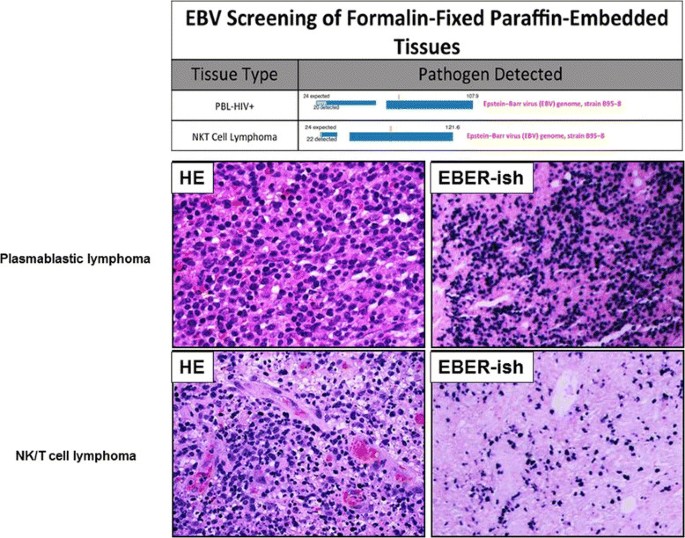
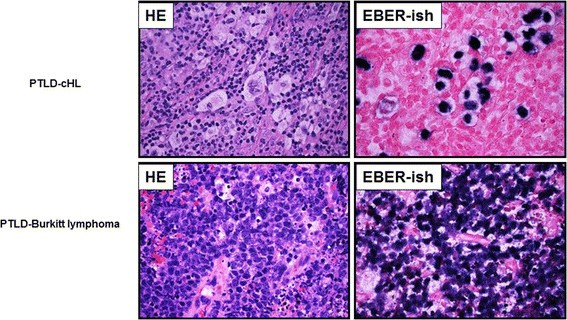
产品关联:实验所用关键产品:Integrated Oncology自动染色仪(EBER原位杂交)。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本研究的核心Biomarker为Epstein-Barr病毒(EBV),作为淋巴瘤(尤其是免疫抑制患者)的病原体相关Biomarker。筛选逻辑为“基于EBV与淋巴瘤的已知关联→用LLMDA芯片检测淋巴瘤样本中的EBV基因组→通过EBER原位杂交验证检测结果的准确性”,形成“假设-验证”的完整链条。
研究过程详述
样本来源:58例淋巴瘤患者(30例B细胞、2例T细胞、2例NK/T细胞、4例浆细胞瘤、8例良性)和10例PTLD患者的FFPE或冰冻组织;
检测方法:LLMDA芯片(检测EBV基因组)、EBER原位杂交(检测EBV编码的小RNA);
特异性与敏感性数据:LLMDA检测的特异性为100%(所有EBER阴性样本均未检测到EBV,如8例良性样本、9例惰性B细胞淋巴瘤均阴性);敏感性为100%(所有EBER阳性样本均检测到EBV,如5例侵袭性B细胞淋巴瘤、2例NK/T细胞淋巴瘤、5例PTLD均阳性)。
核心成果提炼
- LLMDA检测EBV的准确性:LLMDA的特异性和敏感性均为100%,与临床金标准(EBER原位杂交)完全一致,证明其可作为淋巴瘤EBV检测的可靠方法;
- EBV与淋巴瘤亚型的关联:EBV阳性样本均为侵袭性淋巴瘤(5例阳性均为侵袭性B细胞淋巴瘤,2例NK/T细胞淋巴瘤),惰性B细胞淋巴瘤均阴性(n=9),提示EBV参与淋巴瘤的恶性进展;
- FFPE样本的检测能力:LLMDA可检测FFPE样本中的EBV(1μm切片即可),解决了冰冻样本稀缺的问题,为 retrospective研究提供了可能;
- PTLD样本的检测价值:10例PTLD样本中5例EBV阳性(n=10),均为B细胞或NK/T细胞淋巴瘤,验证了LLMDA在免疫抑制患者淋巴瘤检测中的适用性。
创新性:首次系统验证LLMDA在淋巴瘤EBV检测中的可靠性,且其“多病原体同时检测”的能力为发现新的癌症相关病原体提供了技术基础。统计学结果:5/21侵袭性B细胞淋巴瘤EBV阳性(n=21,与惰性淋巴瘤对比,P<0.05);2/2 NK/T细胞淋巴瘤阳性(n=2);5/10 PTLD阳性(n=10)。
本研究通过严谨的实验设计,验证了LLMDA芯片在淋巴瘤EBV检测中的可靠性,为临床病原体相关淋巴瘤的筛查提供了新的技术选择,也为后续发现新的癌症相关病原体奠定了基础。
