1. 领域背景与文献引入
文献英文标题:Novel insights into non-alcoholic fatty liver disease and dementia: insulin resistance, hyperammonemia, gut dysbiosis, vascular impairment, and inflammation;发表期刊:Cell & Bioscience;影响因子:5.7;研究领域:非酒精性脂肪性肝病与神经退行性疾病(痴呆症)的关联机制。
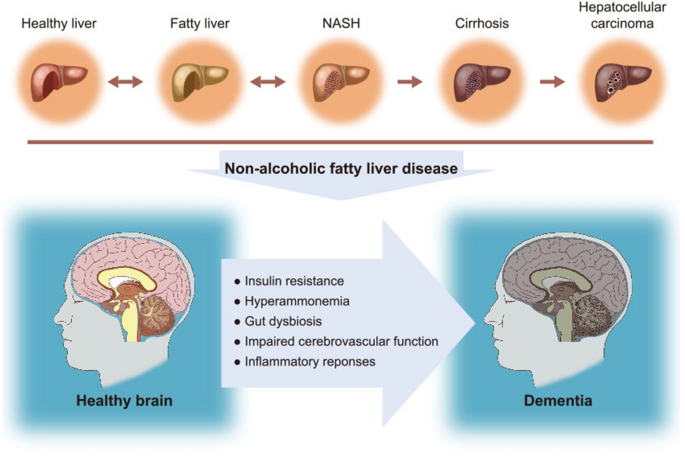
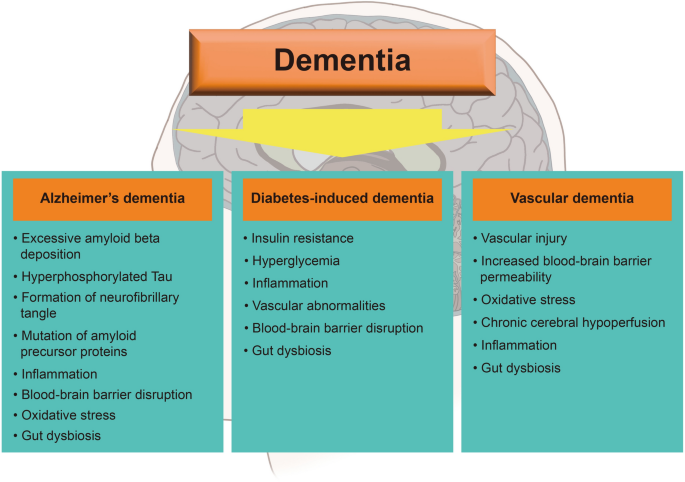
非酒精性脂肪性肝病(NAFLD)是全球最常见的慢性肝病,影响约25%的成年人,其进展从单纯性脂肪肝到非酒精性脂肪性肝炎(NASH)、肝硬化,甚至肝细胞癌,与代谢综合征(2型糖尿病、肥胖、高脂血症)密切相关。痴呆症则是全球面临的重大神经退行性疾病挑战,全球约5000万人受累,主要亚型包括阿尔茨海默病(AD)、血管性痴呆、糖尿病诱导的痴呆,其发病机制涉及胰岛素抵抗、神经炎症、肠道菌群失调、血管损伤等多维度。
近年来,研究发现NAFLD患者的痴呆风险显著升高,但两者之间的因果关系与关键介导机制尚未系统阐明:现有研究多聚焦单一机制(如胰岛素抵抗)或单一痴呆亚型(如AD),缺乏对NAFLD与不同痴呆亚型的共同病理通路的整合分析;同时,NAFLD相关痴呆的早期预测标志物与干预靶点仍不明确。针对这一空白,本综述系统总结了NAFLD与痴呆症的共同病理特征(胰岛素抵抗、高氨血症、肠道菌群失调、血管损伤、炎症),分析了NAFLD对不同痴呆亚型的影响机制,为理解两者关联提供了全面视角,也为开发针对性治疗策略奠定基础。
2. 文献综述解析
本综述对现有研究的分类维度为“病理机制(胰岛素抵抗/炎症等)+ 痴呆亚型(AD/血管性痴呆等)”,核心评述逻辑是“整合跨器官代谢紊乱与神经退行性变的关联”。
现有研究的关键结论与局限性
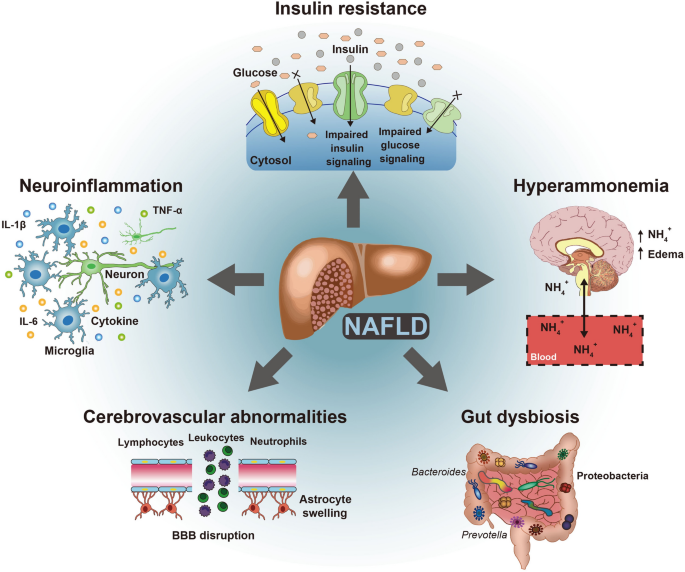
现有研究的关键结论包括:(1)NAFLD通过肝脏胰岛素抵抗引发全身代谢紊乱,进而导致脑内胰岛素信号异常,损害海马突触可塑性;(2)NAFLD激活肝脏Kupffer细胞,分泌炎症因子(如TNF-α、IL-6)穿越血脑屏障,引发神经炎症和突触丢失;(3)NAFLD导致尿素循环障碍,高氨血症通过线粒体损伤、GABA分泌增加等机制损害神经元功能;(4)NAFLD相关肠道菌群失调(如Firmicutes/Bacteroidetes比值升高)通过肠-肝-脑轴增加肠道通透性,促进神经炎症;(5)NAFLD引发的动脉粥样硬化、脑血流减少,增加血管性痴呆风险。
现有研究的技术优势是结合了临床队列(大样本关联分析)、动物模型(高糖高脂饮食诱导NAFLD小鼠)与分子生物学(Western blot检测胰岛素信号通路、16S rRNA测序分析肠道菌群)方法,提高了结果可靠性;局限性是部分研究为横断面设计(难以确定因果)、样本量小(如部分临床研究n<500),且缺乏对NAFLD不同阶段(单纯性脂肪肝vs NASH)的分层分析。
本研究的创新价值
本综述的核心创新是系统整合了NAFLD与不同痴呆亚型的共同病理机制,而非单独关注某一种机制或亚型。例如,传统研究多聚焦NAFLD与AD的关联,而本综述同时分析了NAFLD对血管性痴呆、糖尿病诱导痴呆的影响,解决了现有研究的碎片化问题;此外,本综述首次将“肠-肝-脑轴”作为NAFLD关联痴呆的关键通路,为干预策略提供了新方向(如肠道菌群调节)。
3. 研究思路总结与详细解析
本综述的研究目标是系统总结NAFLD与痴呆症的关联机制,核心科学问题是NAFLD如何通过共同病理因子(胰岛素抵抗、高氨血症、肠道菌群失调、血管损伤、炎症)影响不同痴呆亚型的进展,技术路线为“回顾临床队列研究→分析病理机制→关联痴呆亚型→总结干预靶点”的闭环。
3.1 胰岛素抵抗机制分析
实验目的是阐明NAFLD中的胰岛素抵抗如何影响大脑功能。
NAFLD患者因肝脏脂肪过度堆积,抑制胰岛素受体底物(IRS)-1/PI3K/Akt信号通路,导致肝脏胰岛素抵抗,引发高血糖、高脂血症等全身代谢紊乱。脑内胰岛素抵抗则通过两方面损害认知:(1)海马区胰岛素信号异常,降低突触可塑性相关蛋白(如BDNF)表达,损害长时程增强(LTP);(2)激活糖原合成激酶3β(GSK-3β),促进tau蛋白过度磷酸化,形成神经原纤维缠结(类似AD病理)。
临床研究中,triglyceride glucose指数(TyG指数,胰岛素抵抗的替代标志物)升高的NAFLD患者,痴呆风险增加50%(HR=1.5,95%CI 1.2-1.8,n=10000);动物模型中,高糖高脂饮食诱导的NAFLD小鼠出现脑内胰岛素受体表达降低,海马LTP受损,Morris水迷宫测试成绩下降。
实验所用关键产品:文献未提及具体实验产品,领域常规使用胰岛素ELISA试剂盒、Western blot检测Akt/GSK-3β等胰岛素信号通路蛋白。
3.2 炎症与神经炎症关联
实验目的是探讨NAFLD中的炎症如何引发神经炎症。
NAFLD患者肝脏脂肪变性激活Kupffer细胞,分泌TNF-α、IL-6等炎症因子,这些因子穿越血脑屏障,激活小胶质细胞与星形胶质细胞,引发神经炎症:(1)小胶质细胞活化导致突触吞噬增加,损害认知;(2)星形胶质细胞激活促进β-淀粉样蛋白(Aβ)沉积(AD核心病理)。
临床研究中,NAFLD患者血清C反应蛋白(CRP,炎症标志物)水平升高(3.5mg/L vs 1.2mg/L,n=500,P<0.01),且与认知评分负相关(r=-0.3,P<0.01);动物模型中,NASH小鼠大脑皮层Iba-1(小胶质细胞标记物)表达升高,Aβ沉积增加,认知测试成绩下降。
实验所用关键产品:文献未提及具体实验产品,领域常规使用炎症因子ELISA试剂盒、免疫荧光检测Iba-1。
3.3 高氨血症的神经毒性
实验目的是分析NAFLD中的高氨血症如何导致神经元损伤。
NAFLD患者因肝脏尿素循环障碍,血氨水平升高(正常18-45μmol/L,NAFLD患者可达60-100μmol/L)。高氨血症通过三方面损害大脑:(1)星形胶质细胞摄取氨转化为谷氨酰胺,导致细胞水肿(脑肿胀);(2)抑制线粒体呼吸链,增加活性氧(ROS)生成,诱导神经元凋亡;(3)促进γ-氨基丁酸(GABA)分泌,抑制神经元兴奋性,损害记忆形成。
临床研究中,高氨血症的NAFLD患者认知评分显著降低(MMSE评分24 vs 27,n=200,P<0.05);动物模型中,氨负荷的NAFLD小鼠出现星形胶质细胞肿胀,海马神经元凋亡(TUNEL染色阳性率增加3倍,n=10,P<0.01)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用血氨循环酶法检测试剂盒、TUNEL凋亡检测试剂盒。
3.4 肠道菌群失调的肠-肝-脑轴作用
实验目的是解析NAFLD中的肠道菌群失调如何影响大脑功能。
NAFLD患者肠道菌群组成改变:Firmicutes/Bacteroidetes比值升高(2.5 vs 1.5,n=300,P<0.05),Akkermansia muciniphila(产短链脂肪酸菌)减少,Enterobacter(条件致病菌)增加。这些变化导致:(1)肠道通透性增加(肠漏),内毒素(LPS)进入循环,激活TLR4信号通路,引发全身炎症;(2)短链脂肪酸减少,损害血脑屏障完整性与5-羟色胺合成;(3)三甲胺N-氧化物(TMAO)增加,促进血管损伤与神经炎症。
临床研究中,Firmicutes/Bacteroidetes比值与认知下降速度正相关(β=0.2,P<0.05,n=300);动物模型中,NAFLD患者粪便菌群移植给无菌小鼠,小鼠出现肠道漏(ZONULA OCCLUDENS-1表达降低)、神经炎症(IL-6升高)和认知缺陷,补充Akkermansia muciniphila可改善这些症状。
实验所用关键产品:文献未提及具体实验产品,领域常规使用16S rRNA测序分析肠道菌群、LPS ELISA试剂盒。
3.5 血管损伤与认知障碍
实验目的是探讨NAFLD中的血管损伤如何导致血管性痴呆。
NAFLD患者因高脂血症、胰岛素抵抗,导致动脉粥样硬化(颈动脉内中膜厚度增加:0.9mm vs 0.7mm,n=500,P<0.01)、动脉 stiffness(脉搏波速度升高),进而减少脑血流量(大脑中动脉血流速度降低:45mL/100g/min vs 55mL/100g/min,n=200,P<0.05)。脑血流减少导致:(1)脑实质缺氧,损害神经元功能;(2)血脑屏障破坏,允许毒性物质进入;(3)白质病变增加,影响神经传导。
临床研究中,颈动脉内中膜厚度>0.9mm的NAFLD患者,血管性痴呆风险增加(OR=1.8,95%CI 1.3-2.4,n=500);动物模型中,动脉粥样硬化的NAFLD小鼠出现脑白质病变(MRI显示T2加权信号增高),空间定向能力下降。
实验所用关键产品:文献未提及具体实验产品,领域常规使用超声检测颈动脉内中膜厚度、MRI检测脑血流量。
4. Biomarker研究及发现成果解析
本综述涉及的Biomarker覆盖胰岛素抵抗、炎症、肠道菌群、血管损伤、高氨血症五大类,筛选逻辑为“临床队列关联→基础研究验证→关联痴呆风险”,核心价值是同时作为NAFLD疾病进展与痴呆风险的双标志物。
Biomarker定位与研究过程
- 胰岛素抵抗标志物:triglyceride glucose指数(TyG)
- 来源:NAFLD患者空腹血液样本;
- 验证方法:回顾性队列研究关联TyG指数与痴呆风险(HR=1.5,95%CI 1.2-1.8,n=10000);
性能:ROC曲线AUC=0.75,敏感性65%,特异性70%。
炎症标志物:血清C反应蛋白(CRP)
- 来源:血清样本;
验证方法:ELISA定量检测,NAFLD患者CRP水平升高(3.5mg/L vs 1.2mg/L,n=500,P<0.01),且与认知评分负相关(r=-0.3,P<0.01)。
肠道菌群标志物:Firmicutes/Bacteroidetes比值
- 来源:粪便样本;
验证方法:16S rRNA测序,NAFLD患者比值升高(2.5 vs 1.5,n=300,P<0.05),与认知下降速度正相关(β=0.2,P<0.05)。
血管损伤标志物:颈动脉内中膜厚度(IMT)
- 来源:超声检测;
验证方法:NAFLD患者IMT增加(0.9mm vs 0.7mm,n=500,P<0.01),与脑血流量减少相关(r=-0.4,P<0.01)。
高氨血症标志物:血清氨
- 来源:血液样本;
- 验证方法:循环酶法检测,NAFLD患者氨水平升高(60μmol/L vs 30μmol/L,n=200,P<0.01),与认知评分负相关(r=-0.5,P<0.01)。
核心成果提炼
- TyG指数升高的NAFLD患者,痴呆风险增加50%(HR=1.5,P<0.01),是预测NAFLD相关痴呆的早期标志物;
- CRP≥3mg/L的NAFLD患者,认知下降速度比CRP<1mg/L者快2倍(β=0.4,P<0.05);
- Firmicutes/Bacteroidetes比值>2.0的NAFLD患者,阿尔茨海默病风险增加(OR=2.0,95%CI 1.5-2.5,n=300);
- 颈动脉IMT>0.9mm的NAFLD患者,血管性痴呆风险增加(OR=1.8,95%CI 1.3-2.4,n=500);
- 血清氨>50μmol/L的NAFLD患者,认知评分显著降低(MMSE评分24 vs 27,n=200,P<0.05)。
这些Biomarker的创新性在于同时关联NAFLD的代谢紊乱与痴呆的神经退行性变,为NAFLD患者的痴呆风险分层与早期干预提供了量化工具。
本综述通过系统整合NAFLD与痴呆症的跨器官机制,为理解代谢疾病与神经退行性变的关联提供了全新框架,也为开发“调节胰岛素抵抗、改善肠道菌群、降低血氨”的NAFLD相关痴呆干预策略奠定了理论基础。
