1. 领域背景与文献引入
文献英文标题:Insights into KMT2A rearrangements in acute myeloid leukemia: from molecular characteristics to targeted therapies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:急性髓系白血病(KMT2A重排亚型)的分子机制、诊断技术与靶向治疗转化研究。
急性髓系白血病(AML)是一类高度异质性的血液系统恶性肿瘤,以髓系祖细胞克隆性扩增、分化阻滞为核心特征。KMT2A重排(KMT2A-r)AML是其中的高危亚型,占成人初发AML的3%-6%、治疗相关AML的10%,被世界卫生组织(WHO)及2022年国际共识分类(ICC)列为独立的临床生物学实体。领域发展关键节点包括:20世纪90年代明确KMT2A(原MLL)基因重排与白血病的关联;2010年后下一代测序(NGS)技术推动罕见融合伴侣的鉴定;2024年美国FDA批准首个针对该亚型的Menin抑制剂Revumenib,标志着治疗从传统化疗向靶向表观调控的范式转变。当前研究热点集中于靶向KMT2A融合蛋白的表观调控通路、基于机器学习的生物标志物筛选、最小残留病(MRD)监测优化等方向,但仍存在核心未解决问题:KMT2A-r的分子异质性导致诊断分层与治疗响应预测困难,耐药机制尚未完全阐明,缺乏可广泛应用的预后与疗效预测生物标志物。针对上述领域空白,本综述系统整合KMT2A-r AML的分子特征、诊断技术迭代、靶向治疗进展及未来挑战,为该亚型的精准诊疗转化提供全面参考框架。
2. 文献综述解析
作者以“分子基础-诊断技术-治疗策略-未来方向”为核心分类维度,对KMT2A-r AML领域的现有研究进行结构化评述。
现有研究的关键结论可分为三类:一是分子机制层面,KMT2A重排通过形成融合蛋白,保留N端Menin结合域但丢失C端SET甲基转移酶结构域,招募DOT1L等辅因子导致组蛋白H3K79异常甲基化,持续激活HOXA/MEIS1致癌通路;二是诊断技术层面,传统荧光原位杂交(FISH)、反转录PCR(RT-PCR)是常规检测方法,但存在罕见融合假阴性、灵敏度不足等局限,NGS技术可实现高灵敏度的融合伴侣鉴定,机器学习模型能基于转录组数据预测KMT2A-r并挖掘潜在生物标志物;三是治疗层面,Menin抑制剂、DOT1L抑制剂等靶向表观调控的药物在临床前及早期临床试验中显示出抗白血病活性,为高危患者提供了新的治疗选择。现有技术方法的优势在于,NGS可同时检测多种基因组异常,机器学习能从海量转录组数据中挖掘潜在生物标志物;局限性则包括FISH对罕见融合的检测盲区、NGS成本较高、Menin抑制剂缺乏长期生存数据及耐药应对策略等。
本综述的创新价值在于,首次系统整合了2023-2025年的最新研究成果,包括PROTAC介导的KMT2A复合物降解、WDR5抑制剂等新兴治疗策略,以及机器学习在生物标志物筛选中的应用,填补了现有综述对前沿技术与最新临床数据整合的空白。同时,综述通过对比现有研究在耐药机制、生物标志物验证等方面的不足,强调了从分子机制到个性化治疗转化的紧迫性,为领域后续研究提供了清晰的方向指引。
3. 研究思路总结与详细解析
本研究为系统性综述,整体框架以“分子特征解析-诊断技术迭代-靶向治疗进展-未来挑战展望”为逻辑闭环,核心研究目标是全面梳理KMT2A-r AML的基础与临床研究进展,为该亚型的精准诊疗提供理论支撑与实践参考;核心科学问题聚焦于KMT2A重排的致癌机制、诊断技术的优化方向及靶向治疗的转化路径。
3.1 KMT2A分子结构与重排致癌机制
实验目的:明确KMT2A基因的正常功能及重排后的致癌分子机制。
方法细节:通过调研已发表的基础研究文献,系统分析KMT2A基因的染色体定位、蛋白结构域功能、重排类型及下游调控通路。
结果解读:KMT2A基因位于11q23,编码的约500 kDa蛋白被taspase-1切割为N端(含Menin结合域、AT-hook基序)和C端(含SET甲基转移酶结构域)片段,正常生理状态下通过催化组蛋白H3K4甲基化调控HOX基因表达,维持造血干细胞的自我更新与分化平衡。KMT2A重排主要发生在断点簇区域(BCR),与超过100种伴侣基因形成融合蛋白,融合蛋白丢失C端SET结构域,通过N端Menin结合域招募DOT1L等辅因子,导致组蛋白H3K79异常甲基化,持续激活HOXA/MEIS1致癌通路,驱动白血病发生。
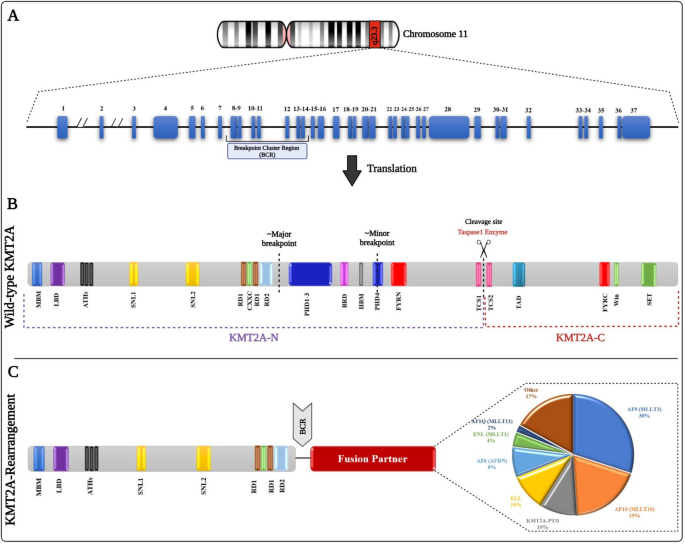
产品关联:文献未提及具体实验产品,领域常规使用免疫组化(IHC)、蛋白质免疫印迹(WB)等技术检测组蛋白甲基化水平,FISH探针、NGS测序平台用于KMT2A重排的鉴定。
3.2 KMT2A重排AML诊断技术体系
实验目的:总结KMT2A-r AML的诊断技术及优缺点,为临床诊断提供参考。
方法细节:调研从传统到新兴的KMT2A-r检测技术,包括免疫表型分析、细胞遗传学检测、分子生物学检测及机器学习辅助诊断。
结果解读:免疫表型分析中,神经胶质抗原2(NG2)在约90%的11q23/KMT2A-r白血病细胞中表达,但特异性不足,也可见于其他AML亚型;FISH是常规检测方法,使用KMT2A 5’/3’探针可检测重排,但对涉及次要BCR的融合(如KMT2A-USP2)可能出现假阴性;RT-PCR可检测常见融合伴侣,长距离反向PCR(LDI-PCR)能鉴定罕见融合;NGS技术可实现高灵敏度的全基因组融合检测,同时发现其他伴随的基因组异常;机器学习模型基于转录组数据,可识别LAMP5、SKIDA1等生物标志物,预测KMT2A-r的AUC分别为0.746、0.839,提高风险分层准确性。
产品关联:文献提及商业化KMT2A FISH探针试剂盒、NGS测序平台,未明确品牌,领域常规使用Illumina、NovaSeq等NGS平台,流式细胞仪用于免疫表型分析。
3.3 靶向治疗策略与临床研究进展
实验目的:系统总结KMT2A-r AML的靶向治疗进展及临床研究数据。
方法细节:调研已发表的临床前及临床研究文献,包括Menin抑制剂、DOT1L抑制剂、WDR5抑制剂及PROTAC等新兴治疗策略的研究结果。
结果解读:Menin抑制剂通过阻断Menin-KMT2A融合蛋白的相互作用,抑制HOXA/MEIS1通路,诱导白血病细胞分化。其中Revumenib(SNDX-5613)于2024年获FDA批准,用于治疗复发/难治性(R/R)KMT2A-r急性白血病,在I/II期临床试验中,KMT2A-r患者的总缓解率(ORR)为53%,完全缓解(CR)/伴部分血液学恢复的完全缓解(CRh)率为30%;Ziftomenib(KO-539)在I/II期临床试验中,600mg剂量组的ORR为42%,CR/CRh率为25%。DOT1L抑制剂Pinometostat(EPZ-5676)单药治疗R/R KMT2A-r AML的疗效有限,仅2例患者达到CR,但联合化疗或其他靶向药物显示出潜在协同作用。此外,WDR5抑制剂、PROTAC介导的KMT2A复合物降解等新兴策略处于临床前研究阶段,为后续治疗提供了新方向。
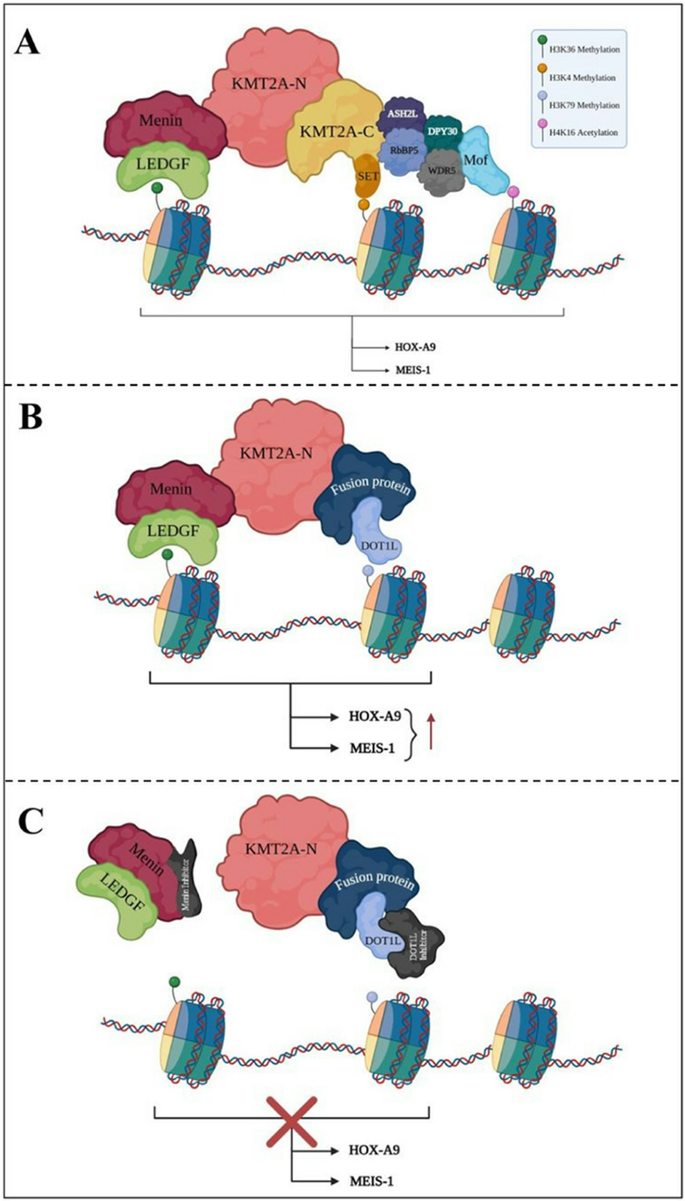
产品关联:文献明确提及实验所用关键产品:Menin抑制剂Revumenib(SNDX-5613)、Ziftomenib(KO-539),DOT1L抑制剂Pinometostat(EPZ-5676)。
3.4 未来挑战与转化研究方向
实验目的:分析KMT2A-r AML领域当前的挑战及未来研究方向。
方法细节:调研现有研究的局限性及未解决问题,结合临床需求提出未来研究重点。
结果解读:当前领域面临的核心挑战包括:KMT2A-r的分子异质性导致诊断分层与治疗响应预测困难,耐药机制尚未完全阐明,缺乏可靠的预后与疗效预测生物标志物,MRD监测方法需进一步优化。未来研究方向应聚焦于:阐明耐药机制并开发应对策略,验证LAMP5、SKIDA1等生物标志物的临床价值,开展大规模III期临床试验验证Menin抑制剂等靶向药物的疗效,探索联合治疗策略以提高疗效并减少耐药。
产品关联:文献未提及具体实验产品,领域常规使用数字PCR、流式细胞术等技术进行MRD监测。
4. Biomarker研究及发现成果解析
Biomarker定位
文献中涉及的Biomarker分为三类:诊断Biomarker(NG2、LAMP5、SKIDA1)、治疗响应Biomarker(HOXA9/MEIS1)。筛选与验证逻辑为:NG2通过免疫表型分析发现与KMT2A-r的相关性;LAMP5、SKIDA1通过机器学习模型分析转录组数据筛选,并验证其与KMT2A-r的关联;HOXA9/MEIS1通过qRT-PCR检测,验证其作为Menin抑制剂治疗响应的动态Biomarker的价值。
研究过程详述
NG2来源于白血病细胞表面,采用流式细胞术检测,在约90%的11q23/KMT2A-r白血病细胞中表达,但也可见于FLT3突变、NPM1突变等其他AML亚型,特异性不足(文献未明确样本量及P值)。LAMP5、SKIDA1来源于AML患者的转录组数据,机器学习模型分析显示,两者过表达与KMT2A-r显著相关,AUC分别为0.746(95% CI 0.685-0.806)、0.839(95% CI 0.799-0.879)(文献未明确样本量)。HOXA9/MEIS1通过qRT-PCR检测,Menin抑制剂治疗后,HOXA9/MEIS1转录水平下降≥50%与患者生存延长相关(文献未明确样本量及P值)。
核心成果提炼
NG2可作为KMT2A-r AML的快速筛查Biomarker,但特异性不足,需结合其他检测方法;LAMP5、SKIDA1可提高KMT2A-r的预测准确性,有助于风险分层;HOXA9/MEIS1可作为Menin抑制剂治疗响应的动态Biomarker,其表达水平变化可用于评估疗效及预测生存。其中,LAMP5和SKIDA1是首次通过机器学习在转录组数据中发现的KMT2A-r相关Biomarker,为该亚型的诊断提供了新的潜在靶点。
