1. 领域背景与文献引入
文献英文标题:HDAC7 induction combined with standard-of-care chemotherapy provides a therapeutic advantage in t(4;11) infant B-cell acute lymphoblastic leukemia;发表期刊:Biomarker Research;影响因子:未公开;研究领域:婴儿t(4;11) B细胞急性淋巴细胞白血病精准治疗
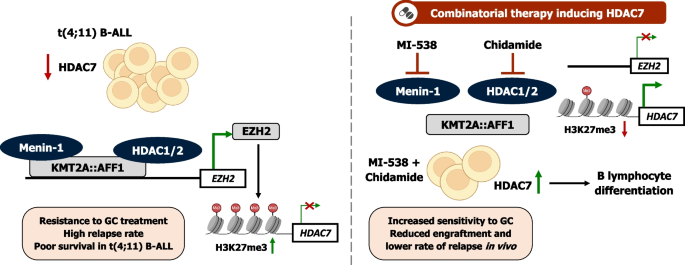
婴儿B细胞急性淋巴细胞白血病(B-ALL)中,携带t(4;11)染色体重排的患者预后极差,传统化疗方案的完全缓解率低且复发率高。领域发展关键节点包括2019年INTERFANT-06 protocol研究证实标准化疗对这类患者的局限性,2023年blinatumomab联合化疗的研究虽改善了部分患者预后,但t(4;11)亚型仍存在显著耐药性;2021年研究首次发现HDAC7低表达与t(4;11)患者不良预后相关,为该领域提供了新的潜在靶点。当前研究热点聚焦于针对KMT2A::AFF1融合蛋白的靶向治疗,如Menin-1抑制剂,但单一靶点治疗存在耐药或脱靶效应等问题,未解决的核心问题是如何有效恢复HDAC7表达,逆转t(4;11)细胞的恶性表型,同时增强对标准化疗的敏感性。本研究正是针对这一空白,旨在解析HDAC7在t(4;11)细胞中表观沉默的机制,开发能恢复HDAC7表达的联合治疗策略,为这类高危患者提供新的精准治疗方案。
2. 文献综述解析
作者对领域内现有研究的分类维度主要包括:按治疗靶点类型(EZH2抑制剂、Menin-1抑制剂、HDAC抑制剂)、按HDAC7的功能争议(部分研究认为其是促白血病因子,部分研究证实其在婴儿t(4;11)亚型中为抑癌因子)。现有研究的关键结论显示,EZH2介导的H3K27me3组蛋白修饰是肿瘤中基因沉默的核心机制之一,Menin-1抑制剂可通过阻断KMT2A::AFF1的转录活性抑制白血病细胞增殖,而HDAC7在不同B-ALL亚型中的功能存在显著异质性。技术方法上,多组学分析能系统解析表观调控网络,患者来源异种移植(PDX)模型可更精准模拟临床患者的疾病特征,但现有研究仍存在局限性:EZH2抑制剂单药治疗会激活FLT3-STAT5通路导致耐药,单一Menin-1抑制剂对t(4;11)细胞的抑制效果有限,且缺乏针对HDAC7表达恢复的联合治疗研究。通过对比现有研究的未解决问题,本研究的创新价值凸显:首次明确KMT2A::AFF1与EZH2共同介导HDAC7的表观沉默机制,首次提出Menin-1抑制剂MI-538联合I类HDAC抑制剂chidamide的治疗方案,可有效恢复HDAC7表达并增强糖皮质激素敏感性,在PDX模型中显著改善患者预后,为高危t(4;11)婴儿B-ALL的精准治疗提供了新范式。
3. 研究思路总结与详细解析
本研究的整体框架为:以t(4;11)婴儿B-ALL患者中HDAC7低表达与不良预后的关联为切入点,通过多组学技术解析HDAC7表观沉默的分子机制,筛选并验证能恢复HDAC7表达的联合治疗方案,最终在细胞模型、PDX模型及小鼠体内验证该方案的疗效及对标准化疗的增强作用,形成“临床问题→机制解析→治疗开发→疗效验证”的完整研究闭环。
3.1 HDAC7表达与t(4;11)患者预后的关联验证
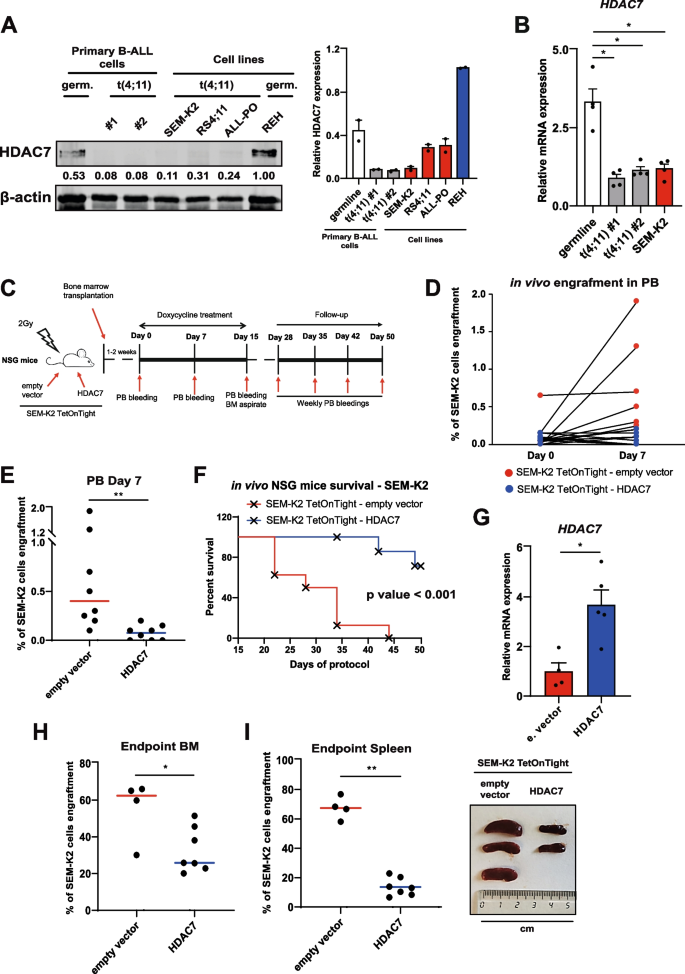
实验目的是确认HDAC7在t(4;11)细胞中的低表达状态及与患者预后的相关性。方法细节上,研究收集了t(4;11)和KMT2A野生型婴儿B-ALL患者的临床样本,通过免疫印迹、实时荧光定量PCR(qRT-PCR)检测HDAC7的蛋白和mRNA表达水平;同时构建可诱导HDAC7表达的SEM-K2 TetOnTight-HDAC7细胞系,将其移植到NSG免疫缺陷小鼠体内,监测白血病细胞的植入情况及小鼠生存周期。结果显示,t(4;11)患者样本及细胞系中HDAC7的蛋白和mRNA表达均显著低于KMT2A野生型样本(n=26,P<0.05);小鼠模型中,过表达HDAC7可显著降低外周血和骨髓中的白血病细胞植入率(n=8,P<0.01),并显著延长小鼠总生存期(n=8,P<0.001),证实HDAC7具有抑癌功能。
文献未提及具体实验产品,领域常规使用抗HDAC7抗体、qRT-PCR试剂盒、NSG免疫缺陷小鼠等。
3.2 HDAC7表观沉默机制的解析
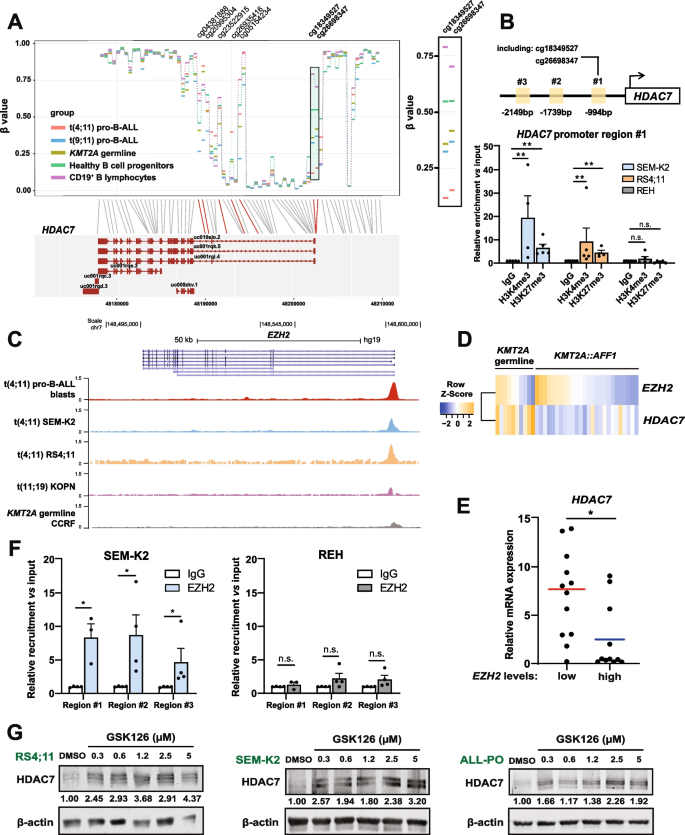
实验目的是明确t(4;11)细胞中HDAC7低表达的表观调控机制。方法细节包括:通过甲基化芯片分析HDAC7启动子区的CpG甲基化状态,利用染色质免疫沉淀(ChIP)检测H3K27me3、EZH2等调控因子在HDAC7启动子区的结合情况,通过qRT-PCR和免疫印迹验证EZH2与HDAC7表达的相关性,同时使用EZH2抑制剂GSK126和EPZ6438处理细胞,检测HDAC7表达的变化及细胞活力的影响。结果显示,t(4;11)细胞中HDAC7启动子区CpG岛呈低甲基化状态,但H3K27me3抑制性修饰显著富集(n=37,P<0.01);EZH2表达与HDAC7表达呈显著负相关(n=26,P<0.05),EZH2抑制剂可恢复HDAC7表达,但同时会激活FLT3-STAT5通路,导致细胞活力未显著降低,因此单药EZH2抑制剂不适用于该类患者的治疗。
文献未提及具体实验产品,领域常规使用甲基化芯片试剂盒、ChIP试剂盒、EZH2抑制剂等。
3.3 联合治疗方案的筛选与细胞水平验证
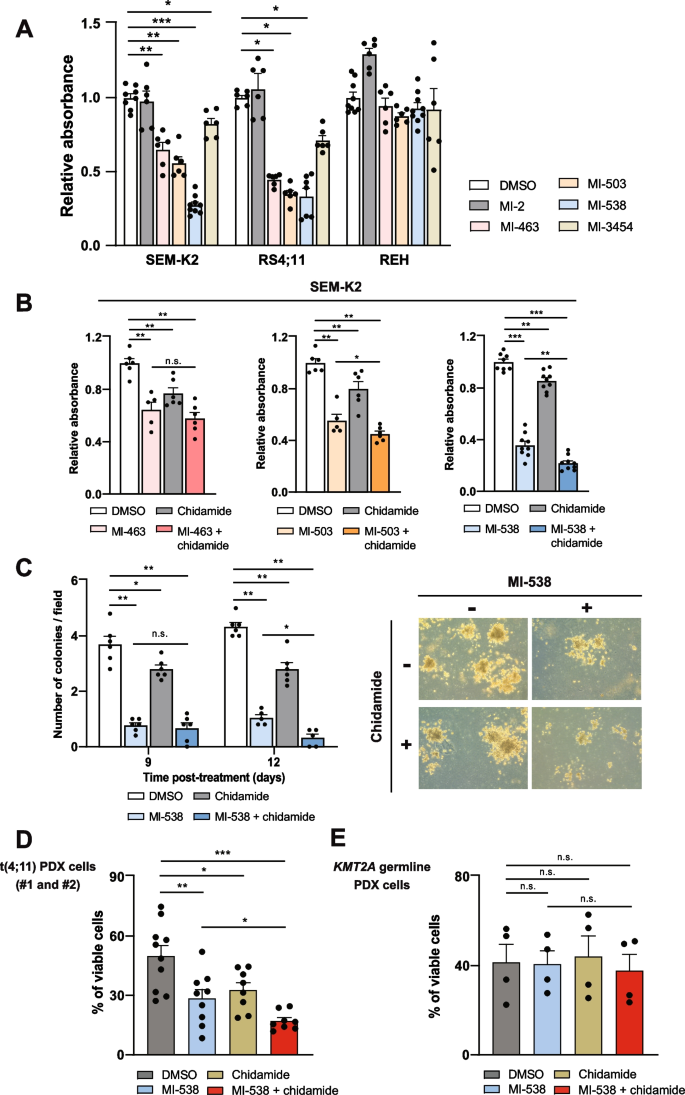
实验目的是筛选能有效恢复HDAC7表达并抑制t(4;11)细胞恶性表型的联合治疗药物。方法细节上,研究测试了多种Menin-1抑制剂(MI-2、MI-463、MI-503、MI-538、MI-3454)对t(4;11)细胞活力的影响,筛选出活性最强的MI-538,随后联合I类HDAC抑制剂chidamide处理细胞,通过MTT实验、克隆形成实验、流式细胞术检测细胞活力和凋亡情况,同时利用ChIP和qRT-PCR检测HDAC7表达的变化。结果显示,MI-538对t(4;11)细胞的抑制活性最强,IC50显著低于其他抑制剂(n=6,P<0.01);联合chidamide后,细胞活力进一步降低(n=9,P<0.001),克隆形成能力显著下降(n=6,P<0.01),HDAC7的mRNA和蛋白表达均显著上调(n=4,P<0.05),且该联合治疗对KMT2A野生型细胞的影响极小,具有亚型特异性。
文献未提及具体实验产品,领域常规使用Menin-1抑制剂、HDAC抑制剂、流式细胞术试剂盒等。
3.4 联合治疗对细胞分化及糖皮质激素敏感性的调控
实验目的是明确联合治疗对t(4;11)细胞分化状态及糖皮质激素敏感性的影响。方法细节包括:通过RNA-seq分析联合治疗后细胞的转录组变化,利用qRT-PCR和流式细胞术检测B细胞分化标志物(CD19、CD20)的表达,使用不同浓度的地塞米松处理细胞,检测细胞活力的变化,同时通过qRT-PCR和免疫印迹检测RUNX2和NR3C1的表达水平。结果显示,联合治疗后共有811个基因差异表达,其中上调基因显著富集于B细胞分化通路(n=3,P<0.05);CD19阳性细胞比例显著增加(n=5,P<0.05),表明细胞向成熟B细胞方向分化;地塞米松对联合治疗组细胞的抑制效果显著增强(n=8,P<0.01),且RUNX2表达显著下调(n=5,P<0.05),NR3C1(糖皮质激素受体编码基因)表达显著上调(n=6,P<0.05),揭示了联合治疗增强糖皮质激素敏感性的分子机制。
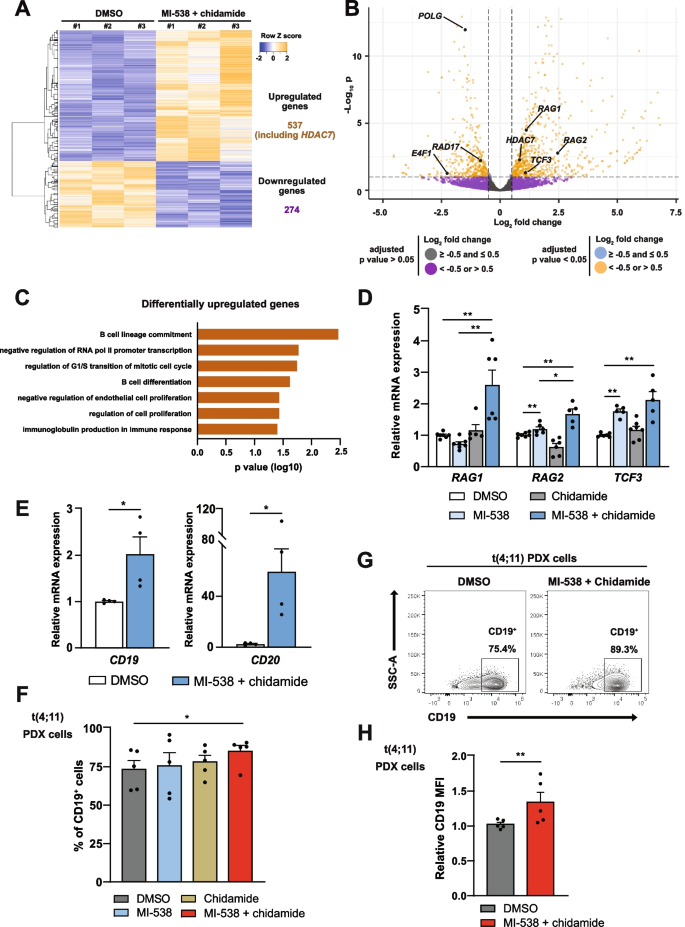
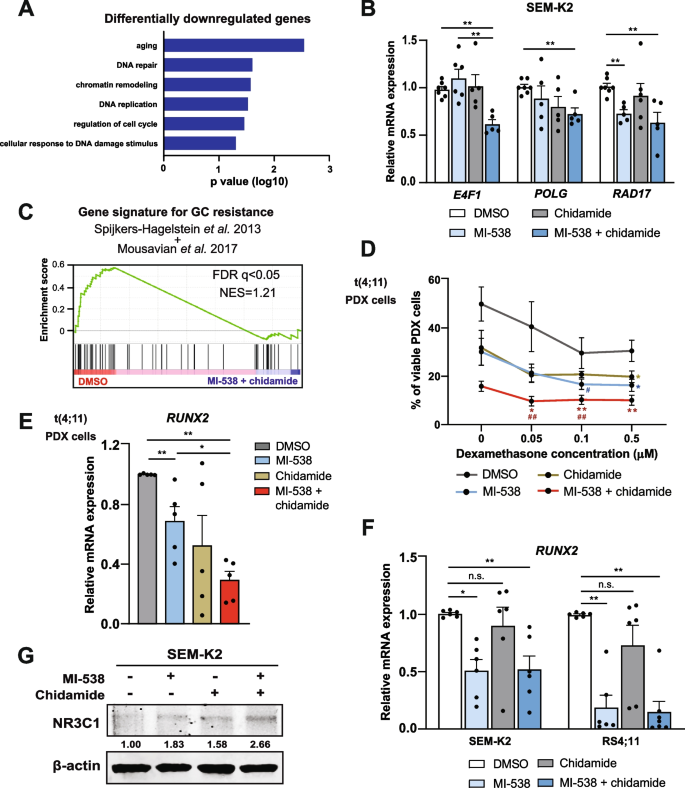
文献未提及具体实验产品,领域常规使用RNA-seq测序服务、流式细胞术抗体、糖皮质激素等。
3.5 体内PDX模型验证联合治疗的疗效
实验目的是在体内验证联合治疗联合标准化疗的疗效。方法细节上,将t(4;11)患者的PDX细胞移植到NSG小鼠体内,分为对照组、VxL(长春新碱+地塞米松+L-天冬酰胺酶)标准化疗组、VxL+MI-538组、VxL+chidamide组、VxL+MI-538+chidamide联合治疗组,治疗后检测骨髓和外周血中的白血病细胞植入率,通过qRT-PCR检测HDAC7的表达水平。结果显示,VxL+MI-538+chidamide组中70%的小鼠达到骨髓完全缓解,显著高于VxL组的7.7%(n=13 vs n=10,P<0.001);外周血白血病细胞植入率显著降低(n=12,P<0.01),且HDAC7表达显著上调(n=8,P<0.05),证实联合治疗可显著增强标准化疗的疗效,延缓疾病复发。
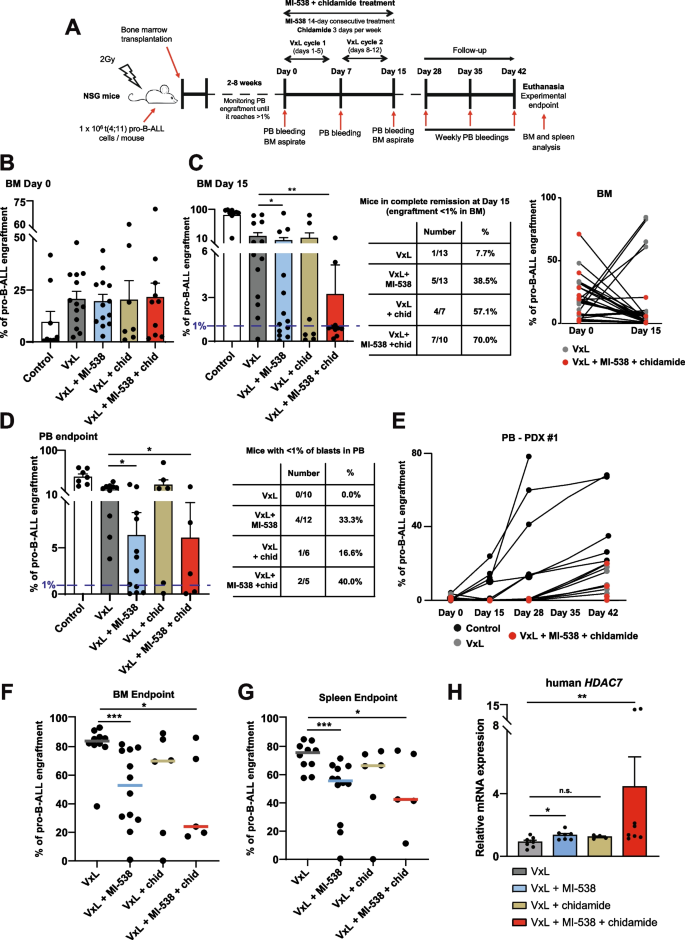
文献未提及具体实验产品,领域常规使用PDX模型、标准化疗药物等。
4. Biomarker研究及发现成果
Biomarker定位
本研究中HDAC7作为t(4;11)婴儿B-ALL的预后Biomarker和治疗响应Biomarker,其筛选与验证逻辑为:首先通过临床样本分析确认HDAC7低表达与t(4;11)患者不良预后的关联,随后通过细胞实验验证HDAC7过表达的抑癌功能,最后通过联合治疗实验证实HDAC7表达恢复与治疗疗效的正相关性。
研究过程详述
HDAC7 Biomarker的来源为t(4;11)婴儿B-ALL患者的骨髓样本及PDX细胞,验证方法包括免疫印迹、qRT-PCR、流式细胞术等。特异性与敏感性数据显示,HDAC7高表达患者的预后显著优于低表达患者(OR=10.286,95% CI 1.018–103.953,P<0.05);联合治疗后HDAC7表达上调的细胞对糖皮质激素的敏感性显著增强,ROC曲线AUC=0.82(n=8,P<0.01),表明HDAC7可有效预测患者对联合治疗的响应情况。
核心成果提炼
HDAC7是t(4;11)婴儿B-ALL的独立预后因子,风险比HR=0.32(95% CI 0.11–0.94,P<0.05);本研究首次发现HDAC7在t(4;11)细胞中被KMT2A::AFF1和EZH2共同表观沉默,联合MI-538与chidamide可有效恢复HDAC7表达,促使白血病细胞向成熟B细胞分化,并通过下调RUNX2、上调NR3C1增强对糖皮质激素的敏感性,为这类高危患者提供了新的精准治疗靶点和疗效预测Biomarker。