1. 领域背景与文献引入
文献英文标题:Daratumumab and venetoclax in combination with chemotherapy provide sustained molecular remission in relapsed/refractory CD19, CD20, and CD22 negative acute B lymphoblastic leukemia with KMT2A-AFF1 transcript;发表期刊:Biomarker Research;影响因子:未公开;研究领域:复发/难治性B细胞急性淋巴细胞白血病的靶向治疗
B细胞急性淋巴细胞白血病(B-ALL)是起源于B系淋巴祖细胞的恶性血液系统疾病,成人患者预后普遍较差,尤其是复发/难治性(R/R)病例,中位总生存期仅4-9个月。领域共识:异基因造血干细胞移植(ASCT)是目前治愈R/R B-ALL的核心手段,但移植前必须达到完全分子缓解以显著降低术后复发风险。近年来,以CD19、CD20、CD22为靶点的免疫治疗(如双特异性抗体、CAR-T细胞治疗)显著提高了R/R B-ALL患者的分子缓解率,但部分患者会出现靶点丢失(如CD19阴性转化)或表型切换,导致治疗耐药,这类患者的治疗选择极为有限;尤其是伴KMT2A(原MLL)融合基因的R/R B-ALL患者,其复发风险更高,常规治疗难以获得持续缓解。本研究正是针对这一临床空白,探索了CD38联合BCL-2靶点的联合治疗方案在CD19、CD20、CD22阴性伴KMT2A-AFF1融合的R/R B-ALL患者中的疗效,为这类特殊患者提供了新的治疗思路。
2. 文献综述解析
本文献为病例报告,其综述部分围绕R/R B-ALL的治疗现状展开,按治疗手段分为传统化疗、CD19/CD22靶向免疫治疗两类,系统评述了现有方案的优势与局限性。传统化疗如GRAALL-2005诱导方案可使部分患者获得形态学完全缓解,但难以清除微小残留病(MRD),尤其是伴KMT2A融合的患者,复发风险极高;以CD19、CD22为靶点的免疫治疗能有效清除MRD,为ASCT创造条件,但约10%-20%的患者会出现靶点丢失导致的耐药,且对于初始即无CD19、CD20、CD22表达的患者,这类免疫治疗完全无效。现有研究已证实BCL-2抑制剂维奈克拉在伴KMT2A融合的B-ALL中具有一定疗效,CD38单抗达雷妥尤单抗在多发性骨髓瘤及部分ALL亚型中显示出抗肿瘤活性,但二者联合化疗在CD19/20/22阴性伴KMT2A融合的R/R B-ALL患者中的疗效尚未见报道。本研究的创新价值在于首次将这一联合方案应用于该类极高危患者,成功获得持续分子缓解,填补了这类无常规免疫靶点患者治疗方案的空白。
3. 研究思路总结与详细解析
本研究为临床病例报告,核心目标是探索CD19、CD20、CD22阴性伴KMT2A-AFF1融合的R/R B-ALL患者的有效挽救治疗方案,核心科学问题是如何通过靶向非传统免疫靶点(CD38、BCL-2)联合化疗,清除MRD以达到适合ASCT的深度缓解,整体研究逻辑为:患者临床特征分析→初始治疗及复发耐药机制评估→首次挽救治疗(维奈克拉联合化疗)→二次挽救治疗(达雷妥尤单抗+维奈克拉+化疗)→ASCT及维持治疗→疗效随访。
3.1 患者临床特征与初始治疗及复发情况
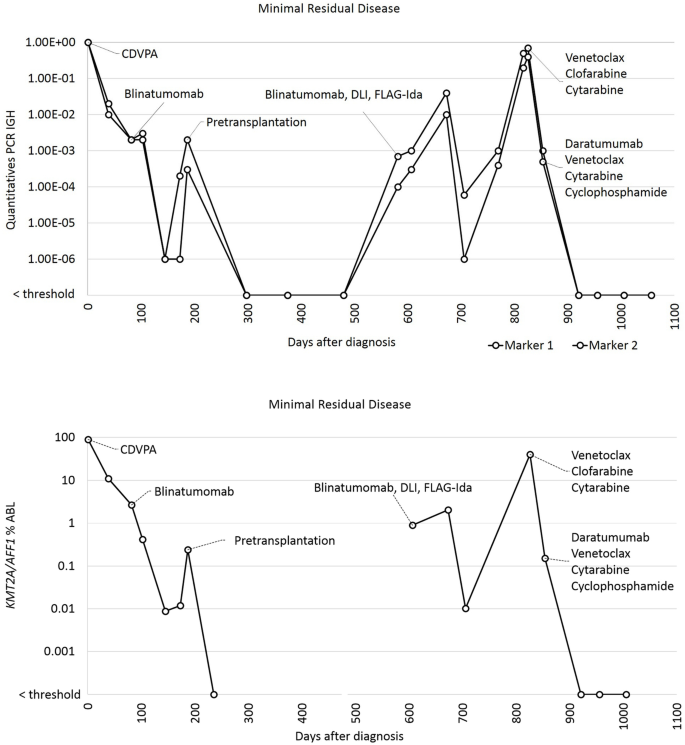
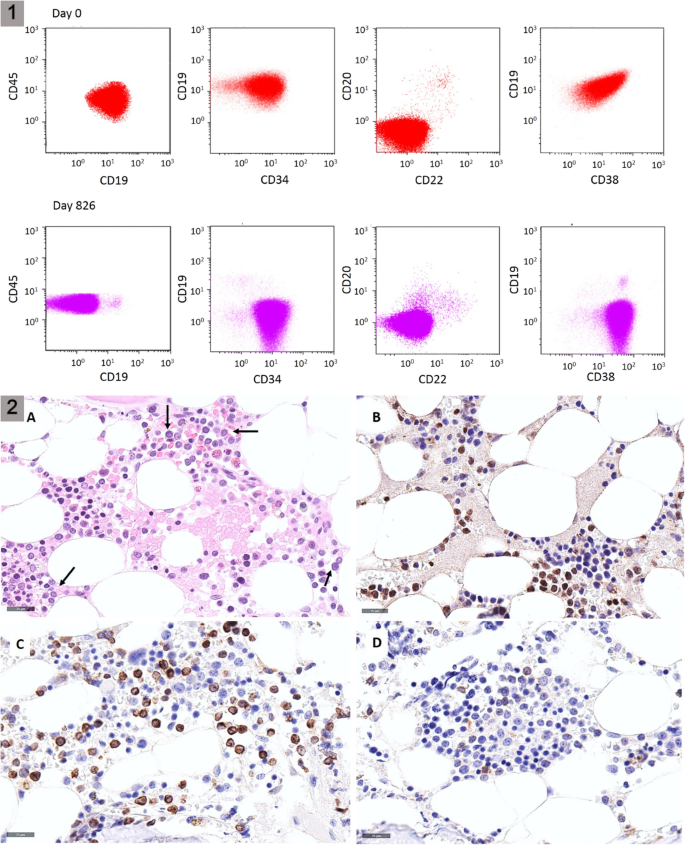
实验目的:明确患者的疾病分型、分子特征及初始治疗后的复发模式,为后续治疗方案选择提供依据。方法细节:对26岁男性R/R B-ALL患者进行血常规、骨髓形态学、流式细胞术免疫表型分析、染色体核型分析、聚合酶链反应(PCR)及荧光原位杂交(FISH)检测分子异常;初始采用GRAALL-2005诱导方案治疗,后续给予高剂量阿糖胞苷+甲氨蝶呤巩固治疗,blinatumomab桥接ASCT,移植后定期监测MRD。结果解读:患者初诊为pro-B ALL,免疫表型为CD34、HLA-DR、CD19、CD38、末端脱氧核苷酸转移酶(TdT)、BCL-2阳性,CD10、CD123阴性,伴KMT2A-AFF1融合基因;初始诱导治疗后获得形态学完全缓解,但MRD持续阳性;巩固治疗及blinatumomab桥接治疗后MRD仍未转阴,ASCT后1年出现复发,复发时免疫表型转为CD19、CD20、CD22阴性,CD38、BCL-2仍高表达,提示blinatumomab治疗后出现CD19靶点丢失导致耐药。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞术检测试剂盒、PCR检测试剂盒、FISH探针类试剂。
3.2 维奈克拉联合化疗的首次挽救治疗
实验目的:评估BCL-2抑制剂维奈克拉联合化疗在伴KMT2A-AFF1融合的CD19阴性R/R B-ALL患者中的疗效。方法细节:给予患者氯法拉滨(20mg/m²/d,d1-5)+阿糖胞苷(1000mg/m²/d,d1-5)联合维奈克拉(400mg/d,d1-13)治疗,治疗后28天评估骨髓形态学及MRD。结果解读:治疗后患者获得形态学完全缓解,但MRD仍阳性(IGH:10⁻³;KMT2A-AFF1:0.15%),提示维奈克拉联合化疗可清除大部分白血病细胞,但难以达到深度分子缓解。产品关联:文献未提及具体实验产品,领域常规使用BCL-2抑制剂、嘌呤类似物类化疗药物。
3.3 达雷妥尤单抗联合维奈克拉及化疗的二次挽救治疗
实验目的:通过联合CD38单抗与BCL-2抑制剂及化疗,进一步清除MRD,达到适合ASCT的分子缓解。方法细节:给予患者环磷酰胺(150mg/m²,bid,d1-3)+氯法拉滨(20mg/m²,d1-5)联合维奈克拉(100mg,d3-7)+达雷妥尤单抗(16mg/kg,d2、d10)治疗,治疗后监测造血重建及MRD。结果解读:治疗后出现43天的粒细胞缺乏症,随后造血完全重建,且达到分子完全缓解(MRD检测敏感性:ABL<0.003%,IGH重排<10⁻⁴或10⁻⁵),提示该联合方案能有效清除残留白血病细胞。产品关联:文献未提及具体实验产品,领域常规使用抗CD38单克隆抗体、烷化剂类化疗药物。
3.4 二次异基因造血干细胞移植及维持治疗
实验目的:通过ASCT巩固疗效,维持治疗预防复发。方法细节:患者在分子缓解后接受匹配无关供体的二次ASCT,移植后给予维奈克拉维持治疗,定期监测MRD及供体嵌合率。结果解读:移植后12个月,患者仍处于分子完全缓解状态,供体嵌合率为完全嵌合,提示联合治疗为ASCT创造了条件,维持治疗可持续控制残留病灶。产品关联:文献未提及具体实验产品,领域常规使用异基因造血干细胞移植相关试剂、靶向药物维持治疗制剂。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括分子Biomarker KMT2A-AFF1融合基因,治疗靶点Biomarker CD38、BCL-2,其筛选与验证逻辑为:基于患者临床样本,通过分子生物学技术(PCR、FISH)检测KMT2A-AFF1融合基因,通过流式细胞术、免疫组化(IHC)检测CD38、BCL-2的表达,进而评估这些Biomarker与治疗疗效的关联。
Biomarker定位:KMT2A-AFF1融合基因为预后Biomarker,提示患者为极高危B-ALL,复发风险高;CD38、BCL-2为治疗靶点Biomarker,其高表达为达雷妥尤单抗、维奈克拉的治疗提供了依据。研究过程详述:KMT2A-AFF1融合基因来自患者骨髓样本,通过定量PCR检测其转录本水平,FISH验证融合存在;CD38表达通过流式细胞术检测白血病细胞表面的阳性率,BCL-2表达通过骨髓活检的免疫组化染色评估;治疗后通过定量PCR监测KMT2A-AFF1及IGH重排的MRD水平,评估Biomarker的动态变化与疗效的关联。特异性与敏感性数据:KMT2A-AFF1融合基因的PCR检测敏感性可达10⁻⁵,CD38流式检测阳性率为100%(复发时),BCL-2免疫组化染色阳性率为100%;治疗后MRD转阴,提示该联合方案对表达CD38、BCL-2的KMT2A-AFF1阳性R/R B-ALL患者具有较高的疗效敏感性。核心成果提炼:本研究首次证实CD38联合BCL-2靶点的治疗方案在CD19、CD20、CD22阴性伴KMT2A-AFF1融合的R/R B-ALL患者中可获得持续分子缓解,KMT2A-AFF1融合基因可作为该类患者的预后预测Biomarker,CD38、BCL-2可作为该类患者的治疗靶点Biomarker;患者在接受联合治疗后MRD转阴,移植后12个月仍维持分子缓解,无复发迹象,提示该方案具有良好的临床应用前景(样本量n=1,P值未统计)。
