1. 领域背景与文献引入
文献英文标题:Multiple Fra-1-bound enhancers showing different molecular and functional features can cooperate to repress gene transcription;发表期刊:Cell & Bioscience;影响因子:未公开;研究领域:肿瘤分子生物学(三阴性乳腺癌转录调控)
AP-1转录复合物是调控细胞增殖、分化及恶性转化的关键转录调控体系,其中Fra-1(由FOSL1基因编码)作为AP-1的核心组分,在三阴性乳腺癌(TNBC)等恶性肿瘤中呈高表达状态,通过调控靶基因表达参与肿瘤侵袭、转移、上皮间质转化等恶性表型的形成。目前生命科学领域对转录因子激活基因表达的分子机制研究较为充分,但转录因子结合多个远程增强子抑制基因表达的具体机制仍存在诸多空白,尤其是同一转录因子在调控同一基因的不同增强子上的分子效应是否存在异质性这一核心问题尚未得到解答。现有研究表明Fra-1可调控超过1000个靶基因的表达,但其抑制基因转录的机制研究仅局限于少数启动子近端结合位点,对其通过远程增强子抑制基因表达的机制及增强子的异质性功能缺乏系统解析。本研究以Fra-1抑制TGFB2基因表达为模型,针对上述空白展开深入探究,为理解转录因子的多增强子协同抑制机制提供了新的实验依据与理论框架。
2. 文献综述解析
作者对领域内现有研究的分类维度主要围绕转录调控的两个核心方向展开:一是转录因子对基因表达的调控效应(激活作用vs抑制作用),二是转录因子结合位点的基因组定位(启动子近端区域vs远程增强子区域)。现有研究显示,Fra-1在肿瘤中主要发挥促癌功能,通过激活PLAU、HMGA1等靶基因的转录,促进肿瘤细胞的侵袭、转移及上皮间质转化;基因组学研究证实Fra-1的结合位点绝大多数位于远离基因转录起始位点的远程增强子区域,提示染色质三维结构在Fra-1的转录调控中发挥关键作用。但现有研究存在明显局限性:一方面,对Fra-1抑制基因转录的机制研究极为匮乏,尚未涉及同一基因的多个Fra-1结合增强子的功能异质性;另一方面,未阐明同一转录因子在不同增强子上的分子效应差异及其协同调控基因表达的机制。本研究的创新价值在于,首次以Fra-1抑制TGFB2基因为研究模型,系统解析了12个Fra-1结合增强子的分子与功能异质性,揭示了这些增强子通过不同机制协同抑制基因转录的过程,同时阐明了Fra-1不影响RNA聚合酶II的招募,而是通过减少其转录起始形式的形成来抑制基因表达,填补了转录因子多增强子协同抑制机制研究的空白。
3. 研究思路总结与详细解析
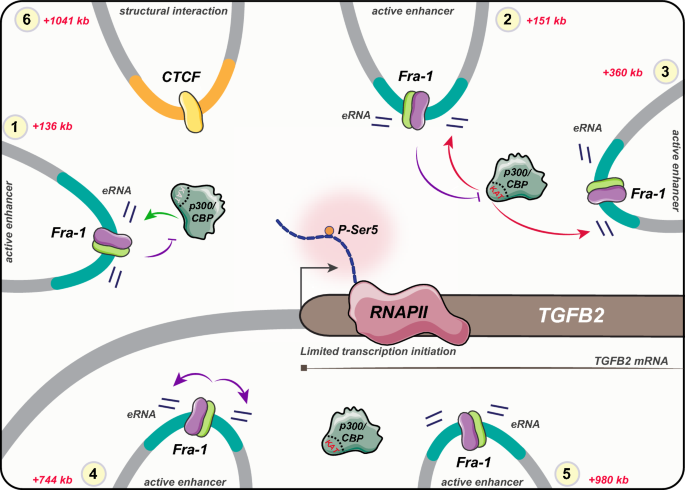
本研究的整体研究目标为解析Fra-1结合多个远程增强子抑制TGFB2基因转录的分子机制,核心科学问题是明确Fra-1在不同增强子上的分子效应是否存在异质性,以及这些异质性增强子如何协同调控基因转录;技术路线遵循“假设验证-机制解析-异质性分析”的闭环逻辑:首先验证Fra-1对TGFB2的转录抑制作用,接着鉴定TGFB2启动子结合的增强子并分析其分子特征,随后解析Fra-1对增强子活性的调控机制,最后探讨p300/CBP在不同增强子中的功能差异。
3.1 Fra-1对TGFB2的转录抑制作用验证
实验目的:明确Fra-1是否通过转录水平调控TGFB2基因表达。
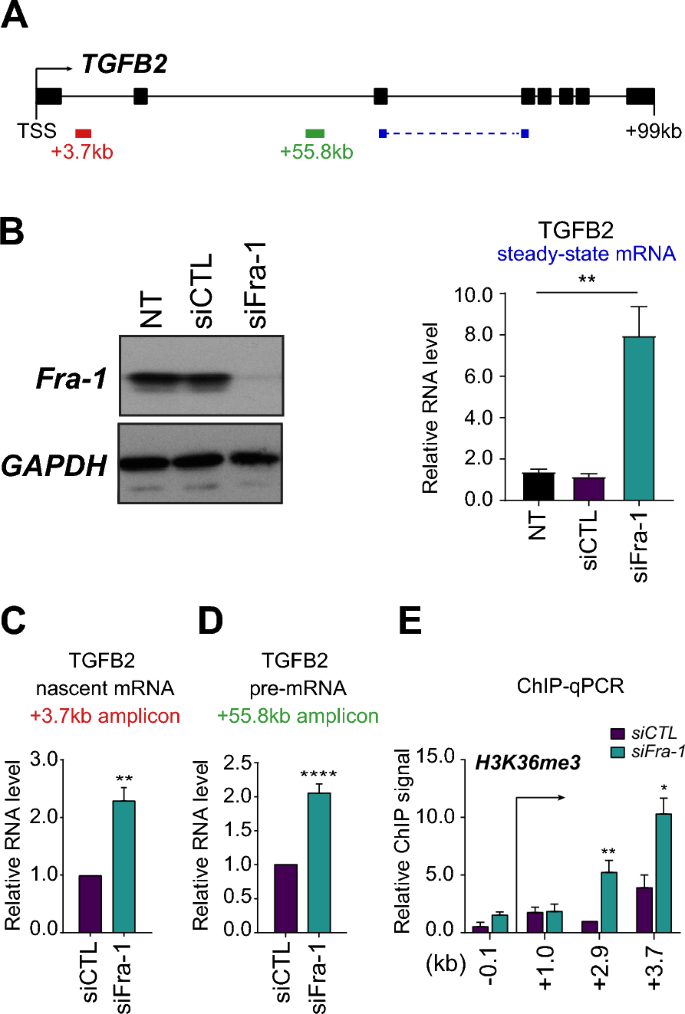
方法细节:在MDA-MB-231三阴性乳腺癌细胞中,采用siRNA干扰技术敲低Fra-1表达,设置阴性对照siCTL;通过免疫印迹验证Fra-1的敲低效率,采用实时荧光定量PCR(RT-qPCR)检测TGFB2 mRNA水平,通过run-on实验检测新生RNA合成水平,通过RT-qPCR检测TGFB2前体mRNA水平,通过染色质免疫沉淀(ChIP-qPCR)检测TGFB2基因体上H3K36me3修饰水平(该修饰与转录延伸正相关)。
结果解读:免疫印迹结果显示Fra-1敲低效率显著;RT-qPCR结果显示,敲低Fra-1后TGFB2 mRNA水平升高约6倍(n=4,P<0.01);run-on实验显示新生RNA水平升高2-2.5倍(n=3,P<0.05);前体mRNA水平升高约2倍(n=7,P<0.01);ChIP-qPCR结果显示TGFB2基因体上H3K36me3修饰水平显著增加(n=5,P<0.05),上述结果共同证实Fra-1在转录水平抑制TGFB2基因表达。
产品关联:文献未提及具体实验产品,领域常规使用siRNA转染试剂、免疫印迹抗体、RT-qPCR试剂盒、ChIP实验试剂盒等试剂/仪器。
3.2 Fra-1对RNA聚合酶II的调控作用分析
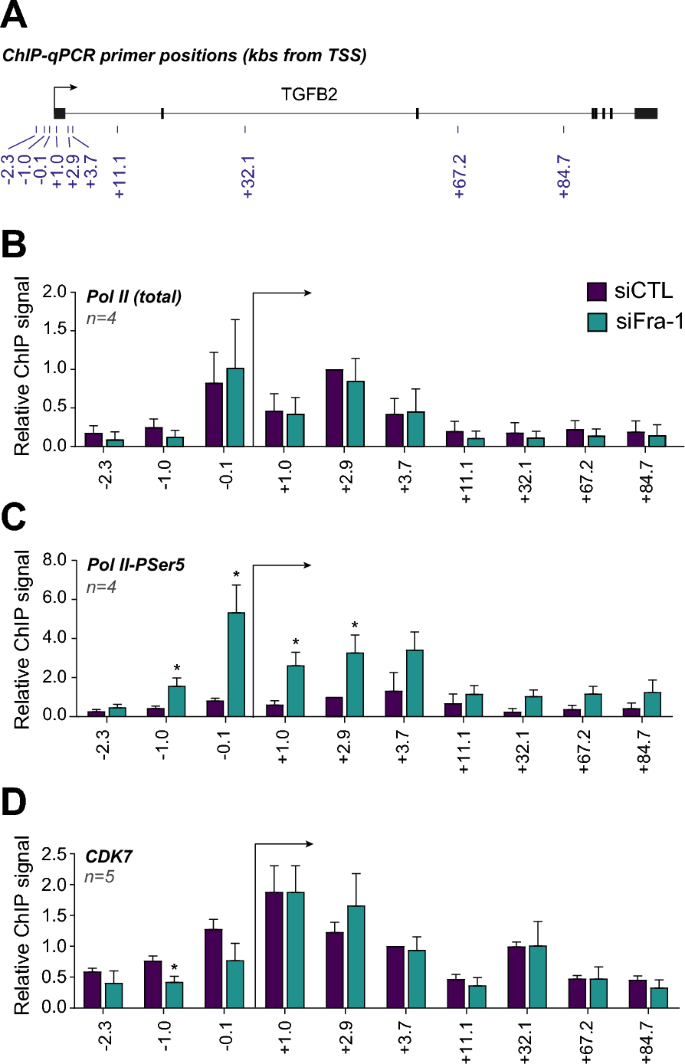
实验目的:解析Fra-1抑制TGFB2转录的具体分子环节。
方法细节:在Fra-1敲低及对照细胞中,通过ChIP-qPCR检测总RNA聚合酶II(Pol II)、磷酸化Ser5的Pol II(转录起始形式)及CDK7(Pol II Ser5磷酸化激酶)在TGFB2启动子及基因体上的招募水平,以管家基因RPS26作为内参对照。
结果解读:ChIP-qPCR结果显示,敲低Fra-1后总Pol II在TGFB2启动子及基因体上的招募水平无显著变化,但磷酸化Ser5的Pol II水平在启动子及基因起始区域显著升高(n=4,P<0.01);CDK7的招募水平无显著变化,表明Fra-1通过减少Pol II转录起始形式的形成来抑制TGFB2转录,而非影响Pol II的招募。
产品关联:文献未提及具体实验产品,领域常规使用Pol II、磷酸化Pol II及CDK7特异性抗体、ChIP-qPCR引物等试剂/仪器。
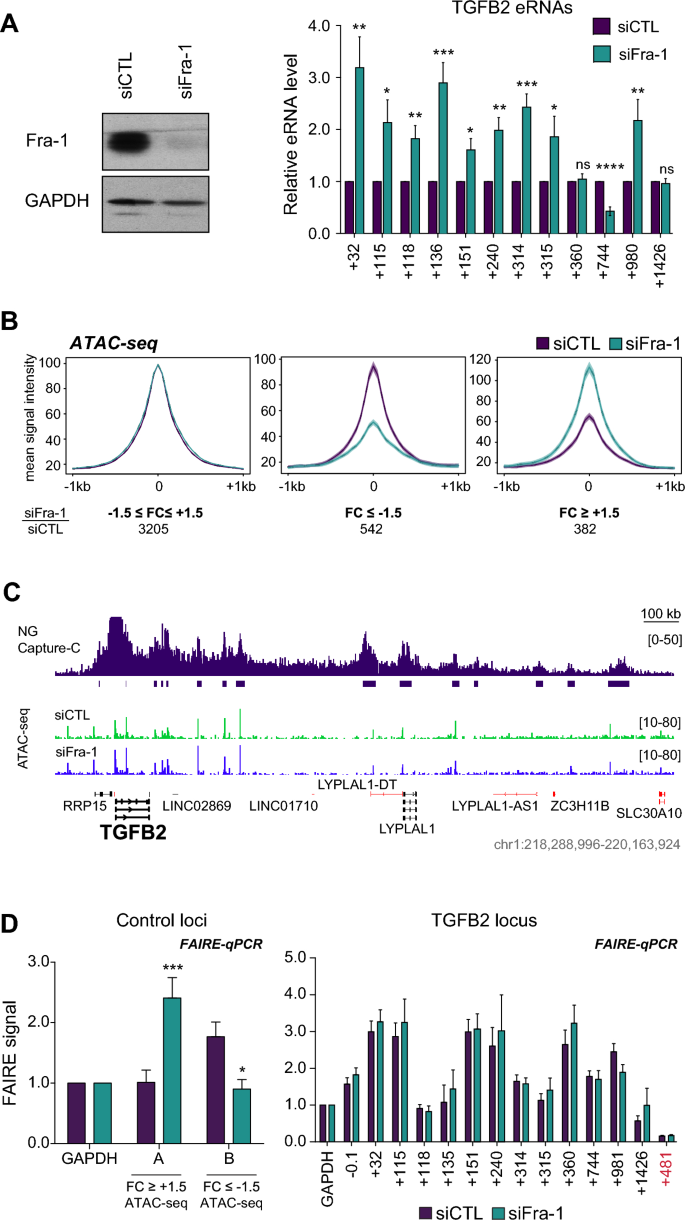
3.3 TGFB2启动子结合增强子的鉴定与特征分析
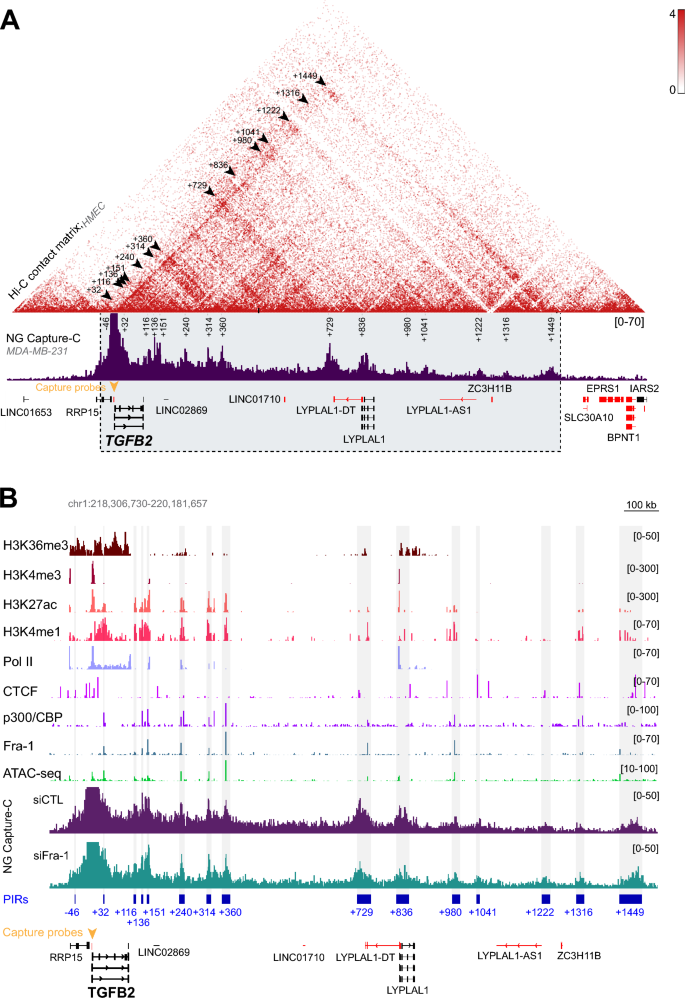
实验目的:鉴定与TGFB2启动子相互作用的增强子区域,并分析其分子特征及异质性。
方法细节:采用NG Capture-C技术鉴定TGFB2启动子的相互作用区域(PIRs),结合已发表的ChIP-seq数据(Fra-1、p300/CBP、组蛋白修饰H3K4me1、H3K27ac等)及ATAC-seq数据,分析这些区域的分子特征;通过对比Fra-1敲低前后的NG Capture-C数据,检测启动子与增强子的相互作用频率变化。
结果解读:共鉴定出15个与TGFB2启动子相互作用的PIRs,其中12个为Fra-1结合的增强子区域,这些增强子均位于同一拓扑关联结构域(TAD)内;分子特征分析显示,不同增强子在Fra-1结合水平、p300/CBP招募水平、组蛋白修饰水平及染色质可及性上存在显著异质性;NG Capture-C数据显示Fra-1敲低后,启动子与增强子的相互作用频率无显著变化,表明Fra-1不通过调控染色质三维结构来抑制转录。
产品关联:文献未提及具体实验产品,领域常规使用NG Capture-C建库试剂盒、高通量测序平台、基因组学数据分析软件等试剂/仪器。
3.4 Fra-1对增强子RNA及染色质可及性的调控
实验目的:明确Fra-1对增强子活性的调控效应及机制。
方法细节:通过RT-qPCR检测Fra-1敲低前后12个Fra-1结合增强子的增强子RNA(eRNA)水平(eRNA水平与增强子活性正相关);通过ATAC-seq及FAIRE-qPCR检测Fra-1敲低前后增强子区域的染色质可及性变化,设置阴性对照区域及管家基因启动子作为内参。
结果解读:RT-qPCR结果显示,敲低Fra-1后,9个增强子的eRNA水平升高约2倍(n=7,P<0.01),1个增强子的eRNA水平降低,2个增强子的eRNA水平无显著变化;ATAC-seq及FAIRE-qPCR结果显示,Fra-1敲低后所有增强子区域的染色质可及性无显著变化,表明Fra-1通过调控增强子的转录活性而非染色质可及性来影响其功能。
产品关联:文献未提及具体实验产品,领域常规使用RT-qPCR试剂盒、ATAC-seq建库试剂盒、FAIRE实验试剂等试剂/仪器。
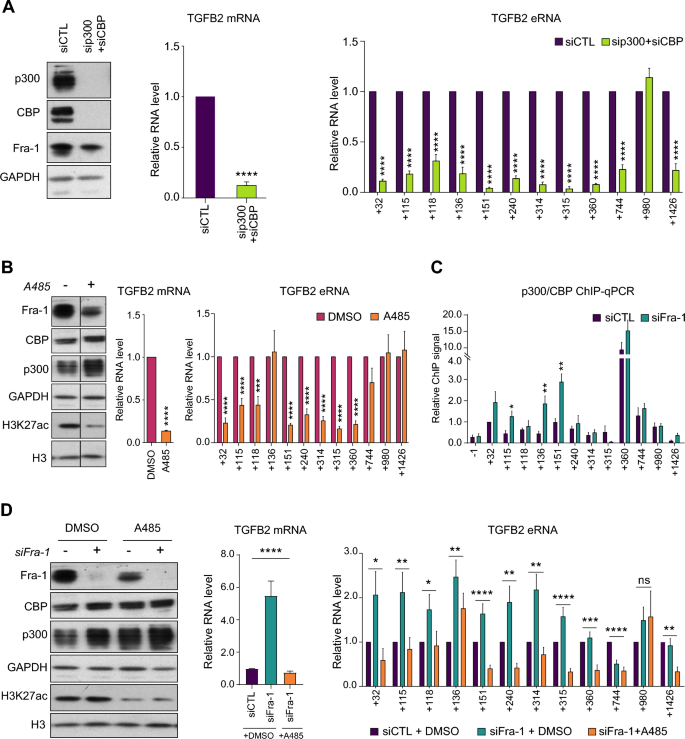
3.5 p300/CBP在Fra-1调控增强子活性中的异质性作用
实验目的:探讨p300/CBP(赖氨酸乙酰转移酶)在Fra-1调控增强子活性中的功能及异质性。
方法细节:采用siRNA同时敲低p300和CBP,或使用p300/CBP酶活性特异性抑制剂A485处理细胞;通过RT-qPCR检测TGFB2 mRNA及eRNA水平,通过ChIP-qPCR检测Fra-1敲低前后p300/CBP在增强子区域的招募水平。
结果解读:敲低p300/CBP后,TGFB2 mRNA水平降低80%(n=4,P<0.001),11个增强子的eRNA水平显著降低;使用A485处理后,8个增强子的eRNA水平显著降低,3个增强子的eRNA水平无变化;ChIP-qPCR结果显示,敲低Fra-1后,3个增强子区域的p300/CBP招募水平显著升高,表明不同增强子对p300/CBP的依赖存在异质性:部分增强子依赖p300/CBP的存在,部分依赖其乙酰转移酶活性,部分则不依赖;Fra-1通过差异调控p300/CBP的招募或酶活性来调控不同增强子的功能。
产品关联:文献未提及具体实验产品,领域常规使用p300/CBP抗体、A485抑制剂、siRNA转染试剂等试剂/仪器。
4. Biomarker研究及发现成果
本研究聚焦于转录调控层面的功能性Biomarker,核心为12个Fra-1结合的TGFB2增强子及其相关调控因子。Biomarker定位:这些增强子属于转录调控类功能性Biomarker,筛选与验证逻辑为:首先通过NG Capture-C技术鉴定TGFB2启动子的相互作用区域,再结合ChIP-seq数据筛选Fra-1结合的区域,最后通过ATAC-seq(染色质可及性)及eRNA检测验证其增强子活性,形成“三维互作鉴定-转录因子结合验证-功能活性确认”的完整验证链条。
研究过程详述:这些增强子来源于MDA-MB-231三阴性乳腺癌细胞的基因组DNA,通过ChIP-seq实验验证Fra-1的特异性结合(所有增强子区域均存在AP-1结合基序),通过RT-qPCR检测eRNA水平确认其转录活性;特异性与敏感性分析显示,不同增强子对p300/CBP的依赖存在显著差异:11个增强子的活性依赖p300/CBP的存在,其中8个同时依赖其乙酰转移酶活性,1个增强子的活性不依赖p300/CBP;Fra-1对不同增强子的调控效应也存在异质性:9个增强子的活性被Fra-1抑制,1个被Fra-1激活,2个不受Fra-1调控。
核心成果提炼:本研究首次揭示了同一转录因子结合的多个增强子具有显著的分子与功能异质性,这些增强子通过协同作用抑制TGFB2基因转录;明确了Fra-1抑制基因转录的新机制:不影响RNA聚合酶II的招募,而是通过减少其转录起始形式的形成来抑制转录;同时发现TGFB2的最终转录输出依赖于Fra-1在不同增强子上的正负调控效应的平衡。该成果为理解AP-1转录复合物的抑制性调控机制提供了新的视角,也为三阴性乳腺癌的转录靶向治疗提供了潜在的新型靶点方向。