1. 领域背景与文献引入
文献英文标题:Advances in engineered T cell immunotherapy for autoimmune and other non-oncological diseases;发表期刊:Biomarker Research;影响因子:未公开;研究领域:工程化T细胞免疫治疗在非肿瘤疾病(自身免疫病、感染、纤维化、衰老等)中的应用
领域共识:嵌合抗原受体T细胞(CAR-T)治疗自2017年FDA批准首款产品用于血液肿瘤以来,已成为肿瘤免疫治疗的突破性技术,其核心优势在于无需主要组织相容性复合体(MHC)递呈即可特异性识别靶抗原。随着研究深入,CAR-T及其他工程化T细胞(如CAR调节性T细胞,CAR-Treg)的应用逐渐拓展至非肿瘤领域,包括自身免疫病、感染性疾病、纤维化、衰老相关疾病等。当前领域发展关键节点包括2021年首个CAR-T用于自身免疫病的临床研究成果发表(系统性红斑狼疮治疗)、2020年首次报道CAR-T用于衰老相关疾病的研究;研究热点方向为优化CAR结构以增强特异性与安全性、开发CAR-Treg用于免疫稳态调控、针对难治性感染与纤维化的工程化T细胞治疗;未解决的核心问题包括非肿瘤领域CAR治疗的长期安全性(如继发性肿瘤、免疫重建异常)、靶点特异性不足导致的脱靶效应、治疗成本高昂与可及性低、临床转化数据有限等。
针对上述领域现状,本综述通过系统检索PubMed与Web of Science的相关研究,全面梳理了工程化T细胞在非肿瘤领域的应用进展、CAR结构演化、各类疾病的治疗策略及当前挑战,旨在为该领域的后续研究与临床转化提供综合参考,填补了非肿瘤领域工程化T细胞治疗综述的全面性空白。
2. 文献综述解析
本综述以疾病类型为核心分类维度,系统整合了工程化T细胞在自身免疫病、感染、纤维化、血友病、衰老、移植排斥六大非肿瘤领域的研究成果,通过对比不同疾病的病理机制与治疗需求,明确了各类工程化T细胞的应用场景与优势局限。
现有研究中,自身免疫病领域主要分为两类策略:一是利用CAR-T清除自身反应性免疫细胞(如靶向CD19、BCMA清除异常B细胞),临床前动物实验与小样本临床研究显示可显著降低自身抗体水平、缓解疾病症状,但存在无法清除CD19阴性浆细胞的局限性;二是利用CAR-Treg发挥免疫抑制作用,临床前研究显示可抑制自身反应性T细胞活化,但在炎症环境中的稳定性与疗效仍需验证。感染性疾病领域聚焦于靶向病原体抗原(如HIV的gp120、HBV的HBsAg),CAR-T可特异性清除感染细胞,但面临病原体突变导致的抗原逃逸、正常组织损伤(如HBV治疗中的肝毒性)等问题。纤维化与衰老领域靶向活化成纤维细胞或衰老细胞表面的特异性抗原(如FAP、uPAR),临床前研究显示可逆转纤维化与衰老相关病理,但临床数据尚未见报道。技术方法优势在于CAR的特异性识别能力,可通过基因工程改造增强T细胞的增殖、存活与功能;局限性包括临床研究样本量小、长期安全性数据缺失、生产工艺复杂导致成本高昂。
与现有综述多聚焦于单一疾病领域不同,本研究全面覆盖了六大非肿瘤领域的工程化T细胞治疗进展,系统总结了CAR结构从一代到五代的演化逻辑及各类工程化T细胞(CAR-T、CAR-Treg、CAR-NK等)的特点,同时深入分析了非肿瘤领域CAR治疗的独特挑战(如靶细胞为正常免疫细胞导致的免疫重建风险),为该领域的研究方向提供了更全面的指导。
3. 研究思路总结与详细解析
本研究的整体思路为:首先概述CAR的基本结构与工程化T细胞的类型演化,明确不同代际CAR的功能特点;随后按疾病领域分别阐述工程化T细胞的应用研究现状,包括临床前实验与临床研究数据;最后系统分析当前非肿瘤领域工程化T细胞治疗面临的挑战,并提出未来研究方向。
3.1 CAR结构与工程化T细胞类型概述
实验目的:明确CAR的核心结构组成及工程化T细胞的类型与演化逻辑,为后续疾病领域的应用研究奠定基础。
方法细节:通过梳理领域内经典研究,总结CAR的三大核心结构(胞外抗原结合域、跨膜域、胞内信号域),以及从一代到五代CAR的演化过程,同时分类介绍CAR-T、CAR-Treg、CAR-NK、CAR巨噬细胞等不同工程化细胞类型的特点。
结果解读:一代CAR仅包含CD3ζ信号域,T细胞活化信号弱、体内存活时间短;二代CAR加入一个共刺激域(如4-1BB或CD28),增强T细胞活化与增殖;三代CAR加入两个共刺激域,但疗效未显著优于二代;四代CAR加入免疫调节因子(如IL-12),可调控免疫微环境;五代CAR为通用型CAR,可实现现货供应,但面临移植物抗宿主病(GvHD)风险。CAR-Treg可通过免疫抑制维持免疫稳态,CAR-NK具有更强的细胞杀伤能力但体内存活时间短,CAR巨噬细胞可吞噬靶细胞并调控微环境。
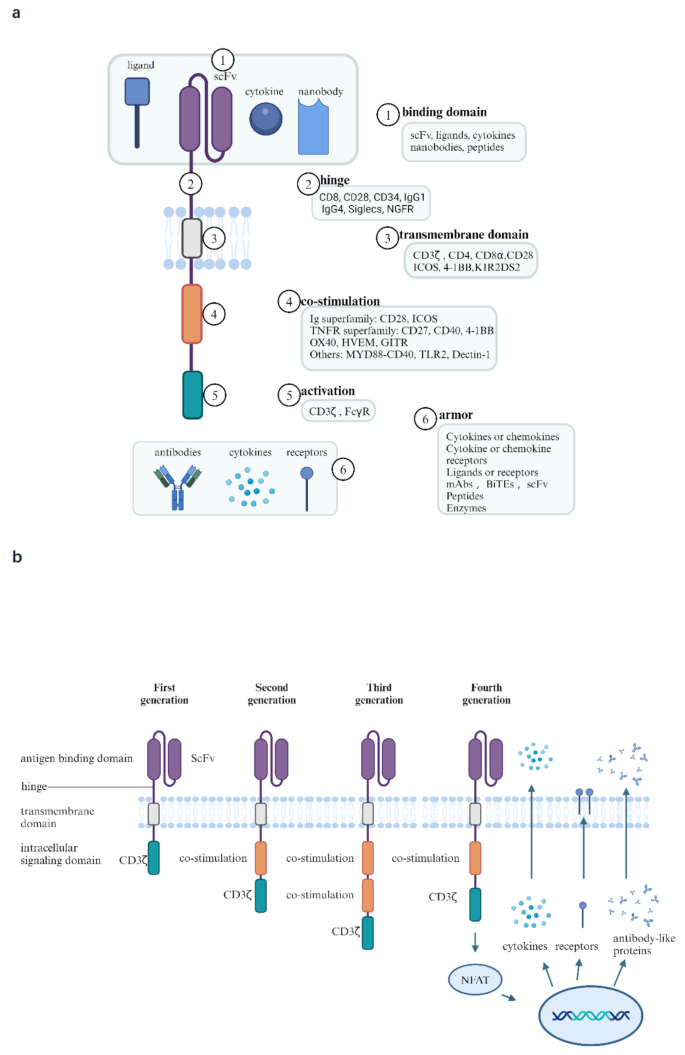
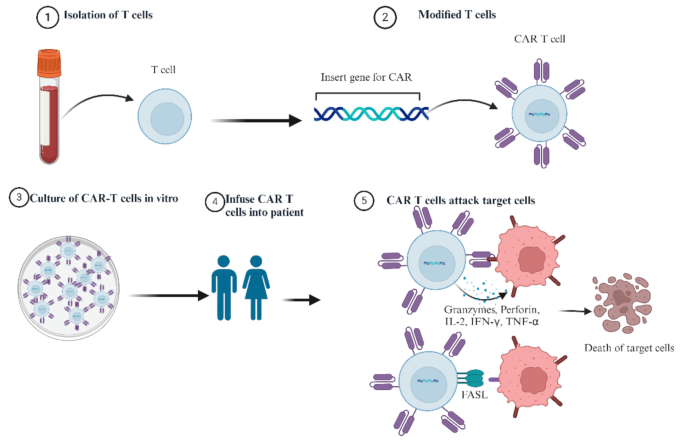
产品关联:文献未提及具体实验产品,领域常规使用慢病毒/逆转录病毒载体、CRISPR-Cas9基因编辑系统、流式细胞分析仪、酶联免疫吸附试验(ELISA)试剂盒等。
3.2 自身免疫病中的工程化T细胞应用研究
实验目的:系统总结工程化T细胞在各类自身免疫病中的应用现状与疗效数据。
方法细节:检索并整理自身免疫病领域的临床前动物实验与临床研究,包括系统性红斑狼疮(SLE)、类风湿关节炎(RA)、多发性硬化(MS)、重症肌无力(MG)等疾病的相关研究。
结果解读:在SLE中,抗CD19 CAR-T治疗可使难治性患者的双链DNA自身抗体水平恢复正常、狼疮疾病活动指数(SLEDAI)从16降至0(n=1,文献未明确P值),双靶点CD19/BCMA CAR-T可同时清除B细胞与浆细胞,12例患者均实现低疾病活动度(文献未明确P值);在MG中,抗BCMA CAR-T治疗14例患者均实现临床改善,B细胞重建以初始表型为主(n=14,文献未明确P值);在MS中,抗CD19 CAR-T可降低鞘内抗体产生,CAR-Treg可抑制自身反应性T细胞活化,缓解实验性自身免疫性脑脊髓炎(EAE)症状。
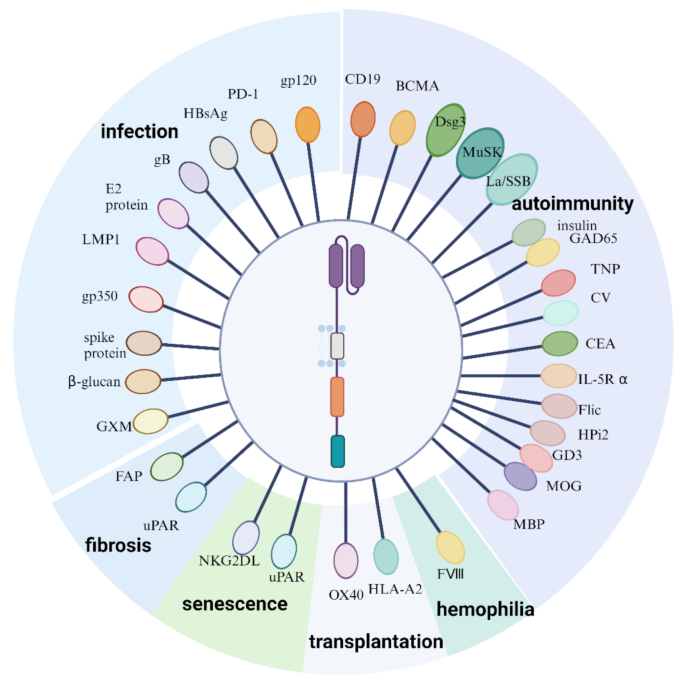
产品关联:文献未提及具体实验产品,领域常规使用抗CD19、抗BCMA CAR载体,小鼠疾病模型(如狼疮小鼠、EAE小鼠)等。
3.3 感染性疾病中的工程化T细胞应用研究
实验目的:梳理工程化T细胞在病毒、真菌等感染性疾病中的应用进展。
方法细节:检索并整理HIV、HBV、HCV、真菌等感染性疾病的工程化T细胞研究,包括临床前与临床研究数据。
结果解读:在HIV感染中,CD4 CAR-T治疗可降低直肠组织HIV RNA水平,但血浆HIV RNA水平无显著变化(n=24,文献未明确P值),靶向PD-1的CAR-T可清除SIV感染的CD4+T细胞;在HBV感染中,抗HBsAg CAR-T可特异性清除感染肝细胞,但存在肝毒性风险,加入安全开关(如caspase 9)可降低不良反应;在真菌感染中,靶向真菌细胞壁抗原的CAR-T可抑制真菌生长,但抗原靶点的特异性仍需验证。
产品关联:文献未提及具体实验产品,领域常规使用靶向病原体抗原的CAR载体、感染细胞模型、动物感染模型等。
3.4 纤维化与衰老相关疾病中的工程化T细胞应用研究
实验目的:总结工程化T细胞在纤维化与衰老疾病中的治疗策略与临床前数据。
方法细节:检索并整理心脏纤维化、肝纤维化、衰老相关疾病的工程化T细胞研究。
结果解读:在心脏纤维化中,靶向FAP的CAR-T可显著减少心肌纤维化、恢复心脏功能(小鼠模型,文献未明确样本量与P值);在肝纤维化中,靶向uPAR的CAR-T与CAR巨噬细胞可降低纤维化程度、恢复肝功能(小鼠模型,文献未明确样本量与P值);在衰老相关疾病中,靶向uPAR或NKG2DLs的CAR-T可清除衰老细胞,改善代谢功能与运动能力(小鼠与非人灵长类模型,文献未明确样本量与P值)。
产品关联:文献未提及具体实验产品,领域常规使用靶向FAP、uPAR的CAR载体,纤维化与衰老动物模型等。
3.5 其他非肿瘤疾病中的工程化T细胞应用研究
实验目的:梳理工程化T细胞在血友病、移植排斥等疾病中的应用进展。
方法细节:检索并整理血友病、GvHD等疾病的工程化T细胞研究。
结果解读:在血友病A中,FVIII特异性CAR-Treg可抑制抗FVIII抗体产生,预防免疫耐受破坏(小鼠模型,文献未明确样本量与P值);在GvHD中,靶向OX40的CAR-T可清除活化的T细胞,CAR-Treg可诱导免疫耐受,延长移植物存活时间(小鼠模型,文献未明确样本量与P值)。
产品关联:文献未提及具体实验产品,领域常规使用靶向凝血因子或免疫细胞抗原的CAR载体,血友病与移植模型等。
4. Biomarker研究及发现成果
本研究涉及的Biomarker主要为工程化T细胞的靶抗原,覆盖自身免疫病、感染、纤维化、衰老等领域,其筛选逻辑基于疾病病理机制中异常细胞或病原体的特异性表达抗原,通过临床前验证与临床研究逐步明确其治疗价值。
在自身免疫病中,核心Biomarker为CD19、BCMA(B细胞表面抗原)、Dsg3(天疱疮自身抗原)、MuSK(重症肌无力自身抗原),筛选逻辑为基于自身免疫病中B细胞或自身反应性免疫细胞的异常活化,选择特异性高表达的抗原作为CAR靶点,验证流程为临床前动物实验→小样本临床研究;在感染性疾病中,核心Biomarker为HIV gp120、HBV HBsAg、HCV E2、真菌细胞壁抗原,筛选逻辑为基于病原体的特异性结构蛋白,选择在感染细胞表面高表达的抗原,验证流程为体外细胞实验→动物感染模型→小样本临床研究;在纤维化与衰老中,核心Biomarker为FAP(活化成纤维细胞抗原)、uPAR(活化成纤维细胞与衰老细胞抗原)、NKG2DLs(衰老细胞抗原),筛选逻辑为基于纤维化与衰老过程中异常细胞的特异性表达抗原,验证流程为体外细胞实验→动物模型。
研究过程中,以CD19为例,其来源为B细胞表面,验证方法包括流式细胞术检测B细胞清除率、ELISA检测自身抗体水平,在SLE临床研究中,抗CD19 CAR-T治疗后患者B细胞完全清除,自身抗体水平降至正常(n=1,文献未明确P值);以BCMA为例,其来源为浆细胞与记忆B细胞表面,验证方法为流式细胞术检测浆细胞清除率、临床症状评分,在NMOSD临床研究中,12例患者接受抗BCMA CAR-T治疗后,11例无复发,血清AQP4抗体水平显著下降(n=12,文献未明确P值);以FAP为例,其来源为活化成纤维细胞表面,验证方法为免疫组化检测纤维化程度、心脏功能检测,在小鼠心脏纤维化模型中,靶向FAP的CAR-T治疗后纤维化面积减少约50%(文献未明确样本量与P值)。
核心成果方面,这些Biomarker作为CAR的识别靶点,为非肿瘤疾病的精准治疗提供了核心依据,例如CD19与BCMA已成为自身免疫病中CAR-T治疗的核心靶点,实现了难治性患者的疾病缓解;FAP与uPAR为纤维化的治疗提供了新方向,临床前研究显示可逆转病理损伤。创新性在于首次系统整合了非肿瘤领域的各类CAR靶点,明确了不同疾病中靶点选择的逻辑与依据,为新靶点的筛选提供了参考。部分Biomarker的临床疗效数据仍需大样本临床研究验证,长期安全性(如免疫重建异常、脱靶效应)需进一步监测。
