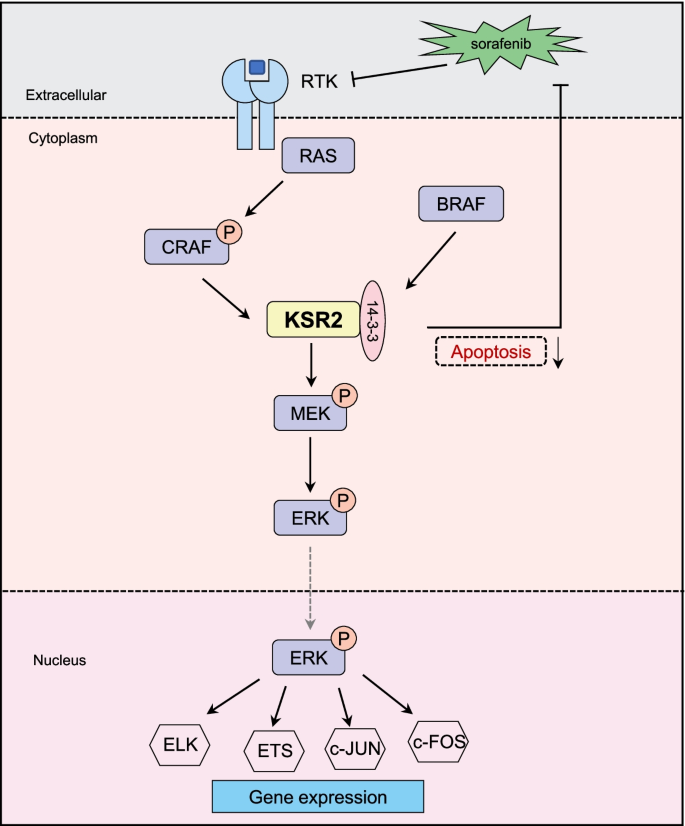
1. 领域背景与文献引入
文献英文标题:KSR2-14–3-3ζ complex serves as a biomarker and potential therapeutic target in sorafenib-resistant hepatocellular carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝细胞癌靶向治疗与耐药机制
肝细胞癌(肝癌)是全球第六大常见恶性肿瘤,也是第四大癌症相关死因,2020年全球新发病例约90.6万,死亡病例约83万。多数患者确诊时已处于晚期,失去手术根治机会,索拉非尼作为首个获FDA批准的晚期肝癌分子靶向药物,通过抑制MAPK通路及受体酪氨酸激酶发挥抗肿瘤作用,但超过70%的患者在治疗6-12个月后会出现获得性耐药,其具体机制尚未完全阐明,成为制约肝癌治疗效果的关键瓶颈。领域共识:MAPK通路的过度激活是肝癌发生发展的重要驱动因素,支架蛋白在调控通路活性中发挥关键作用,但KSR家族成员KSR2在肝癌中的功能及与耐药的关联尚未被系统研究,现有研究也未关注到KSR2与14-3-3ζ蛋白的相互作用对索拉非尼耐药的调控作用,因此本研究针对这一领域空白展开,旨在明确KSR2在肝癌中的功能及介导耐药的分子机制。
2. 文献综述解析
作者围绕MAPK通路调控、KSR家族蛋白功能及14-3-3家族蛋白在肿瘤中的作用三个维度展开综述,系统梳理了领域内现有研究的进展与不足。
现有研究表明,MAPK通路(Ras/Raf/MEK/ERK)的过度激活在肝癌等多种肿瘤的发生发展中起关键作用,支架蛋白通过招募通路组分调控信号传导的时空特异性与强度。KSR家族包括KSR1和KSR2两个成员,KSR1已被证实参与Ras信号调控及细胞增殖、分化过程,而KSR2虽与KSR1具有结构同源性,但其功能更多集中在能量代谢调控方面,在肿瘤中的作用尚未明确。14-3-3家族蛋白是一类高度保守的磷酸丝氨酸结合蛋白,其中14-3-3ζ在肝癌组织中高表达,参与肿瘤细胞增殖、侵袭等过程,但现有研究未揭示其与KSR2的相互作用及在耐药中的功能。本研究的创新价值在于,首次将KSR2与14-3-3ζ的相互作用与肝癌索拉非尼耐药关联起来,填补了KSR2在肿瘤领域功能研究的空白,同时为肝癌耐药机制提供了新的分子靶点。
3. 研究思路总结与详细解析
本研究整体遵循“表达验证→功能研究→机制解析→耐药关联”的逻辑框架,首先明确KSR2在肝癌中的表达及预后意义,随后通过细胞与动物实验验证其对肝癌恶性表型的调控作用,接着解析KSR2与14-3-3ζ的相互作用及对MAPK通路的调控机制,最后验证该复合物与索拉非尼耐药的关联,形成完整的科学研究闭环。
3.1 KSR2在肝癌组织及细胞系中的表达与预后验证
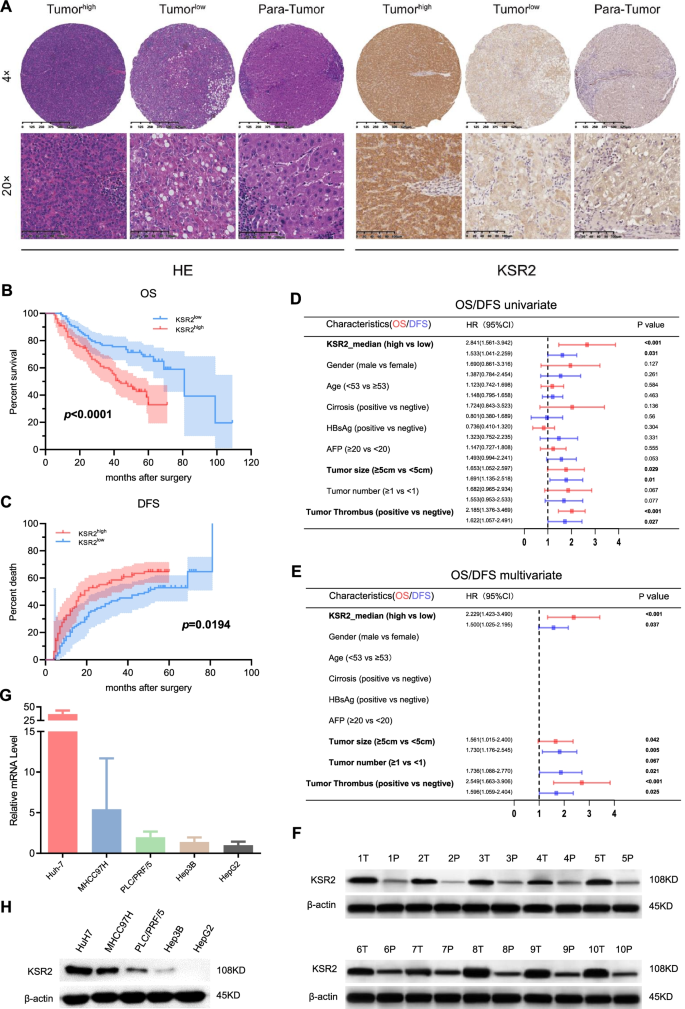
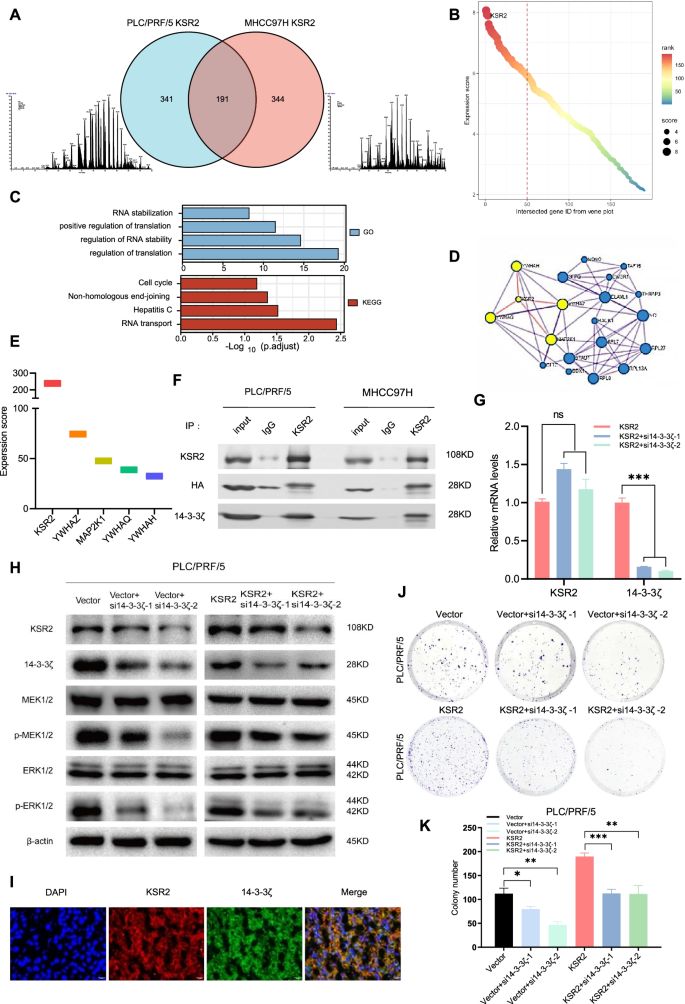
实验目的:明确KSR2在肝癌组织及细胞系中的表达水平,及其与肝癌患者临床预后的关联。方法细节:首先利用Human Protein Atlas、TCGA公共数据库分析KSR2在肿瘤中的表达及预后价值;随后采用包含198对肝癌及癌旁组织的组织芯片进行免疫组化(IHC)检测,结合qPCR、蛋白质免疫印迹(Western Blot)技术检测临床样本及5种肝癌细胞系(HuH7、PLC/PRF/5、MHCC97H、Hep3B、HepG2)的KSR2 mRNA及蛋白表达;最后通过Kaplan-Meier生存分析评估KSR2表达与患者总生存期(OS)、无病生存期(DFS)的关联。结果解读:公共数据库分析显示,KSR2在肝癌组织中高表达,且高表达与患者不良预后相关(TCGA数据库,P<0.05);组织芯片免疫组化结果显示,KSR2在肝癌组织中的阳性表达率显著高于癌旁组织(n=198,P<0.0001),高KSR2表达患者的OS(P<0.0001)和DFS(P=0.0194)均显著短于低表达患者;qPCR及蛋白质免疫印迹结果显示,5种肝癌细胞系中KSR2的mRNA及蛋白水平均呈中至高度上调。实验所用关键产品:抗KSR2抗体(Abnova,台湾,中国)、抗-β-actin抗体(CST,马萨诸塞州,美国)、组织芯片(复旦大学附属中山医院)。
3.2 KSR2对肝癌细胞恶性表型的调控作用验证
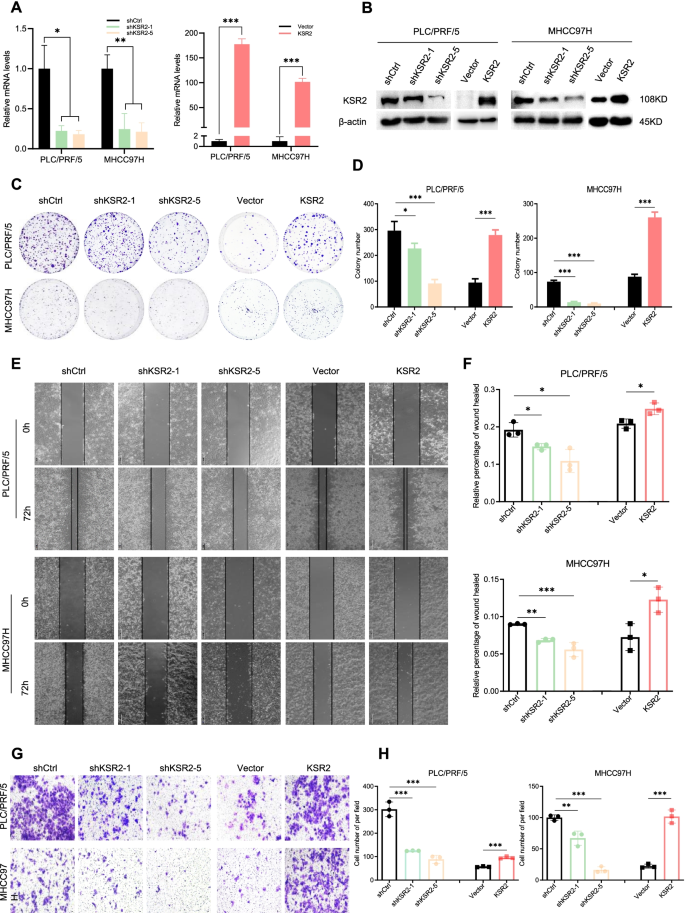
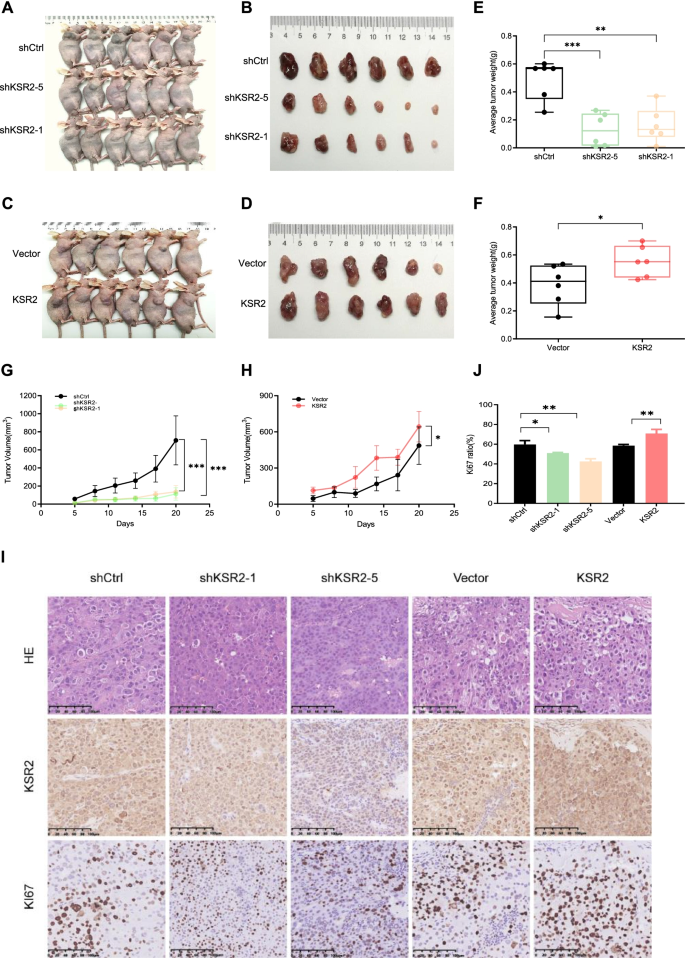
实验目的:明确KSR2对肝癌细胞增殖、迁移、侵袭能力的调控作用。方法细节:选取KSR2表达水平中等的PLC/PRF/5和MHCC97H细胞系,通过慢病毒载体介导KSR2的敲低与过表达,采用qPCR、蛋白质免疫印迹验证敲低与过表达效率;随后通过克隆形成实验检测细胞增殖能力,划痕实验检测细胞迁移能力,Transwell侵袭实验检测细胞侵袭能力;同时构建裸鼠异种移植模型,将KSR2敲低、过表达及对照细胞分别接种于裸鼠背部,监测肿瘤生长情况并评估成瘤能力。结果解读:KSR2敲低显著抑制肝癌细胞的克隆形成能力(n=3,P<0.01)、迁移能力(n=3,P<0.01)及侵袭能力(n=3,P<0.001),而过表达KSR2则显著促进上述恶性表型;体内实验中,KSR2敲低组裸鼠的肿瘤体积及重量均显著小于对照组(n=6,P<0.01),过表达组则显著大于对照组(n=6,P<0.01);免疫组化结果显示,KSR2过表达组肿瘤组织中Ki67阳性细胞比例更高(n=3,P<0.01),敲低组则更低。实验所用关键产品:慢病毒载体(Genomeditech,上海,中国)、Lipofectamine 2000转染试剂(Invitrogen,卡尔斯巴德,美国)、Matrigel基质胶(Corning,纽约,美国)。
3.3 KSR2与14-3-3ζ的相互作用及MAPK通路调控机制解析
实验目的:解析KSR2促进肝癌进展的分子机制,明确其相互作用蛋白及对MAPK通路的调控作用。方法细节:采用免疫共沉淀(co-IP)结合质谱技术筛选KSR2的相互作用蛋白,通过co-IP实验验证KSR2与14-3-3ζ的直接结合;随后在肝癌细胞中敲低14-3-3ζ,采用qPCR、蛋白质免疫印迹检测KSR2表达及MAPK通路关键分子(p-CRAF、p-MEK1/2、p-ERK1/2)的磷酸化水平;同时采用免疫荧光(IF)技术检测KSR2与14-3-3ζ在肝癌组织中的亚细胞定位。结果解读:质谱筛选及co-IP实验证实,14-3-3ζ与KSR2存在直接相互作用;敲低14-3-3ζ可显著降低KSR2的蛋白水平(n=3,P<0.05),但对其mRNA水平无影响,提示14-3-3ζ通过调控KSR2的蛋白稳定性发挥作用;蛋白质免疫印迹结果显示,敲低14-3-3ζ可显著抑制MAPK通路中p-MEK1/2和p-ERK1/2的磷酸化水平(n=3,P<0.01);免疫荧光结果显示,KSR2与14-3-3ζ在肝癌组织的细胞质及细胞核中存在共定位。实验所用关键产品:蛋白A/G磁珠(MedChemExpress,新泽西州,美国)、抗14-3-3ζ抗体(CST,马萨诸塞州,美国)、免疫荧光试剂盒(Yeasen,上海,中国)。
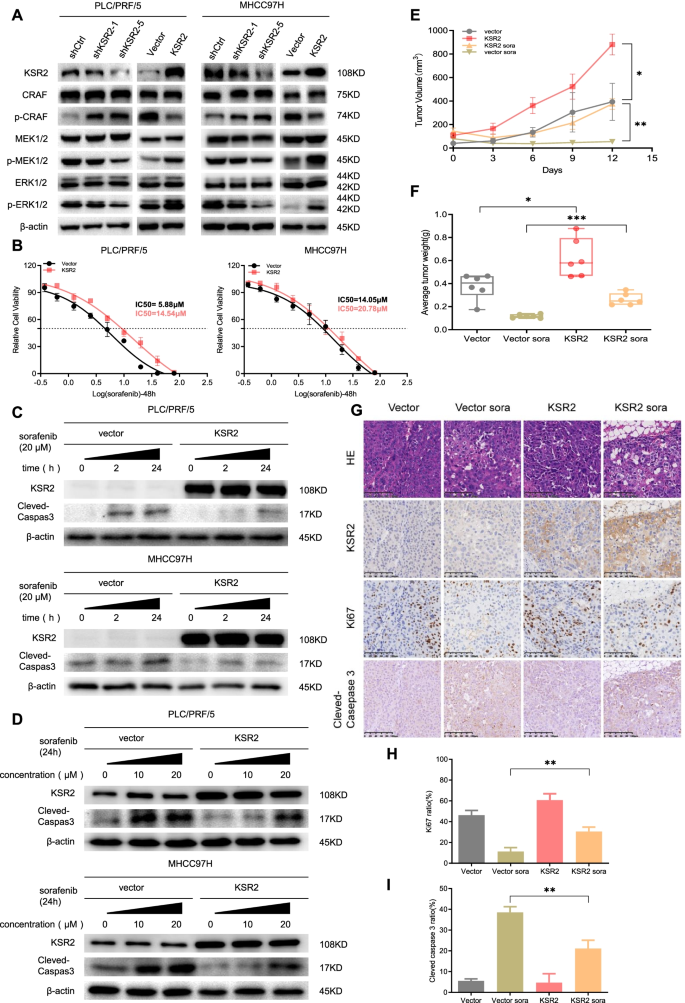
3.4 KSR2-14-3-3ζ复合物与索拉非尼耐药的关联验证
实验目的:明确KSR2-14-3-3ζ复合物对肝癌细胞索拉非尼敏感性的调控作用。方法细节:采用CCK-8实验检测KSR2过表达及对照细胞对索拉非尼的IC50值;通过流式细胞术检测索拉非尼处理后细胞的凋亡率;构建裸鼠异种移植模型,给予索拉非尼治疗(20mg/kg,隔日灌胃),监测肿瘤生长情况;同时在KSR2过表达细胞中敲低14-3-3ζ,检测细胞对索拉非尼的敏感性变化。结果解读:KSR2过表达显著降低肝癌细胞对索拉非尼的敏感性,IC50值升高(n=3,P<0.05),索拉非尼诱导的细胞凋亡率降低(n=3,P<0.01);体内实验中,KSR2过表达组裸鼠经索拉非尼治疗后的肿瘤体积仍显著大于对照组(n=6,P<0.01);敲低14-3-3ζ可显著恢复KSR2过表达细胞对索拉非尼的敏感性,凋亡率升高(n=3,P<0.01)。实验所用关键产品:索拉非尼、Annexin V-FITC/PI凋亡检测试剂盒(Bio-platform,上海,中国)、LSRFortessa流式细胞仪(BD Biosciences,加利福尼亚州,美国)。
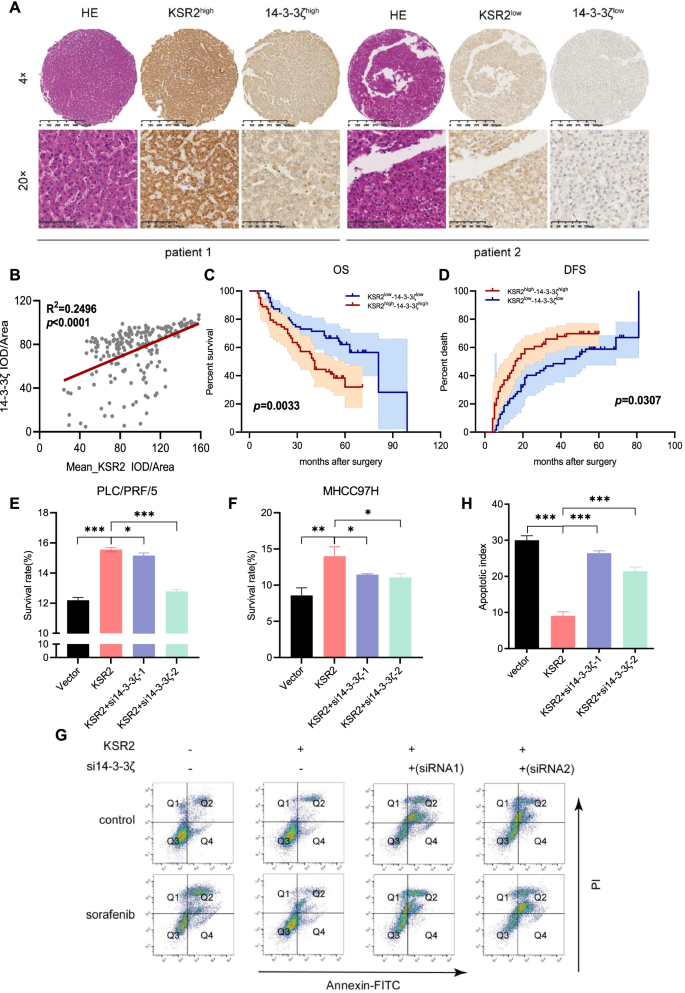
4. Biomarker研究及发现成果解析
本研究鉴定出KSR2-14-3-3ζ复合物作为肝细胞癌预后评估及索拉非尼耐药预测的新型生物标志物,其通过激活MAPK通路促进肝癌进展并介导耐药,为肝癌的精准治疗提供了新的靶点。
Biomarker定位:该生物标志物为KSR2与14-3-3ζ形成的蛋白复合物,属于功能型生物标志物,筛选与验证逻辑为“公共数据库筛选→临床样本验证→细胞功能验证→分子机制解析→耐药关联验证”的完整链条。研究过程详述:Biomarker来源为198对肝癌临床组织样本及肝癌细胞系;验证方法包括免疫组化检测蛋白表达、Kaplan-Meier生存分析评估预后价值、co-IP验证相互作用、细胞实验验证耐药调控作用;特异性与敏感性数据显示,KSR2与14-3-3ζ在肝癌组织中的表达呈正相关(R²=0.2496,P<0.0001),联合高表达两者的患者OS显著短于联合低表达患者(P=0.0033),DFS也显著更短(P=0.0307)。核心成果提炼:该复合物通过稳定KSR2蛋白并激活MAPK通路,促进肝癌细胞的增殖、迁移、侵袭及索拉非尼耐药;首次揭示了KSR2与14-3-3ζ的相互作用在肝癌中的功能,为肝癌预后评估提供了新的联合生物标志物,同时为逆转索拉非尼耐药提供了潜在的治疗靶点;统计学结果显示,该复合物的预后价值具有显著统计学意义(P<0.01),样本量覆盖198例临床患者,具备一定的临床应用潜力。