1. 领域背景与文献引入
文献英文标题:The landscape overview of CD47-based immunotherapy for hematological malignancies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液系统恶性肿瘤免疫治疗、CD47/SIRPα先天免疫检查点研究。
领域共识:以PD-1/PD-L1为代表的适应性免疫检查点抑制剂已成为多种肿瘤的标准治疗方案,显著改善了患者的预后,但仍存在部分患者无应答、耐药等问题。近年来,研究热点逐渐转向先天免疫检查点,其中CD47/SIRPα轴作为巨噬细胞的核心“别吃我”信号通路,成为肿瘤免疫治疗的新兴靶点。CD47广泛表达于正常细胞和肿瘤细胞表面,与巨噬细胞表面的SIRPα结合后,通过抑制吞噬信号通路帮助肿瘤细胞逃避免疫清除;阻断该轴不仅能增强巨噬细胞对肿瘤细胞的吞噬活性,还可促进抗原交叉呈递,激活T细胞介导的适应性免疫应答。目前,CD47单克隆抗体的临床试验已取得初步疗效,但血液毒性(尤其是贫血)成为限制其临床应用的主要障碍;双特异性抗体、SIRPα/Fc融合蛋白等新型CD47拮抗剂虽能降低毒性,但临床数据仍较为有限,且领域内缺乏对各类CD47拮抗剂临床进展的系统梳理。在此背景下,本综述从结构、功能、临床试验等角度全面总结了CD47拮抗剂在淋巴瘤和血液系统恶性肿瘤中的应用现状,为领域内的研究和药物开发提供了全景式参考。
2. 文献综述解析
本综述以CD47/SIRPα轴的生物学机制为基础,按药物类型(单克隆抗体、双特异性抗体、SIRPα/Fc融合蛋白)和疾病类型(淋巴瘤、血液系统恶性肿瘤)对现有研究进行分类整合,系统梳理了CD47拮抗剂的临床进展、疗效与安全性,并深入分析了当前研究面临的挑战及未来发展方向。
现有研究的关键结论表明,CD47/SIRPα轴阻断可通过多种机制发挥抗肿瘤效应,包括增强巨噬细胞吞噬、重编程肿瘤相关巨噬细胞表型、激活适应性免疫、介导NK细胞效应及直接抑制肿瘤细胞增殖迁移;CD47单克隆抗体在复发/难治性(R/R)非霍奇金淋巴瘤(NHL)、急性髓系白血病(AML)等疾病中显示出一定临床活性,但血液毒性(尤其是贫血)发生率较高;双特异性抗体通过同时结合CD47和肿瘤特异性抗原(如CD20、CD19),可优先靶向肿瘤细胞,降低对正常细胞的损伤;SIRPα/Fc融合蛋白由于不结合红细胞,血液毒性显著降低,且在临床试验中显示出良好的耐受性和初步疗效。现有研究的局限性主要包括:多数临床试验仍处于I/II期阶段,缺乏大规模III期临床数据;双特异性抗体仅针对表达特定抗原的肿瘤类型,适用范围有限;CD47在多种正常细胞的广泛表达导致药物脱靶风险;IgG亚型选择存在矛盾,IgG1亚型能有效激活巨噬细胞的Fc受体,但会介导红细胞的吞噬,而IgG4亚型毒性较低,但抗肿瘤活性较弱。
本综述的创新价值在于,它是目前为数不多的全面覆盖各类CD47拮抗剂临床进展的综述,不仅总结了已发表的临床试验数据,还纳入了正在进行的临床试验信息,为研究者提供了最新的研究动态。此外,综述系统分析了CD47免疫治疗面临的核心挑战,并提出了针对性的未来开发策略,包括优化给药方案、改造药物结构、开发新型药物载体、提高肿瘤选择性等,为领域内的药物开发和临床研究提供了重要的指导方向。
3. 研究思路总结与详细解析
本综述的研究目标是系统阐述CD47/SIRPα轴的生物学机制,全面总结CD47拮抗剂在血液系统恶性肿瘤中的临床研究进展,分析当前研究面临的挑战,并提出未来的发展策略。核心科学问题是如何在有效阻断CD47/SIRPα轴发挥抗肿瘤效应的同时,降低药物的血液毒性,提高治疗的安全性和有效性。研究路线遵循“基础机制-临床进展-挑战与展望”的逻辑闭环,通过整合已发表的基础研究和临床研究数据,构建了CD47免疫治疗的全景式框架。
3.1 CD47/SIRPα轴的基础生物学机制解析
实验目的:明确CD47/SIRPα轴的结构、表达模式及在肿瘤免疫逃逸中的作用机制,为CD47拮抗剂的开发提供理论基础。
方法细节:通过检索PubMed、Web of Science等数据库,整合已发表的结构生物学、细胞生物学、动物实验及临床研究文献,系统分析CD47和SIRPα的分子结构、组织表达谱、相互作用方式,以及CD47/SIRPα轴在肿瘤细胞免疫逃逸中的调控机制。
结果解读:CD47是一种分子量为50kDa的跨膜蛋白,由胞外可变区、跨膜区和胞内区组成,广泛表达于正常细胞和肿瘤细胞表面;SIRPα是主要表达于髓系细胞(巨噬细胞、树突状细胞等)表面的受体,包含胞外免疫球蛋白超家族结构域、跨膜区和胞内免疫受体酪氨酸抑制基序(ITIM)。CD47与SIRPα结合后,SIRPα胞内的ITIM发生磷酸化,招募Src同源磷酸酶(SHP)-1和SHP-2,抑制巨噬细胞的吞噬信号通路,传递“别吃我”信号,帮助肿瘤细胞逃避免疫清除。阻断CD47/SIRPα轴可通过五种机制发挥抗肿瘤效应:直接增强巨噬细胞对肿瘤细胞的吞噬;将肿瘤相关巨噬细胞重编程为抗肿瘤表型并增加肿瘤内巨噬细胞招募;促进树突状细胞的吞噬和抗原呈递,激活CD8+T细胞介导的适应性免疫;介导自然杀伤(NK)细胞的抗体依赖细胞介导的细胞毒性(ADCC)和补体依赖的细胞毒性(CDC)效应;直接诱导肿瘤细胞死亡、抑制增殖和迁移。
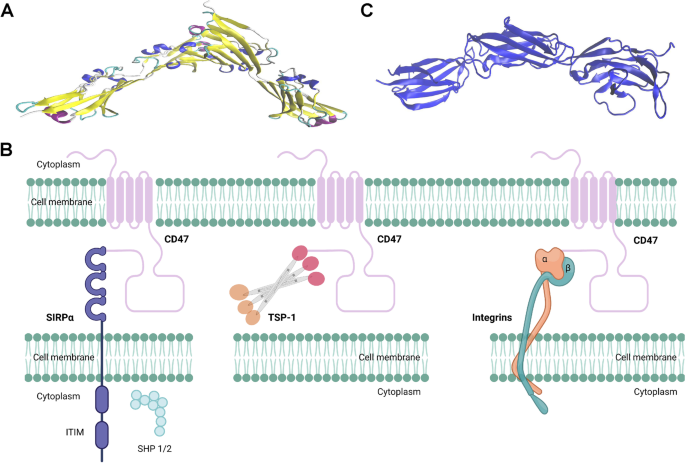
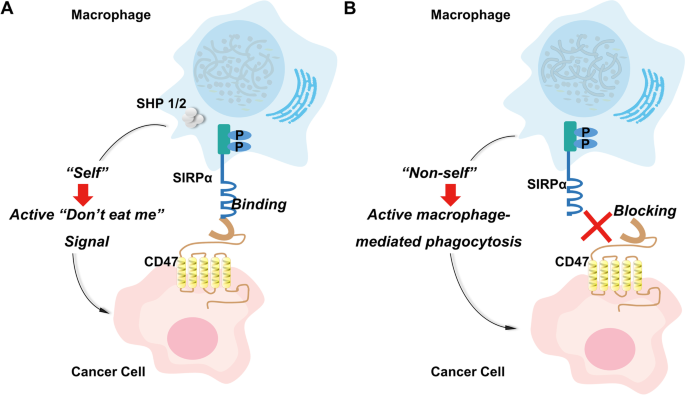
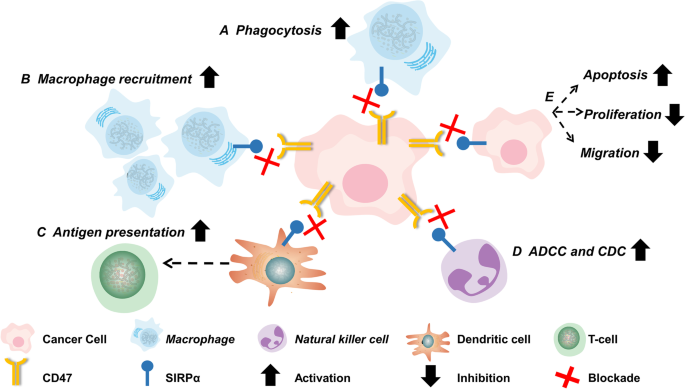
产品关联:文献未提及具体实验产品,领域常规使用重组蛋白、单克隆抗体、流式细胞仪等试剂/仪器进行CD47/SIRPα轴的机制研究。
3.2 CD47拮抗剂的临床研究进展梳理
实验目的:全面总结不同类型CD47拮抗剂在淋巴瘤和血液系统恶性肿瘤中的临床研究数据,评估其疗效与安全性。
方法细节:检索PubMed、ResearchGate、美国临床试验注册库(NCT)、中国药物临床试验注册中心(CTR)等数据库,收集CD47拮抗剂的临床试验信息,按药物类型(单克隆抗体、双特异性抗体、SIRPα/Fc融合蛋白)和疾病类型(淋巴瘤、AML、骨髓增生异常综合征(MDS)等)进行分类整理,提取患者特征、给药方案、不良反应、疗效数据等关键信息。
结果解读:在淋巴瘤治疗中,已有23种CD47拮抗剂进入临床试验。CD47单克隆抗体中,CC-90002联合利妥昔单抗在24例R/R NHL患者中,客观缓解率(ORR)为16.7%(1例完全缓解(CR)、2例部分缓解(PR)),主要不良反应为中性粒细胞减少(38%,3/4级)和血小板减少(21%,3/4级);Hu5F9-G4联合利妥昔单抗在22例R/R淋巴瘤患者中ORR为50%(n=22),其中弥漫大B细胞淋巴瘤(DLBCL)患者ORR为40%(n=15),滤泡性淋巴瘤(FL)患者ORR为71%(n=7),最常见不良反应为贫血(42%,n=22);TJ011133联合利妥昔单抗在7例R/R NHL患者中ORR为57%(3例CR、1例PR,n=7),无严重血液毒性,无需预激剂量;AK117在临床试验中显示出良好的安全性,无剂量限制性毒性和血液相关不良反应,无需预激剂量。CD47/CD20双特异性抗体IMM0306在临床前研究中显示出比CD47单抗更强的肿瘤选择性和抗肿瘤活性,目前处于I期临床试验阶段;CD47/CD19双特异性抗体TG-1801正在进行I期临床试验,尚未公布临床数据。SIRPα/Fc融合蛋白中,TTI-621单药治疗在71例NHL患者中ORR为20%(n=71),联合利妥昔单抗在DLBCL患者中ORR为21%(n=24),主要不良反应为可逆性血小板减少(20%,n=71);TTI-622在27例R/R淋巴瘤患者中ORR为33%(2例CR、7例PR,n=27),不良反应多为1/2级;ALX148联合利妥昔单抗在11例R/R CD20阳性B细胞NHL患者中ORR为63.6%(3例CR、4例PR,n=11),无剂量限制性毒性。在血液系统恶性肿瘤(AML、MDS)治疗中,Hu5F9-G4联合阿扎胞苷在初治AML/MDS患者中CR/完全缓解伴不完全血液学恢复(CRi)率达53%(n=15),在TP53突变AML患者中CR/CRi率更高;TJ011133在R/R AML/MDS患者的I期试验中,1例难治性AML患者达到形态学无白血病状态,不良反应多为1/2级。
产品关联:文献提及的关键临床研究药物:CC-90002(Celgene)、Hu5F9-G4(Gilead Sciences)、TJ011133(I-Mab Biopharma)、AK117(Akeso Biopharma)、IMM0306(ImmuneOnco Biopharma)、TG-1801(TG Therapeutics)、TTI-621/TTI-622(Trillium Therapeutics)、ALX148(Alexo Therapeutics)、IMM01(ImmuneOnco Biopharma)等。
3.3 CD47免疫治疗的挑战与未来策略分析
实验目的:分析当前CD47免疫治疗面临的核心挑战,提出针对性的未来开发策略,推动CD47拮抗剂的临床转化。
方法细节:基于已发表的临床研究数据和领域内的研究进展,系统梳理CD47免疫治疗在疗效、安全性、数据积累等方面的挑战,结合基础研究成果和药物开发技术,提出未来的发展方向。
结果解读:当前CD47免疫治疗面临三大挑战:一是治疗有效性不足,CD47在正常细胞广泛表达,需要大剂量或频繁给药才能有效阻断,但可能增加不良反应;肿瘤细胞表达的SIRPα和血小板反应蛋白-1(TSP-1)可能影响CD47拮抗剂的作用;IgG亚型选择存在矛盾,IgG1激活巨噬细胞活性强但易攻击红细胞,IgG4毒性低但抗肿瘤活性弱。二是安全性问题,血液毒性(尤其是贫血)是最常见的不良反应,此外还可能导致T细胞凋亡、神经系统功能异常等。三是数据积累不足,多数临床试验处于I/II期阶段,缺乏大规模III期数据,双特异性抗体的最优给药剂量尚未明确。针对这些挑战,未来的开发策略包括:采用预激剂量-维持剂量的给药方案;改造CD47单抗的结构,降低对红细胞的结合;开发双特异性抗体、SIRPα/Fc融合蛋白等新型药物;开发小分子抑制剂、纳米抗体、质粒载体等新型药物形式;设计pH依赖性CD47抗体提高肿瘤选择性;阻断顺式CD47/SIRPα相互作用增强巨噬细胞吞噬活性等。
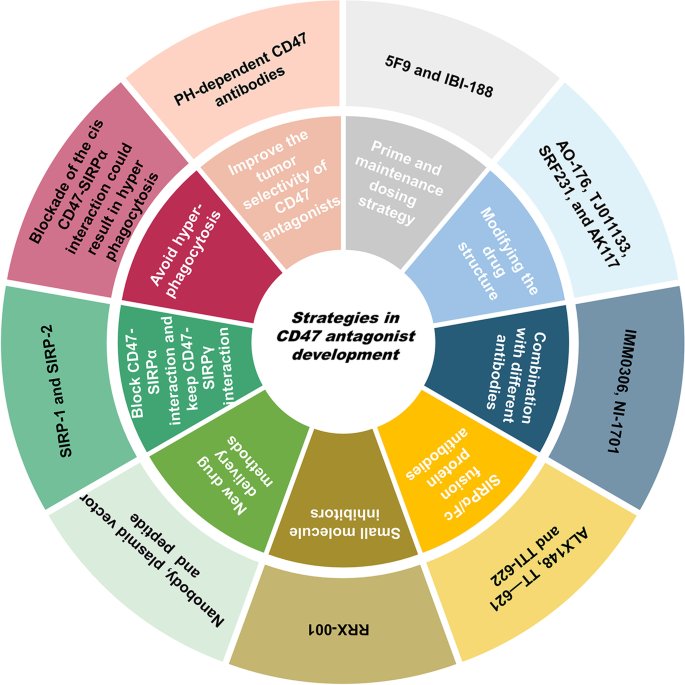
产品关联:文献未提及具体实验产品,领域常规使用结构生物学技术、基因工程技术、药物递送系统等进行CD47拮抗剂的优化开发。
4. Biomarker研究及发现成果
本综述中涉及的Biomarker主要包括CD47蛋白表达水平(预后Biomarker)和CD47受体占有率(药物暴露与疗效Biomarker),通过临床样本分析和临床试验数据验证了其在血液系统恶性肿瘤中的应用价值。
Biomarker定位:CD47作为预后Biomarker,其高表达与血液系统恶性肿瘤患者的不良预后相关;CD47受体占有率作为药物Biomarker,可反映药物的暴露水平,指导给药剂量的优化。筛选与验证逻辑:CD47预后Biomarker的筛选基于癌症基因组图谱(TCGA)数据库、临床样本的免疫组化(IHC)和流式细胞术分析,验证通过大样本临床队列的预后相关性分析;CD47受体占有率的验证通过临床试验中对患者外周血或肿瘤细胞表面CD47结合率的检测,分析其与药物疗效和安全性的相关性。
研究过程详述:CD47预后Biomarker的来源为肿瘤患者的肿瘤组织样本或外周血单个核细胞,验证方法包括免疫组化、流式细胞术、实时荧光定量PCR等,研究显示高CD47表达与AML、慢性髓系白血病(CLL)、NHL等患者的不良预后相关,但原文未提供具体的特异性、敏感性数据及受试者工作特征(ROC)曲线曲线下面积(AUC)值。CD47受体占有率的来源为患者外周血T细胞、红细胞等细胞表面,验证方法为流式细胞术,例如TJ011133在20mg/kg和30mg/kg剂量下,外周血CD47受体占有率分别为80%和90%;AK117在3mg/kg剂量下,外周血T细胞表面CD47受体占有率达到并维持100%,≥10mg/kg剂量下可实现完全且持续的受体占有率。
核心成果提炼:CD47作为预后Biomarker,可有效预测血液系统恶性肿瘤患者的不良预后,为患者分层和治疗方案选择提供依据;CD47受体占有率作为药物Biomarker,可反映药物的体内暴露水平,帮助确定最优给药剂量,提高治疗的有效性和安全性。目前CD47作为预后Biomarker的临床应用仍需进一步验证,缺乏大样本多中心队列的研究数据;CD47受体占有率与疗效的相关性仍需更多临床试验数据支持。
