1. 领域背景与文献引入
文献英文标题:Neutrophil extracellular traps primed intercellular communication in cancer progression as a promising therapeutic target;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫微环境与中性粒细胞胞外陷阱(NETs)研究
领域共识:肿瘤免疫微环境是调控肿瘤进展与免疫治疗响应的核心体系,中性粒细胞作为外周血最丰富的先天免疫细胞,其功能曾长期被忽视。2004年Brinkmann等首次发现中性粒细胞可释放由染色质与胞质蛋白组成的网状结构(即NETs)并发挥抗菌作用,此后NETs在自身免疫病、血栓性疾病中的作用逐渐被揭示。近年肿瘤领域研究显示,肿瘤相关中性粒细胞(TANs)可极化为促肿瘤的N2型或抗肿瘤的N1型,而NETs作为TANs的关键功能产物,已被证实可促进肿瘤增殖、转移与免疫抑制,但现有研究多聚焦NETs自身的功能表型,对其介导的肿瘤微环境内细胞间通讯机制缺乏系统梳理,这一空白限制了NETs作为肿瘤治疗靶点的转化应用。在此背景下,本文通过整合已发表的基础与临床研究数据,首次系统阐述NETs与肿瘤细胞、免疫细胞及血小板的互作机制,为肿瘤免疫治疗提供新的理论依据与潜在靶点。
2. 文献综述解析
本文综述以“NETs介导的细胞间通讯”为核心逻辑,按肿瘤微环境中的细胞类型(肿瘤细胞、巨噬细胞、淋巴细胞、血小板)分类,系统梳理NETs与各类细胞的互作机制、临床关联及治疗潜力。
现有研究中,针对NETs与肿瘤细胞的互作,已证实肿瘤细胞可通过分泌IL-8、G-CSF等因子诱导中性粒细胞形成NETs,而NETs可通过TLR家族受体、整合素等通路激活肿瘤细胞,促进上皮间质转化(EMT)与转移,部分体外研究显示NETs可抑制结直肠癌细胞增殖,但此类抗肿瘤作用的临床相关性尚未明确;技术方法上,现有研究多采用体外细胞共培养、小鼠异种移植模型及临床样本检测,其中单细胞RNA测序(scRNA-seq)技术的应用为解析NETs与循环肿瘤细胞(CTCs)的互作提供了高分辨率数据,但多数研究存在样本量较小、缺乏多中心验证的局限性。针对NETs与免疫细胞的互作,现有研究已明确NETs可抑制CD8+T细胞功能、诱导调节性T细胞(Tregs)分化,但NETs与巨噬细胞、自然杀伤(NK)细胞、B细胞的互作机制仅在非肿瘤疾病中部分揭示,肿瘤领域的相关研究仍处于起步阶段。
与现有仅关注NETs自身功能的综述不同,本文首次将NETs作为细胞间通讯的核心节点,系统整合其与肿瘤微环境中各类细胞的互作网络,同时梳理了NETs作为生物标志物的临床证据及潜在治疗策略,弥补了领域内对NETs介导的细胞互作机制缺乏系统总结的空白,为后续基础研究与临床转化提供了清晰的方向。
3. 研究思路总结与详细解析
本文作为综述性研究,整体研究目标是系统阐明NETs在肿瘤微环境中介导的细胞间通讯机制,明确其作为肿瘤预后生物标志物与治疗靶点的临床价值;核心科学问题是NETs如何通过与不同细胞的互作调控肿瘤进展与免疫抑制;技术路线为整合已发表的基础研究与临床研究数据,按细胞类型分类梳理互作机制,同时分析NETs的临床应用证据与潜在治疗策略。
3.1 NETs与肿瘤细胞的互作机制解析
实验目的是明确NETs与肿瘤细胞间的双向调控机制及分子通路。方法细节涵盖体外细胞共培养实验(如肿瘤细胞与中性粒细胞共培养诱导NETs形成)、小鼠异种移植模型验证NETs的促转移作用、临床样本免疫组化(IHC)检测NETs标志物表达,以及分子生物学实验验证TLR4/9、整合素等通路的激活。结果解读显示,肿瘤细胞分泌的IL-8、G-CSF等因子可通过CXCR1/2受体诱导中性粒细胞形成NETs,而NETs中的组蛋白、中性粒细胞弹性蛋白酶(NE)等成分可激活肿瘤细胞的TLR4/9通路,上调PGC1-α、COX2等分子,促进肿瘤细胞增殖与转移;NETs还可通过与肿瘤细胞表面的CCDC25蛋白结合,激活ILK-β-Parvin通路增强肿瘤细胞迁移能力;少数体外研究显示NETs可抑制结直肠癌细胞增殖,但此类作用的临床意义尚未明确。产品关联:文献未提及具体实验产品,领域常规使用免疫组化(IHC)试剂盒、ELISA检测试剂盒、流式细胞仪、实时荧光定量PCR(qRT-PCR)仪等。
3.2 NETs与免疫细胞的互作机制解析
实验目的是梳理NETs与巨噬细胞、淋巴细胞等免疫细胞的互作对肿瘤免疫微环境的调控作用。方法细节涵盖动物模型实验(如脓毒症模型中NETs与巨噬细胞的互作)、体外免疫细胞共培养实验、临床样本分析NETs与T细胞浸润的相关性。结果解读显示,NETs可通过HMGB1-RAGE通路诱导巨噬细胞焦亡,在非肿瘤疾病中可调控巨噬细胞向M1型极化,但肿瘤领域中NETs与巨噬细胞的互作机制尚未明确;NETs可抑制CD8+T细胞的迁移与功能,诱导其表达PD-1、LAG-3等耗竭标志物,同时促进初始CD4+T细胞向Tregs分化,削弱抗肿瘤免疫应答;而NETs与NK细胞、B细胞的互作机制在肿瘤领域几乎未被研究,仅在自身免疫病中证实NETs可诱导B细胞分化为浆细胞。产品关联:文献未提及具体实验产品,领域常规使用免疫磁珠分选试剂盒、流式细胞仪、细胞因子检测试剂盒等。
3.3 NETs与血小板的正反馈循环解析
实验目的是明确NETs与血小板的双向调控机制及其在肿瘤血栓形成与转移中的作用。方法细节涵盖小鼠脓毒症模型验证血小板诱导NETs形成、临床样本检测NETs与血小板激活标志物的相关性、体外实验验证NETs对血小板的激活作用。结果解读显示,激活的血小板可通过P-选择素与中性粒细胞表面的PSGL-1结合,诱导NETs形成;而NETs可通过DNA、组蛋白等成分激活血小板,形成正反馈循环,促进肿瘤相关血栓形成与CTCs的捕获,增强肿瘤转移能力。产品关联:文献未提及具体实验产品,领域常规使用血小板激活标志物检测试剂盒、流式细胞仪等。
3.4 NETs的临床生物标志物与治疗策略分析
实验目的是总结NETs作为肿瘤生物标志物的临床证据及潜在治疗策略。方法细节涵盖大样本临床队列分析NETs标志物与预后的相关性、动物模型验证NETs抑制剂的治疗效果、临床研究进展梳理。结果解读显示,循环中的MPO-DNA、NE-DNA复合物及瓜氨酸化组蛋白H3(H3Cit)可作为肿瘤预后的独立生物标志物,其中H3Cit在957例癌症患者中与更高死亡率独立相关(HR=1.1,P<0.001);潜在治疗策略包括降解已形成的NETs(如DNase I)、抑制NETs形成(如PAD4抑制剂GSK484、NE抑制剂Sivelestat),且NETs抑制剂与免疫检查点抑制剂联合使用在动物模型中显示出协同抗肿瘤作用。产品关联:文献未提及具体实验产品,领域常规使用ELISA检测试剂盒、NETs抑制剂(如重组DNase I)等。
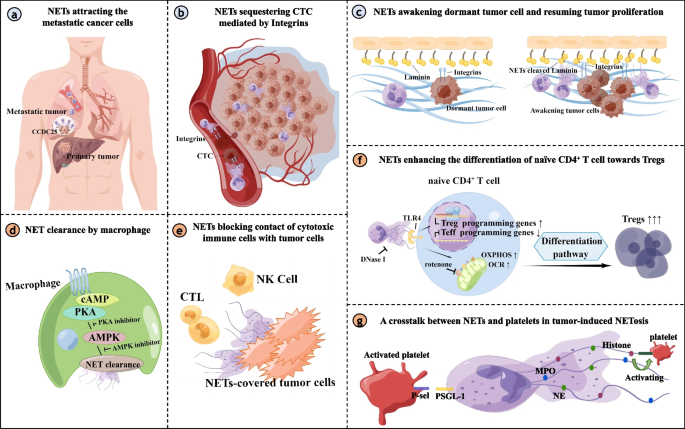
该图系统展示了NETs与肿瘤细胞、巨噬细胞、淋巴细胞及血小板的互作机制,直观呈现了NETs作为细胞间通讯核心节点的调控网络。
4. Biomarker研究及发现成果
本文中涉及的NETs相关生物标志物主要包括MPO-DNA复合物、NE-DNA复合物及瓜氨酸化组蛋白H3(H3Cit),其筛选与验证逻辑为:先通过基础研究明确NETs的核心组成成分,再通过临床样本检测验证其与肿瘤预后、分期的关联,最终评估其作为诊断与预后生物标志物的价值。
Biomarker的来源主要为患者的血清、血浆或肿瘤组织,验证方法包括ELISA定量检测循环中的MPO-DNA、NE-DNA复合物,免疫组化(IHC)检测肿瘤组织中的H3Cit表达。特异性与敏感性方面,血清NE-DNA复合物在胃癌中的诊断效能优于传统标志物CA19-9与CEA,且与淋巴结转移正相关;循环H3Cit水平在957例癌症患者中与更高死亡率独立相关(HR=1.1,P<0.001),在胰腺导管腺癌患者中,肿瘤组织中H3Cit标记的NETs与无复发生存期(RFS)及总生存期(OS)负相关;MPO-DNA复合物在转移性结直肠癌患者中与更短生存期相关,且可作为肝转移的预测标志物。
核心成果提炼:NETs相关标志物可作为多种肿瘤的独立预后生物标志物,其表达水平与肿瘤分期、转移及免疫抑制状态密切相关;创新性在于本文首次系统整合了不同NETs标志物的临床证据,明确了其在肿瘤诊断、预后中的应用价值;同时,NETs作为治疗靶点,其抑制剂与免疫检查点抑制剂的联合治疗策略在动物模型中显示出协同作用,为临床转化提供了方向。目前NETs标志物的临床应用仍缺乏统一的检测标准,大样本多中心验证数据不足,需进一步研究完善。
