1. 领域背景与文献引入
文献英文标题:Identifying candidate drivers of alcohol dependence-induced excessive drinking by assembly and interrogation of brain-specific regulatory networks;发表期刊:Genome Biology;影响因子:未公开;研究领域:神经科学(酒精依赖与脑区转录调控网络)
酒精依赖是一种慢性复发性脑疾病,核心特征为失去饮酒控制、强迫性饮酒及戒断后的高复发率,严重危害人类健康。领域共识:酒精依赖的发病机制涉及脑奖赏系统(如伏隔核、腹侧被盖区)和应激系统(如杏仁核)的神经适应性改变,传统研究多聚焦单个基因或信号通路的功能验证,但难以解析复杂的多基因网络调控关系。2000年后,系统生物学网络方法在癌症领域成功应用于关键驱动因子筛选,但在中枢神经系统疾病中的应用仍处于起步阶段。当前研究未解决的核心问题包括:脑区特异性调控网络如何介导酒精依赖的长期神经适应,尤其是在人类复发风险最高的长期戒断阶段,相关网络调控机制尚未明确;现有治疗靶点多基于急性戒断或全身作用,缺乏针对长期戒断阶段脑区特异性的调控靶点。结合领域现状,本研究旨在通过系统生物学方法构建酒精依赖大鼠脑区特异性转录调控网络,筛选介导过度饮酒的关键调控因子,填补长期戒断阶段网络调控研究的空白,为酒精依赖的治疗提供全新的脑区特异性靶点方向。
2. 文献综述解析
作者在综述部分以“研究方法的演进”为分类维度,对比了传统候选基因研究与系统生物学网络研究在酒精依赖领域的应用。现有研究的关键结论包括:酒精依赖过程中下丘脑-垂体-肾上腺轴的糖皮质激素系统功能紊乱,糖皮质激素受体参与介导强迫性饮酒,但多数研究聚焦全身给药或急性戒断阶段的作用;传统研究的技术方法优势在于可直接验证单个分子的功能,实验体系成熟,但局限性在于无法解析复杂的多基因网络调控关系,忽略了脑区特异性的神经适应差异,且针对长期戒断阶段的研究较为匮乏,难以揭示人类复发的核心机制。通过对比现有研究的未解决问题,本研究的创新价值凸显:首次将在癌症领域成功应用的ARACNe(精准细胞网络重建算法)与MARINa(主调控因子推断算法)系统生物学方法,应用于酒精依赖大鼠的脑区转录组数据,构建全基因组范围的脑特异性转录调控网络,聚焦长期戒断阶段这一人类复发的关键窗口,发现糖皮质激素受体在伏隔核和腹侧被盖区的特异性调控网络,而这一脑区特异性作用未被传统研究关注,为酒精依赖的治疗提供了全新的脑区特异性靶点方向。
3. 研究思路总结与详细解析
本研究的整体框架为“动物模型构建-转录组数据采集-调控网络构建-主调控因子筛选-功能验证”的闭环逻辑,研究目标是解析酒精依赖大鼠脑区特异性转录调控网络,筛选介导过度饮酒的关键驱动因子;核心科学问题是脑区特异性调控网络如何介导酒精依赖从非依赖到依赖的神经适应性改变;技术路线以大鼠酒精依赖模型为基础,通过转录组测序获取多脑区基因表达谱,利用生物信息学方法构建调控网络并筛选主调控因子,最终通过脑区特异性药物干预和基因操作验证调控因子的功能。
3.1 酒精依赖大鼠模型构建与行为学验证
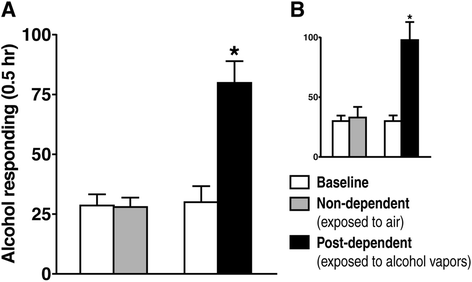
实验目的是建立符合人类酒精依赖核心特征的大鼠模型,验证依赖大鼠在戒断阶段的过度饮酒行为;方法细节:选用成年雄性Wistar大鼠,训练其通过操作式条件反射自主饮用10%(w/v)酒精,随后将大鼠分为三组:酒精依赖组给予慢性间歇性酒精蒸气暴露(14小时开启/10小时关闭)4周,维持血酒精浓度在175-225mg%以诱导依赖;非依赖组暴露于空气作为对照;同时设置未接触酒精的 naive 组作为基线对照。在急性戒断(蒸气暴露结束后6-8小时)和长期戒断(3周后)阶段检测大鼠的酒精自主饮酒行为;结果解读:行为学数据显示,依赖组在急性戒断阶段的酒精按压次数显著高于非依赖组和自身基线水平(n=10,P<0.01),长期戒断阶段仍维持较高的饮酒水平,表明模型成功模拟了人类酒精依赖的过度饮酒和高复发风险特征;产品关联:文献未提及具体实验产品,领域常规使用大鼠操作式自主饮酒箱、酒精蒸气暴露系统等设备。
3.2 脑区转录组测序与数据预处理
实验目的是获取不同脑区的基因表达谱数据,为后续调控网络构建提供高质量数据集;方法细节:从依赖组、非依赖组和 naive 组大鼠中,显微解剖8个与酒精奖赏和应激相关的脑区,包括内侧前额叶皮层、伏隔核核心、伏隔核壳、中央杏仁核、基底外侧杏仁核、终纹床核背侧、终纹床核腹侧及腹侧被盖区,每组选取4只大鼠的脑区样本,采用Affymetrix Rat Genome 230 2.0 GeneChip®芯片进行转录组测序。随后使用Cleaner算法对原始数据进行预处理,包括探针重映射、探针相关性分析,去除低质量和非特异性结合的探针;结果解读:预处理后得到7019个高质量探针集,对应6715个唯一基因,为后续调控网络构建提供了可靠的转录组数据;产品关联:实验所用关键产品:Affymetrix Rat Genome 230 2.0 GeneChip®芯片。
3.3 脑区特异性转录调控网络构建
实验目的是通过反向工程方法构建全基因组范围的脑特异性转录调控网络;方法细节:基于预处理后的转录组数据,使用ARACNe算法构建转录调控网络,该算法通过计算转录因子与候选靶基因之间的互信息(MI),筛选具有统计学意义的相互作用(P≤0.05,Bonferroni校正),并基于数据处理不等式去除间接相互作用;结果解读:成功构建包含664个转录因子和6716个靶基因的中枢神经系统转录调控网络,共包含78090个预测的转录因子-靶基因相互作用,平均每个转录因子调控约100个靶基因,覆盖了酒精奖赏和应激通路的关键脑区;产品关联:文献未提及具体实验产品,领域常规使用ARACNe生物信息学分析工具。

3.4 主调控因子筛选与细胞水平验证
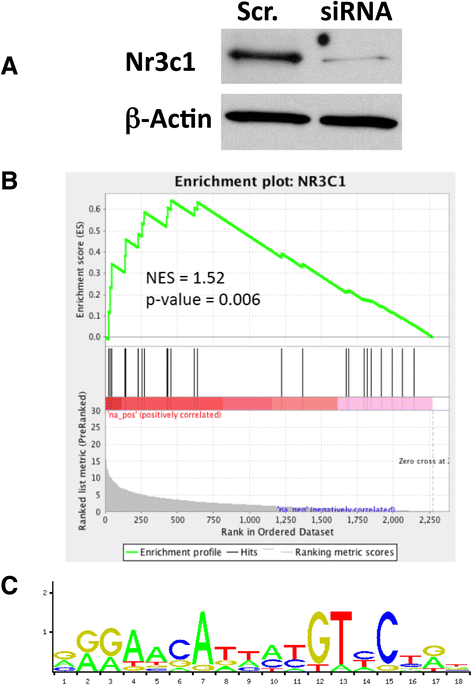
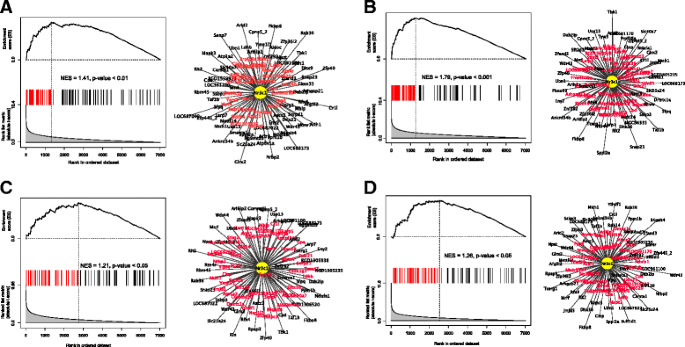
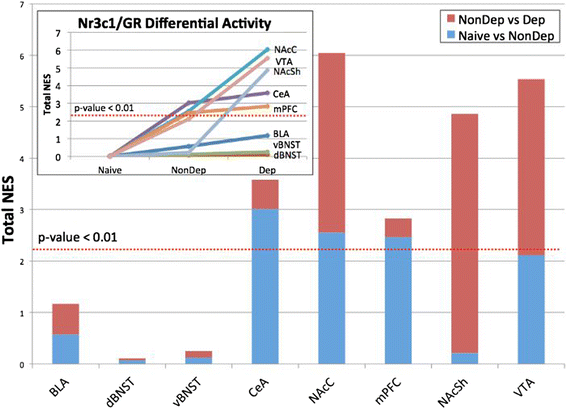
实验目的是筛选介导酒精依赖过度饮酒的关键主调控因子,并验证其调控网络的真实性;方法细节:使用MARINa算法对构建的转录调控网络进行分析,通过基因集富集分析(GSEA)检测每个转录因子的靶基因在依赖/非依赖、 naive/非依赖组的差异表达富集程度,筛选具有显著标准化富集分数(NES)的主调控因子。针对排名靠前的糖皮质激素受体(编码基因为Nr3c1),在大鼠纹状体中型多棘神经元细胞系M213中,使用siRNA沉默Nr3c1表达,通过转录组测序检测靶基因的表达变化,再次用GSEA分析GR靶基因的富集情况;同时分析GR靶基因启动子区域的GR结合位点富集;结果解读:MARINa分析显示GR在伏隔核、腹侧被盖区等多个脑区为高排名主调控因子;siRNA沉默GR后,其靶基因在差异表达基因中显著富集(NES=1.28,n=4,P<0.004),且GR靶基因的启动子区域显著富集经典GR结合位点(P<0.05),验证了GR调控网络的真实性;产品关联:实验所用关键产品:Applied Biosystems的Nr3c1 siRNA。
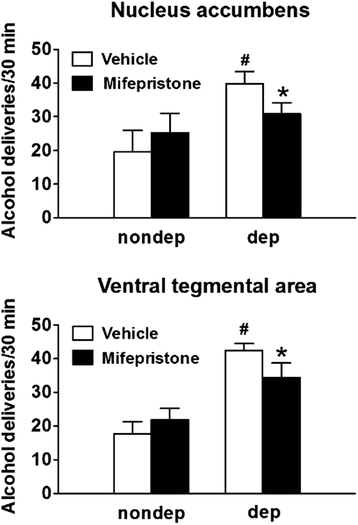
3.5 脑区特异性糖皮质激素受体拮抗的行为学验证
实验目的是验证GR在伏隔核和腹侧被盖区对依赖大鼠过度饮酒的调控作用;方法细节:在依赖组和非依赖组大鼠的伏隔核和腹侧被盖区双侧植入套管,在长期戒断阶段(蒸气暴露结束后1-2个月),向目标脑区双侧注射GR拮抗剂米非司酮(30μg/0.3μL/侧)或溶媒对照,注射90分钟后检测大鼠的自主饮酒行为;结果解读:溶媒处理的依赖组大鼠酒精摄入量显著高于非依赖组(n=7,P<0.05),而米非司酮注射到伏隔核或腹侧被盖区后,依赖组的酒精摄入量显著降低(n=7,P<0.05),但对非依赖组的饮酒行为无影响,说明GR在这两个脑区特异性调控依赖大鼠的过度饮酒行为;产品关联:实验所用关键产品:米非司酮(RU38486)。
3.6 新型调控因子Psip1的功能验证
实验目的是验证另一个筛选得到的主调控因子Psip1在酒精依赖中的功能;方法细节:通过腺相关病毒(AAV)载体在大鼠中央杏仁核区过表达Psip1,检测依赖组和非依赖组大鼠的强迫性饮酒行为;结果解读:过表达Psip1后,依赖组大鼠的强迫性饮酒行为显著降低(P<0.05),但对非依赖组无影响,表明Psip1是介导酒精依赖过度饮酒的新型调控因子;产品关联:实验所用关键产品:AAV载体(含Psip1基因,由NIH的Ronald A. Bush博士提供)。
4. Biomarker研究及发现成果解析
本研究中涉及的Biomarker为功能性转录调控Biomarker,包括糖皮质激素受体(GR)和Psip1,筛选与验证逻辑为“转录组数据采集→调控网络构建→主调控因子筛选→细胞与在体功能验证”的完整链条。研究过程详述:Biomarker的来源为酒精依赖、非依赖及 naive 大鼠的8个脑区转录组样本,验证方法包括生物信息学富集分析、细胞水平siRNA沉默、脑区水平药物拮抗和基因过表达;特异性与敏感性数据显示,GR在依赖组伏隔核和腹侧被盖区的调控活性(标准化富集分数)显著高于非依赖组(P<0.01),米非司酮干预的特异性表现为仅显著降低依赖组的酒精摄入量(n=7,P<0.05),对非依赖组无影响。核心成果提炼:GR作为酒精依赖过度饮酒的核心功能性Biomarker,通过伏隔核和腹侧被盖区的特异性调控网络介导长期戒断阶段的过度饮酒,其创新性在于首次发现GR在这两个脑区的特异性调控作用,填补了长期戒断阶段脑区特异性Biomarker研究的空白;统计学结果显示,米非司酮干预后依赖组酒精摄入量显著降低(n=7,P<0.05),GR靶基因在siRNA沉默后的富集分析具有显著统计学意义(NES=1.28,n=4,P<0.004)。Psip1作为新型Biomarker,首次被发现参与中央杏仁核区的强迫性饮酒调控,为酒精依赖的治疗提供了新的候选靶点。
