1. 领域背景与文献引入
文献英文标题:A novel three-way rearrangement involving ETV6 (12p13) and ABL1 (9q34) with an unknown partner on 3p25 resulting in a possible ETV6-ABL1 fusion in a patient with acute myeloid leukemia: a case report and a review of the literature;发表期刊:Biomarker Research;影响因子:未公开;研究领域:血液肿瘤(急性髓系白血病)。
领域共识:急性髓系白血病(AML)是起源于造血干细胞的恶性克隆性疾病,染色体异常是其核心特征之一,约50%的患者存在染色体易位、缺失或扩增等异常,这些异常常导致融合基因形成,通过调控细胞增殖、凋亡等通路驱动白血病发生发展。当前AML领域的研究热点聚焦于罕见驱动融合基因的鉴定、精准诊断技术优化及靶向治疗响应标志物挖掘,而未解决的核心问题包括:部分隐匿性或复杂染色体重排难以通过常规技术检测,导致罕见融合基因漏诊;部分罕见融合基因的功能及治疗响应特征尚不明确,缺乏足够病例数据支持临床决策。
ETV6-ABL1融合基因是一类罕见的白血病驱动融合基因,截至本文发表前仅报道32例,其中仅5例为AML患者,且多数病例为简单染色体易位导致的融合,涉及复杂三向重排的病例报道极少。由于ETV6与ABL1相对于着丝粒的转录方向相反,形成功能性融合需要至少三次染色体断裂,常规核型分析易漏诊这类异常,且部分荧光原位杂交(FISH)探针也可能无法有效检测,导致这类病例的诊断率偏低。此外,ETV6-ABL1融合基因的功能与BCR-ABL1类似,理论上对酪氨酸激酶抑制剂(TKI)敏感,但现有病例数据显示患者响应程度差异较大,且复发率较高,缺乏针对AML亚型的系统分析。因此,本研究通过报道1例涉及3p25区域的三向重排导致的ETV6-ABL1融合AML病例,补充了该类罕见融合的病例数据,强调了联合细胞遗传学检测技术的重要性,为AML的精准诊断和治疗提供参考。
2. 文献综述解析
本文综述部分以血液肿瘤类型为分类维度,系统梳理了已报道的32例ETV6-ABL1融合基因病例,涵盖急性淋巴细胞白血病(ALL)、AML、骨髓增殖性肿瘤(MPN)三大类,重点分析了该融合基因的形成机制、功能特征及临床治疗响应情况。
现有研究的关键结论显示,ETV6-ABL1融合基因的形成依赖至少三次染色体断裂-连接事件,其编码的融合蛋白包含ETV6的螺旋-环-螺旋(HLH)结构域和ABL1的酪氨酸激酶结构域,可通过持续激活酪氨酸激酶通路驱动白血病发生,功能与BCR-ABL1高度相似;临床治疗方面,携带该融合基因的患者对伊马替尼等酪氨酸激酶抑制剂有一定响应,但多数患者会出现复发,仅少数患者可通过酪氨酸激酶抑制剂或异基因造血干细胞移植获得长期缓解。技术方法上,常规核型分析对这类隐匿性或复杂重排的检测敏感性较低,荧光原位杂交(FISH)是检测该融合基因的关键技术,但部分商业化ABL1 FISH探针可能无法识别这类异常,导致漏诊;现有研究的局限性在于病例数量少,尤其是AML亚型的病例数据匮乏,对复杂重排导致的融合基因形成机制及临床意义的认识不足,缺乏大样本研究明确该融合基因的预后价值及最佳治疗方案。
与现有研究相比,本研究的创新点在于首次报道了涉及3p25区域的三向染色体重排导致的ETV6-ABL1融合基因,补充了AML中该融合基因的病例类型,揭示了3p25区域可能参与该融合基因的形成及白血病发生过程;同时,本研究通过联合常规核型分析、间期及中期荧光原位杂交技术,明确了复杂重排的具体模式,为这类罕见异常的诊断提供了技术参考,解决了常规核型分析漏诊隐匿性重排的问题,凸显了多技术联合检测在血液肿瘤精准诊断中的必要性。
3. 研究思路总结与详细解析
本文的研究目标是明确1例由骨髓增生异常综合征(MDS)进展为AML的患者的染色体异常特征,验证是否存在ETV6-ABL1融合基因,并结合临床数据及文献综述分析该融合基因的临床意义;核心科学问题包括复杂三向染色体重排如何形成ETV6-ABL1融合基因,以及该融合基因与患者临床表型、治疗响应的关联;技术路线遵循“临床病例发现异常→细胞遗传学技术验证→分子机制分析→临床意义总结”的闭环逻辑,通过多种技术联合应用明确了染色体重排模式,并补充了该类融合基因的临床数据。
3.1 常规细胞遗传学分析
实验目的:检测患者骨髓细胞的染色体数目及结构异常,初步明确核型特征。
方法细节:采用标准细胞遗传学技术对患者骨髓样本进行染色体分析,使用Applied Imaging CytoVision软件进行核型分析,按ISCN 2013命名规则描述核型。
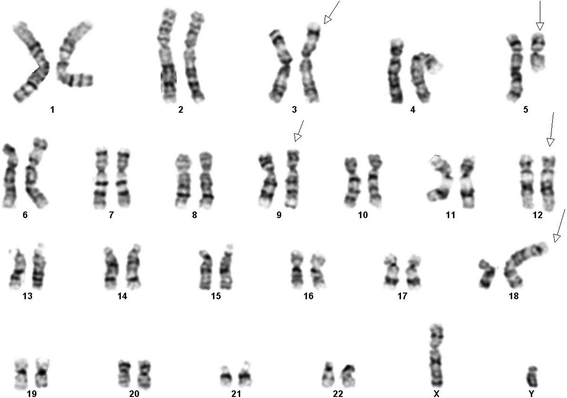
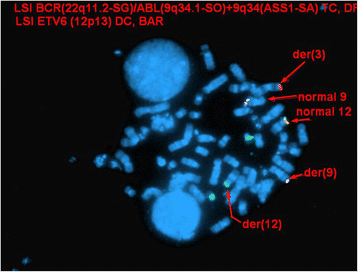
结果解读:在10个中期细胞中,2个细胞存在t(3;9)(p25;q34)、t(5;18)(q13;p11.2)易位,以及12p11.2区域的未知额外物质,其余8个细胞核型正常(n=10),对应图1的G显带核型图,显示涉及3、9、12号染色体的三向重排及5、18号染色体的易位。
产品关联:实验所用关键产品:Applied Imaging CytoVision软件(Applied Imaging, Genetix, Santa Clara, CA)。
3.2 间期荧光原位杂交(FISH)检测
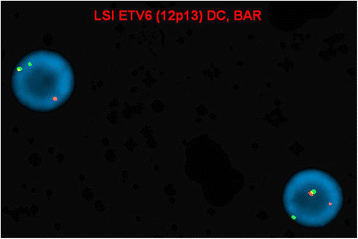
实验目的:验证ETV6和ABL1基因是否存在重排,明确重排的细胞阳性率。
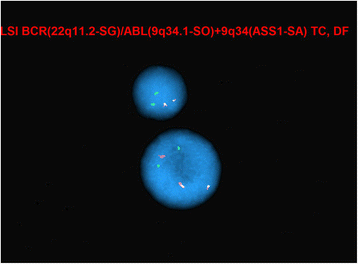
方法细节:采用Abbott Molecular的Vysis ETV6断裂分离FISH探针试剂盒、Vysis BCR/ABL1/ASS1三色DF FISH探针试剂盒,对患者骨髓间期细胞核进行FISH检测,计数300个细胞核的信号情况。
结果解读:41.3%(124/300)的细胞核存在ETV6基因重排(显示分离的红绿信号),5.7%(17/300)的细胞核存在ABL1基因重排(显示额外的ABL1红色信号),对应图2的间期FISH图(ABL1重排)和图3的间期FISH图(ETV6重排),提示患者骨髓细胞中存在ETV6和ABL1的基因重排,但阳性率存在差异。
产品关联:实验所用关键产品:Abbott Molecular的Vysis BCR/ABL1/ASS1 Tri-color DF FISH Probe Kit、Vysis LSI BCR/ABL Dual Color, Dual Fusion Probe Kit、Vysis ETV6 Break Apart FISH Probe Kit。
3.3 中期荧光原位杂交(FISH)与核型修正
实验目的:明确ETV6和ABL1基因重排的染色体定位,验证是否存在ETV6-ABL1融合基因,并修正核型描述。
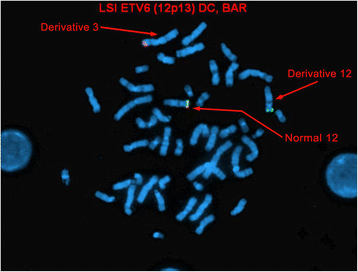
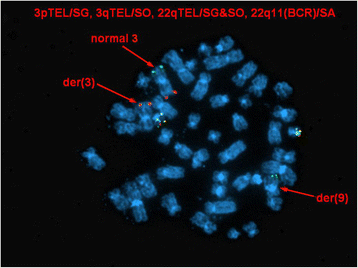
方法细节:在已进行G显带的中期细胞上,使用上述FISH探针进行检测,同时采用TotelVysion 3p、3q探针进行端粒FISH检测,观察信号的定位情况。
结果解读:中期FISH显示ABL1与ETV6信号共定位于3号染色体短臂(3p25区域),提示存在潜在的ETV6-ABL1融合基因;端粒FISH显示3p端粒信号位于衍生9号染色体长臂,衍生12号染色体无3p端粒信号,结合常规核型分析结果,修正后的核型为46,XY,der(3)ins(3;12)(p25;p13p13)t(3;9)(p25;q34),t(5;18)(q13;p11.2),der(9)t(3;9),der(12)ins(3;12)(p25;p13p13)add(12)(p13)[2]/46,XY[8],对应图4(ETV6信号在衍生3号染色体)、图5(ABL1与ETV6信号共定位)、图6(3p端粒信号定位),明确了三向重排的具体模式:ETV6插入3p25区域后,衍生3号染色体与9号染色体发生易位,形成潜在的ETV6-ABL1融合。
产品关联:实验所用关键产品:Abbott Molecular的上述FISH探针试剂盒,以及TotelVysion 3p Spectrum Green、TotelVysion 3q Spectrum Orange探针。
3.4 临床数据与文献关联分析
实验目的:分析ETV6-ABL1融合基因与患者临床表型、治疗响应的关联,结合现有文献总结该融合基因的临床特征。
方法细节:回顾患者的临床病史、实验室检查结果及治疗过程,系统检索已发表的ETV6-ABL1融合基因病例报道,进行病例特征及治疗响应的汇总分析。
结果解读:患者为73岁男性,由MDS进展为AML,伴骨髓嗜酸性粒细胞增多、皮疹及明显液体潴留,使用伊马替尼治疗后上述症状迅速缓解,但患者最终出现复发并死亡;结合文献分析,已报道的5例AML患者中,3例伴嗜酸性粒细胞增多,多数患者对伊马替尼有短暂响应,但仅1例通过异基因造血干细胞移植获得长期缓解,提示ETV6-ABL1融合基因阳性AML患者的预后较差,酪氨酸激酶抑制剂仅能带来短期临床获益。
产品关联:文献未提及具体治疗相关产品,领域常规使用伊马替尼等酪氨酸激酶抑制剂。
4. Biomarker研究及发现成果
本文研究的生物标志物为ETV6-ABL1融合基因,通过“常规核型分析初筛异常→间期FISH验证基因重排→中期FISH明确融合定位→临床表型关联分析”的完整逻辑链条,验证了该融合基因作为AML潜在生物标志物的价值。
该生物标志物的来源为患者的骨髓细胞,筛选过程始于常规核型分析发现的染色体异常,随后通过间期荧光原位杂交(FISH)检测到ETV6和ABL1基因的重排,进一步通过中期FISH明确了两者在3p25区域的共定位,确认潜在的融合基因形成;验证方法上,联合使用常规细胞遗传学、间期及中期FISH技术,弥补了单一技术的局限性,提高了检测的准确性;特异性方面,ETV6-ABL1融合基因在AML中极为罕见,截至本文发表前仅报道5例,本文为第6例,提示该融合基因可作为AML的罕见亚型生物标志物;敏感性方面,常规核型分析仅检测到部分染色体异常,间期FISH检测到41.3%的细胞存在ETV6重排,5.7%的细胞存在ABL1重排,显示FISH技术对这类异常的检测敏感性更高。
该融合基因的功能关联在于,其编码的融合蛋白可持续激活酪氨酸激酶通路,驱动AML的发生发展,与患者的嗜酸性粒细胞增多、皮疹等临床表型相关;作为预后生物标志物,携带该融合基因的AML患者对伊马替尼等酪氨酸激酶抑制剂有短暂响应,但复发率高,预后较差,文献未明确提供风险比HR等具体统计学数据;创新性方面,本文首次报道了涉及3p25区域的三向染色体重排导致的ETV6-ABL1融合基因,为该融合基因的形成机制提供了新的案例,提示3p25区域的基因可能参与白血病发生过程,同时强调了多技术联合检测在罕见白血病生物标志物鉴定中的重要性。
