1. 领域背景与文献引入
文献英文标题:RNA methylomes reveal the m⁶A-mediated regulation of DNA demethylase gene SlDML2 in tomato fruit ripening;发表期刊:Genome Biology;影响因子:14.028(2019年);研究领域:植物表观遗传学与果实发育生物学。
果实成熟是园艺作物核心农艺性状,直接决定果实品质与货架期,其调控涉及转录、表观遗传等多层面网络。领域共识:DNA甲基化(5-甲基胞嘧啶,5mC)是番茄果实成熟的核心表观调控因子,DNA去甲基化酶SlDML2通过全基因组去甲基化激活成熟相关基因,其突变会导致果实成熟完全受阻;而N⁶-甲基腺苷(m⁶A)作为真核生物mRNA最普遍的内部修饰,参与调控mRNA稳定性、翻译效率等转录后过程,在哺乳动物干细胞命运决定、拟南芥开花转变中发挥关键作用,但在园艺作物果实成熟中的功能及与DNA甲基化的相互调控关系尚未明确,这一空白限制了对果实成熟表观调控网络的全面理解。因此,本研究旨在解析番茄果实成熟过程中m⁶A修饰的动态特征,揭示其与DNA甲基化的相互作用机制,为果实成熟精准调控提供新理论依据。
2. 文献综述解析
作者从m⁶A修饰生物学功能、DNA甲基化在果实成熟中的调控作用两个维度综述现有研究,明确领域进展与空白。
现有研究总结:在m⁶A修饰领域,已鉴定其催化复合物(writers)、去甲基化酶(erasers)和识别蛋白(readers),明确其在mRNA代谢中的核心功能及在动植物发育中的调控作用,优势在于建立了m⁶A修饰的基本调控框架,但局限性在于其在园艺作物果实发育中的功能研究较少,且与其他表观修饰的相互作用机制未被揭示。在果实成熟的DNA甲基化调控领域,已明确SlDML2介导的DNA去甲基化是成熟的关键驱动力,Cnr等表观突变体证实了DNA甲基化对成熟的抑制作用,优势在于锁定了核心调控基因,但局限性在于未涉及转录后修饰层面的调控机制。
本研究创新价值:通过填补现有研究空白,首次将DNA甲基化与m⁶A修饰关联,揭示两者在果实成熟中的反馈调控回路,完善了果实成熟表观调控网络中“DNA甲基化-转录后修饰”调控轴,为表观修饰间的交叉调控提供了植物中的典型案例。
3. 研究思路总结与详细解析
本研究整体目标是解析番茄果实成熟过程中m⁶A修饰的动态特征及其与DNA甲基化的相互调控机制,核心科学问题是m⁶A修饰如何参与果实成熟调控、DNA甲基化如何调控m⁶A修饰的动态变化,技术路线遵循“表型观察-组学分析-基因筛选-功能验证-机制解析”的闭环逻辑,从宏观动态变化到微观分子机制系统揭示调控网络。
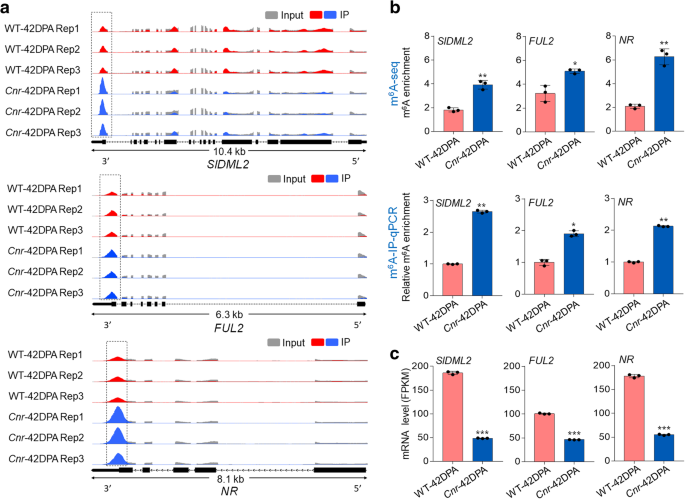
3.1 果实成熟过程中DNA甲基化与m⁶A动态变化检测
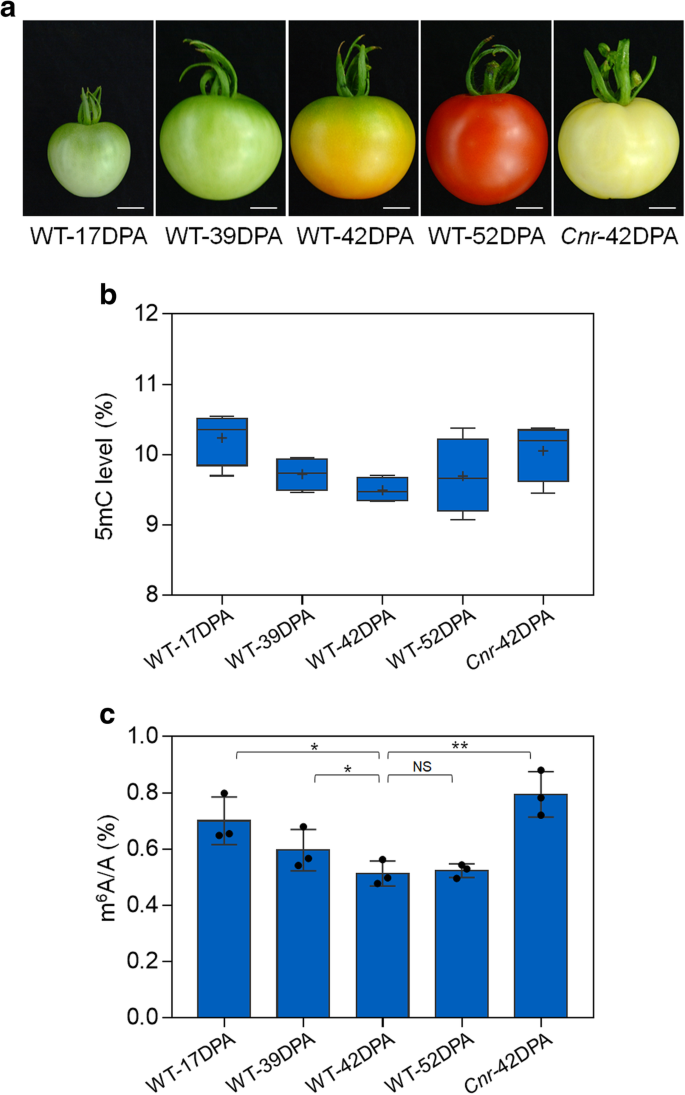
实验目的:明确野生型番茄果实成熟过程及成熟缺陷突变体中DNA甲基化与m⁶A修饰的变化趋势,初步探索两者关联。
方法细节:选取野生型番茄(Ailsa Craig)绿熟期(39天花后,DPA)、转色期(42 DPA)果实,以及成熟缺陷表观突变体Colorless non-ripening(Cnr)42 DPA果实,采用MethylFlash™甲基化DNA定量试剂盒检测基因组DNA中5mC相对水平(每个样本取100 ng基因组DNA,以阳性对照归一化);采用液相色谱-串联质谱(LC-MS/MS)检测mRNA中m⁶A含量,每个处理设置3次生物学重复。
结果解读:野生型果实从绿熟到转色过程中,5mC水平显著下降(n=3,P<0.01),m⁶A水平也显著下降(n=3,P<0.01);Cnr突变体果实的5mC水平显著高于野生型42 DPA果实(n=3,P<0.01),m⁶A水平同样显著高于野生型(n=3,P<0.01),说明DNA甲基化与m⁶A修饰在果实成熟中呈现同步动态变化,推测存在直接调控关联。
产品关联:实验所用关键产品:MethylFlash™甲基化DNA定量试剂盒(Epigentek, P-1034)、Dynabeads mRNA纯化试剂盒(Life Technologies, 61006)、Nuclease P1(Wako, 145-08221)、碱性磷酸酶(Sigma-Aldrich, P6774)、Waters ACQUITY UPLC系统、Triple Quad Xevo TQ-S质谱仪。
3.2 番茄果实m⁶A甲基组图谱绘制与特征分析
实验目的:解析番茄果实中m⁶A修饰的全基因组分布特征,以及成熟过程和Cnr突变体中的差异修饰模式。
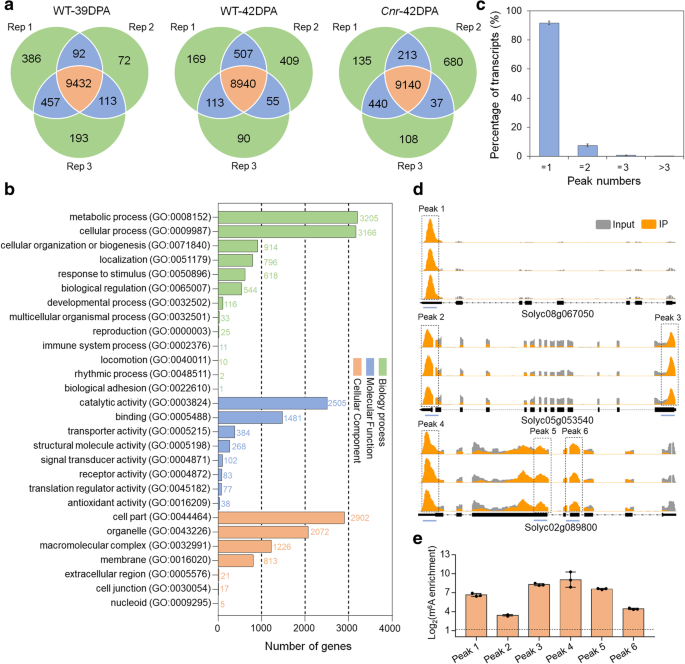
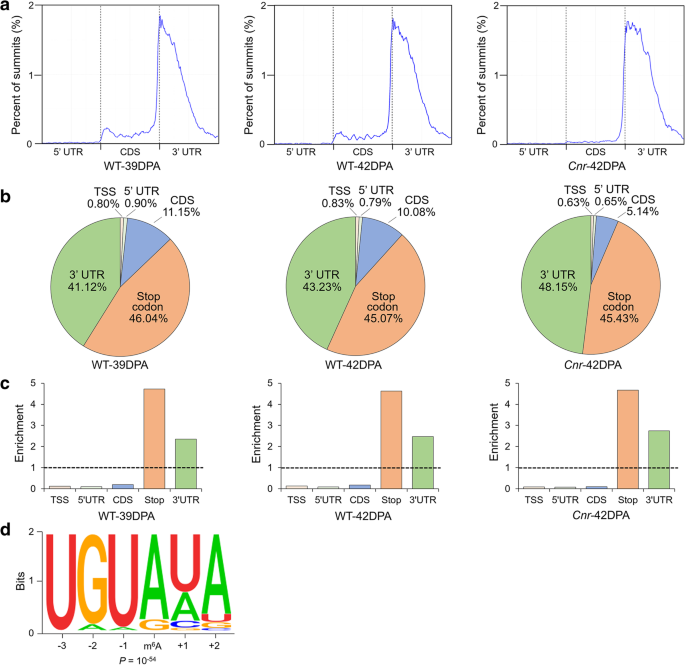
方法细节:对野生型39 DPA、42 DPA和Cnr 42 DPA果实进行m⁶A-seq分析,每个样本3次生物学重复;将mRNA片段化为约100 nt寡核苷酸,用抗m⁶A多克隆抗体进行免疫沉淀,分别构建输入对照和免疫沉淀片段的测序文库,进行高通量测序;采用MACS软件鉴定m⁶A峰(FDR<0.05),仅保留3次重复中均检测到的高置信峰进行后续分析;同时采用m⁶A-免疫沉淀-实时荧光定量PCR(m⁶A-IP-qRT-PCR)验证测序结果。
结果解读:番茄果实mRNA中普遍存在m⁶A修饰,约0.5-0.6个m⁶A峰/活跃转录本,与拟南芥和哺乳动物中的水平相当;m⁶A峰主要富集在终止密码子附近和3"非翻译区(3"UTR),序列基序为UGUAYY(Y代表A/G/U/C),与拟南芥中的基序保守;成熟过程中共有401个转录本的m⁶A水平发生显著变化,Cnr突变体与野生型相比有1241个转录本的m⁶A水平显著变化,其中1107个转录本的m⁶A水平升高,仅134个降低,呈现全基因组m⁶A水平升高的特征;进一步分析显示m⁶A修饰水平与转录本丰度呈负相关,即m⁶A水平升高的转录本其表达量通常降低。
产品关联:实验所用关键产品:抗m⁶A多克隆抗体(Synaptic Systems, 202003)、Dynabeads Protein-A(Life Technologies, 10002A)、NEBNext ultra RNA文库构建试剂盒(NEB, E7530)、Illumina HiSeq X测序平台。
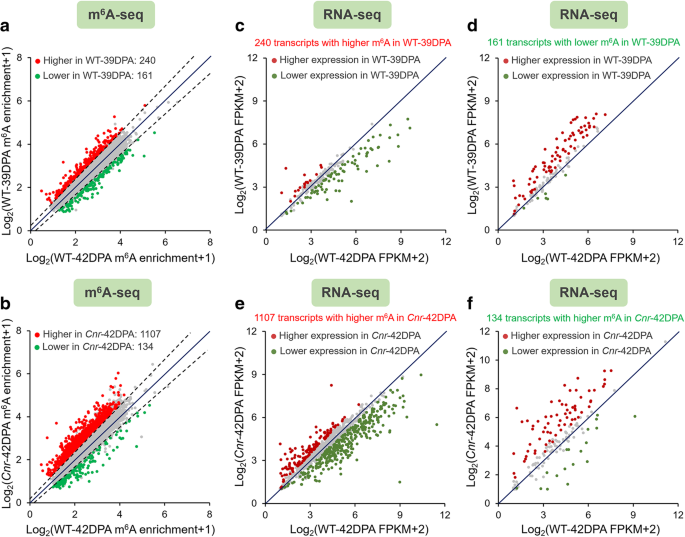
3.3 成熟关键基因的m⁶A修饰验证
实验目的:锁定受m⁶A修饰调控的果实成熟核心基因,明确其修饰变化与表达的关联。
方法细节:从m⁶A-seq差异修饰转录本中筛选已知成熟关键基因,包括DNA去甲基化酶SlDML2、MADS-box转录因子FUL2、乙烯受体NR;采用m⁶A-IP-qRT-PCR验证这些基因mRNA的m⁶A富集水平,同时通过RNA-seq检测其转录本丰度。
结果解读:SlDML2、FUL2、NR的mRNA在Cnr突变体中的m⁶A富集水平显著高于野生型(n=3,P<0.05),而其转录本丰度显著低于野生型(n=3,P<0.01),进一步验证了m⁶A修饰与转录本丰度的负相关关系,提示这些成熟关键基因的表达可能受m⁶A修饰的转录后调控。
产品关联:同前序m⁶A-IP-qRT-PCR实验产品。
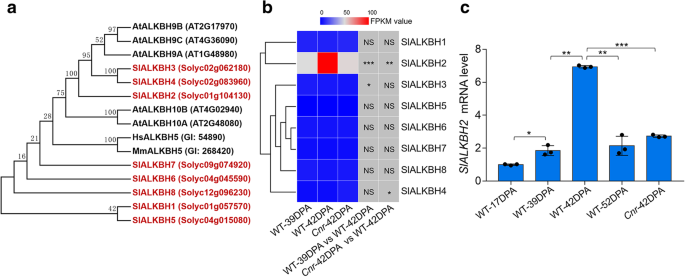
3.4 m⁶A去甲基化酶SlALKBH2的筛选与表达调控验证
实验目的:筛选参与果实成熟的m⁶A去甲基化酶,并验证其表达受DNA甲基化的调控。
方法细节:通过同源比对在番茄基因组中鉴定ALKBH家族基因,共获得8个候选基因(SlALKBH1-SlALKBH8);通过RNA-seq和qRT-PCR分析这些基因在野生型果实成熟过程和Cnr突变体中的表达模式;利用番茄表观基因组数据库分析SlALKBH2启动子区域的DNA甲基化水平;构建SlALKBH2启动子的双荧光素酶报告载体,与SlDML2表达载体共转化本氏烟草叶片,检测启动子活性和甲基化水平。
结果解读:SlALKBH2是唯一在野生型果实成熟过程中表达显著上调(n=3,P<0.01)、在Cnr突变体中显著下调(n=3,P<0.01)的ALKBH家族基因;SlALKBH2启动子区域存在一个差异甲基化区域(DMR),在Cnr和sldml2突变体中该区域呈高甲基化状态;双荧光素酶实验显示,SlDML2共表达能显著提高SlALKBH2启动子的活性(n=6,P<0.0001),并降低其甲基化水平(n=41,P<0.05),说明SlALKBH2的表达受DNA甲基化调控,且SlDML2介导的DNA去甲基化是其表达上调的关键原因。
产品关联:实验所用关键产品:双荧光素酶报告载体pGreenII-0800-LUC、pCambia2300-MCS-HA载体、农杆菌GV3101、EZ DNA甲基化-gold试剂盒(ZYMO Research, D5005)。
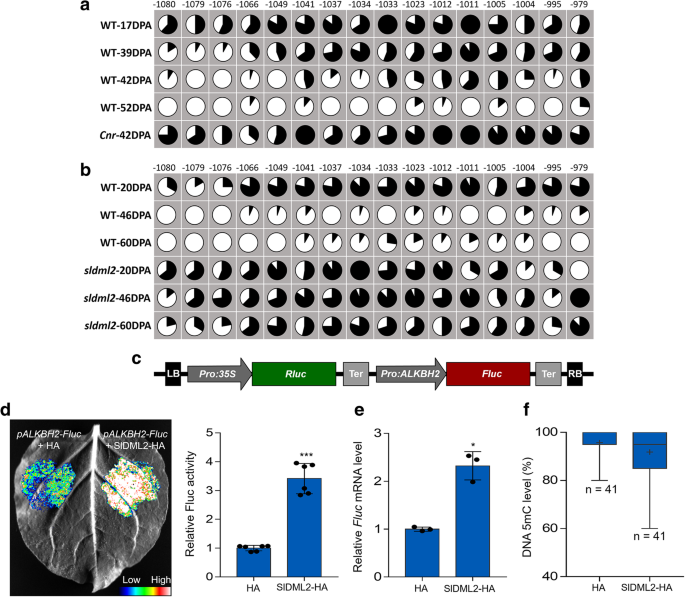
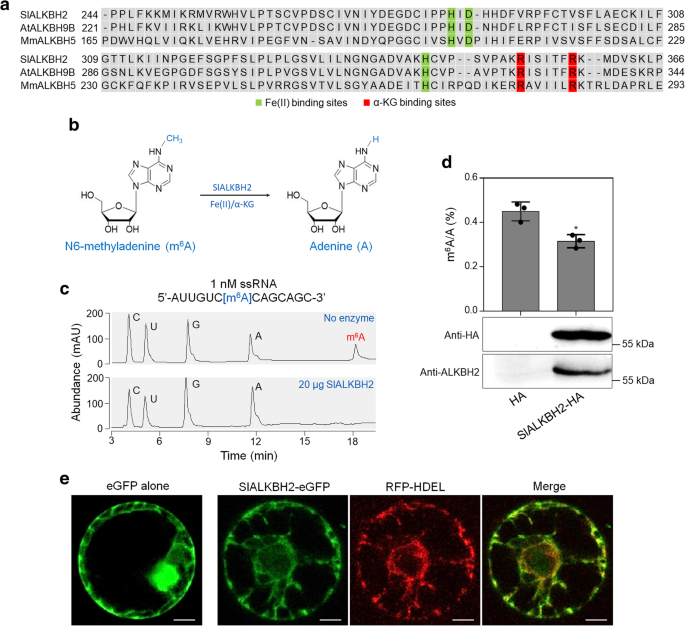
3.5 SlALKBH2的m⁶A去甲基化活性与亚细胞定位验证
实验目的:验证SlALKBH2的m⁶A去甲基化酶活性及其在细胞内的定位。
方法细节:构建SlALKBH2的原核表达载体,在大肠杆菌BL21(DE3)中表达重组His标签蛋白,纯化后与m⁶A修饰的ssRNA底物孵育,采用高效液相色谱(HPLC)检测去甲基化效果;构建SlALKBH2-HA融合蛋白载体,瞬时转化本氏烟草叶片,采用LC-MS/MS检测叶片中总mRNA的m⁶A水平;构建SlALKBH2-eGFP融合蛋白载体,与内质网(ER)标记RFP-HDEL共转化本氏烟草叶片,分离原生质体后用共聚焦显微镜观察荧光信号。
结果解读:体外实验显示SlALKBH2能有效去除ssRNA中的m⁶A修饰,底物中的m⁶A几乎完全转化为腺苷;瞬时表达SlALKBH2的本氏烟草叶片中总mRNA的m⁶A水平显著低于对照(n=3,P<0.05),证实其体内去甲基化活性;共聚焦显微镜观察显示SlALKBH2-eGFP的荧光信号与ER标记RFP-HDEL完全共定位,说明SlALKBH2定位于内质网。
产品关联:实验所用关键产品:pET30a(+)-His-MCS载体、MiRNeasy mini试剂盒(Qiagen, 217004)、Leica共聚焦显微镜(Leica, DMI600CS)。
3.6 SlALKBH2对SlDML2 mRNA稳定性的调控验证
实验目的:验证SlALKBH2通过m⁶A去甲基化调控SlDML2 mRNA的稳定性。
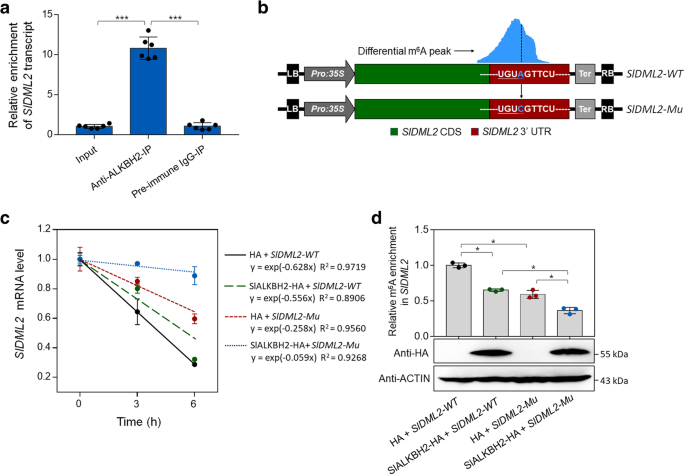
方法细节:采用RNA免疫沉淀(RIP)实验,用SlALKBH2特异性抗体免疫沉淀番茄果实中的RNA-蛋白复合物,通过qRT-PCR检测SlDML2 mRNA的富集水平;构建SlDML2的野生型和m⁶A位点突变型(A→C)的表达载体,与SlALKBH2表达载体共转化本氏烟草叶片,用转录抑制剂放线菌素D处理后,检测SlDML2 mRNA的降解速率;采用m⁶A-IP-qRT-PCR检测SlDML2 mRNA的m⁶A水平。
结果解读:RIP实验显示SlALKBH2抗体免疫沉淀的复合物中SlDML2 mRNA的富集水平显著高于IgG对照(n=6,P<0.001),说明SlALKBH2能特异性结合SlDML2 mRNA;放线菌素D处理后,野生型SlDML2 mRNA的降解速率显著高于突变型,而SlALKBH2共表达能显著减缓野生型SlDML2 mRNA的降解;同时SlALKBH2共表达能显著降低SlDML2 mRNA的m⁶A水平(n=3,P<0.05),说明SlALKBH2通过去除SlDML2 mRNA的m⁶A修饰提高其稳定性。
产品关联:实验所用关键产品:SlALKBH2多克隆抗体、放线菌素D(Sigma, A4262)、QuikChange II XL定点突变试剂盒(Agilent Technologies, 200518)。
3.7 SlALKBH2在果实成熟中的功能验证
实验目的:验证SlALKBH2对番茄果实成熟的调控作用。
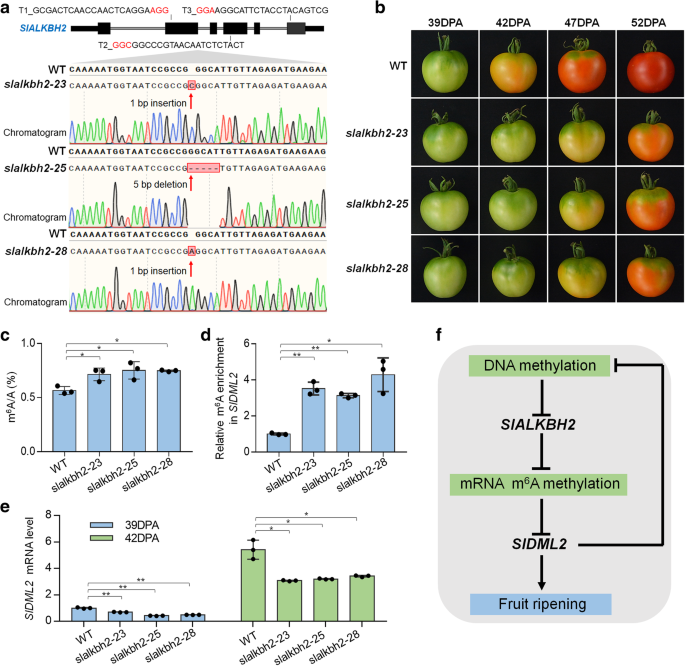
方法细节:采用CRISPR/Cas9基因编辑系统,设计3个靶向SlALKBH2外显子的单向导RNA(sgRNA),构建编辑载体并转化野生型番茄,获得T2代纯合突变体slalkbh2-23(1 bp插入)、slalkbh2-25(5 bp缺失)、slalkbh2-28(1 bp插入);观察突变体果实在39、42、47、52 DPA的成熟表型;采用LC-MS/MS检测突变体果实的总m⁶A水平,采用m⁶A-IP-qRT-PCR检测SlDML2 mRNA的m⁶A水平,采用qRT-PCR检测SlDML2的表达量。
结果解读:3个slalkbh2突变体的果实成熟均显著延迟,42 DPA时野生型果实已转色,而突变体仍为绿色,47 DPA时突变体才开始转色;突变体果实的总m⁶A水平显著高于野生型(n=3,P<0.05),SlDML2 mRNA的m⁶A水平显著升高(n=3,P<0.05),SlDML2的表达量显著低于野生型(n=3,P<0.01),说明SlALKBH2通过调控SlDML2的表达参与果实成熟的调控,是果实正常成熟所必需的基因。
产品关联:实验所用关键产品:pYLCRISPR/Cas9Pubi-H载体、农杆菌GV3101。
4. Biomarker研究及发现成果解析
本文中鉴定的核心Biomarker是SlDML2 mRNA的3"UTR区域m⁶A修饰位点,该位点作为果实成熟的表观调控标记,通过调控SlDML2 mRNA的稳定性参与果实成熟的调控网络。
Biomarker定位:该m⁶A修饰位点属于转录后表观标记,筛选与验证逻辑为:首先通过m⁶A-seq在番茄果实成熟过程和Cnr突变体中筛选差异m⁶A修饰的成熟关键基因,锁定SlDML2的3"UTR区域m⁶A位点;然后通过m⁶A-IP-qRT-PCR在细胞系(本氏烟草)和番茄突变体中验证该位点的富集水平与果实成熟状态的关联;最后通过定点突变实验验证该位点对SlDML2 mRNA稳定性的调控作用,形成完整的筛选-验证逻辑链条。
研究过程详述:该m⁶A修饰位点来源于番茄果实的mRNA样本,验证方法包括m⁶A-IP-qRT-PCR、定点突变和mRNA稳定性检测;特异性方面,该位点的m⁶A修饰水平仅在成熟相关基因中呈现显著差异,且与SlALKBH2的表达水平负相关,在成熟缺陷突变体中显著升高;敏感性方面,该位点的m⁶A水平变化能精准反映果实成熟阶段,野生型42 DPA果实中该位点的m⁶A水平比39 DPA降低1.5倍(n=3,P<0.05),而slalkbh2突变体39 DPA果实中该位点的m⁶A水平比野生型升高1.8倍(n=3,P<0.05)。
核心成果提炼:该m⁶A修饰位点的功能关联在于,其修饰水平直接调控SlDML2 mRNA的稳定性,进而影响SlDML2介导的DNA去甲基化过程,最终调控果实成熟;创新性在于首次在植物中发现DNA去甲基化酶的mRNA受m⁶A修饰调控,建立了“DNA甲基化-m⁶A修饰-mRNA稳定性”的反馈调控回路;统计学结果显示,该位点的m⁶A水平与SlDML2表达量呈显著负相关(r=-0.87,P<0.01),与果实成熟阶段呈显著负相关(r=-0.91,P<0.001)。该Biomarker为果实成熟的精准调控提供了新的靶点,可用于果实成熟状态的检测和调控技术的开发。
