1. 领域背景与文献引入
文献英文标题:Plasma ALS and Gal-3BP differentiate early from advanced liver fibrosis in MASLD patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:代谢功能障碍相关脂肪性肝病(MASLD)肝纤维化非侵入性生物标志物研究。
领域共识:MASLD是全球范围内患病率最高的慢性肝病之一,约影响全球30%的人口,其患病率随肥胖症流行率上升而持续增加。肝纤维化是MASLD进展至肝硬化、肝细胞癌的关键中间阶段,与患者死亡率直接相关,是临床评估MASLD严重程度和制定治疗方案的核心指标。目前肝纤维化的金标准诊断方法是肝活检,但该方法属于侵入性操作,存在取样误差、组织学重复性低、患者依从性差等局限性,无法满足大规模筛查和早期诊断的需求。过去15年间,学界开发了多种非侵入性肝纤维化评估方法,包括基于临床指标的复合评分(如FibroTest、MASLD纤维化评分)和基于血清标志物的检测(如增强肝纤维化ELF测试),但这些方法的诊断性能仍未达到替代肝活检的水平,且部分方法依赖复杂的检测技术或多参数模型,难以在基层医疗机构推广。因此,寻找特异性高、检测简便、可临床转化的非侵入性生物标志物,是当前MASLD肝纤维化研究领域的核心未解决问题。本研究正是针对这一空白,采用质谱蛋白质组学技术筛选血浆中的差异表达蛋白,通过两个独立队列验证了ALS和Gal-3BP在区分MASLD早期与晚期肝纤维化中的诊断价值,为临床提供了新的非侵入性诊断工具。
2. 文献综述解析
本文综述部分以MASLD肝纤维化诊断方法的发展脉络为核心分类维度,系统梳理了从侵入性活检到非侵入性生物标志物的研究进展,明确了现有研究的优势、局限性及领域研究空白。
作者首先总结了现有研究的关键结论,即肝纤维化是MASLD患者预后的核心决定因素,准确区分早期(F0-2)与晚期(F3-4)肝纤维化对患者管理至关重要;肝活检作为金标准存在诸多局限,非侵入性诊断方法是领域研究的重点方向。现有非侵入性方法中,基于临床指标和血清标志物的复合评分如FibroTest、ELF测试等,其诊断性能接近肝活检,但仍存在AUROC值不足、特异性有限等问题,且部分方法的验证队列规模较小,缺乏多中心独立验证;近年来兴起的质谱蛋白质组学技术为生物标志物筛选提供了高通量手段,但多数研究仅停留在发现阶段,缺乏经过严格验证且可快速临床转化的标志物。作者进一步指出,现有研究的核心局限性在于缺乏兼具高诊断性能、检测简便性和临床可及性的生物标志物,这也是本研究的核心切入点。与现有研究相比,本研究的创新价值在于首次在两个大样本独立队列中系统验证了ALS和Gal-3BP的诊断价值,且这两个标志物均有商业化ELISA试剂盒,可直接应用于临床检测;同时,本研究构建的ALS与Gal-3BP组合模型的诊断性能优于现有多数非侵入性方法,为MASLD肝纤维化的早期诊断提供了新的技术方案。
3. 研究思路总结与详细解析
本研究的整体研究目标是筛选并验证可有效区分MASLD早期与晚期肝纤维化的血浆生物标志物,核心科学问题是寻找兼具高特异性与临床可及性的非侵入性肝纤维化诊断标志物,技术路线遵循“发现-验证-独立确认-性能比较”的闭环逻辑,通过质谱蛋白质组学筛选差异蛋白,ELISA技术验证,最终构建并评估组合生物标志物模型的诊断性能。
3.1 研究队列构建与样本制备
实验目的是建立具有明确组织学诊断的MASLD患者队列,为生物标志物的筛选和验证提供标准化的临床样本。方法细节为分别在法国Grenoble医院和Angers医院招募经肝活检确诊的MASLD患者,其中Grenoble队列158例(用于发现和初步验证),Angers队列200例(用于独立验证);纳入标准为临床怀疑MASLD且经临床化学分析和影像学检查提示存在晚期纤维化风险,排除使用致脂肪肝药物、过量饮酒、合并其他慢性肝病(如乙肝、丙肝)的患者;肝活检后数分钟至数小时内采集EDTA抗凝静脉血,离心分离血浆后-80℃保存;样本处理时使用Well Plate Maker软件进行随机分布,以减少批次效应,随后对血浆蛋白进行变性、还原、烷基化处理,采用胰蛋白酶/Lys-C混合酶进行酶解。结果解读显示,两个队列的患者在肝纤维化分期(F0-2与F3-4)上分布均衡,部分临床指标如年龄、AST、ALT等存在统计学差异,但作者通过卡方检验和分层分析证实,队列间的肝组织学特征分布具有一致性,确保了生物标志物验证结果的可靠性。实验所用关键产品:文献未提及具体实验产品,领域常规使用EDTA采血管、胰蛋白酶/Lys-C混合酶解试剂、Well Plate Maker样本随机化软件等。
3.2 质谱蛋白质组学分析与差异蛋白筛选
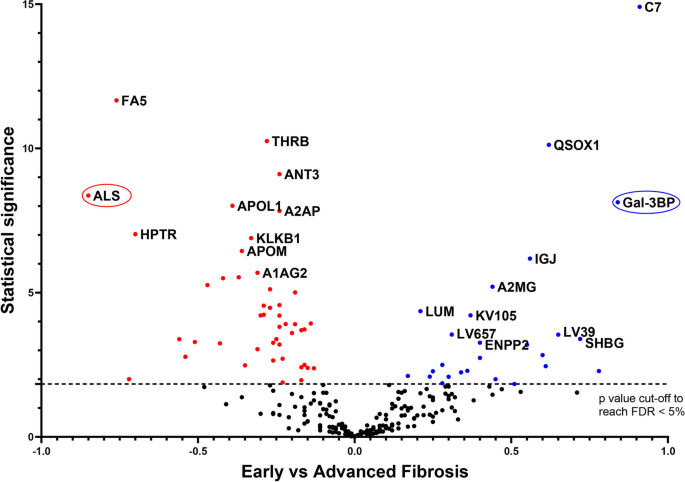
实验目的是从发现队列的血浆样本中筛选出与MASLD肝纤维化分期相关的差异表达蛋白。方法细节为采用纳升液相色谱-串联质谱(LC-MS/MS)技术进行非标记定量蛋白质组学分析,数据采集模式为数据依赖采集;使用Mascot Distiller软件进行数据预处理,Mascot软件对肽段和蛋白进行鉴定,鉴定数据库包括Swiss-Prot人类蛋白数据库、自建污染蛋白数据库及其反向数据库;采用Proline软件合并所有患者的蛋白鉴定数据,过滤后保留至少包含2条特异性肽段的蛋白;使用Prostar软件进行统计分析,先对蛋白丰度数据进行log2转换和方差稳定归一化,采用结构化最小二乘自适应(SLSA)方法填充缺失值,最后通过Limma检验筛选早期与晚期纤维化患者间的差异表达蛋白,采用Benjamini-Hochberg方法校正假发现率(FDR),以FDR<5%为差异蛋白筛选标准。结果解读显示,本研究共鉴定并定量了235种在至少70%的样本中存在的血浆蛋白,最终筛选出72种在早期与晚期纤维化患者中差异表达的蛋白,其中26种蛋白在晚期纤维化患者血浆中丰度升高,46种蛋白丰度降低。
3.3 ELISA验证与独立队列确认
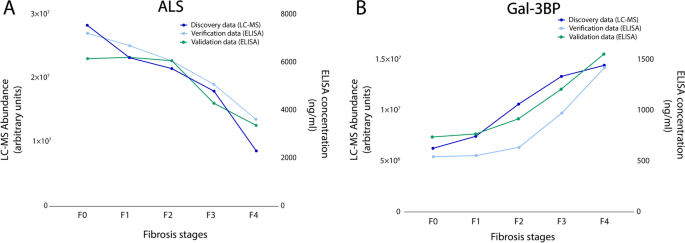
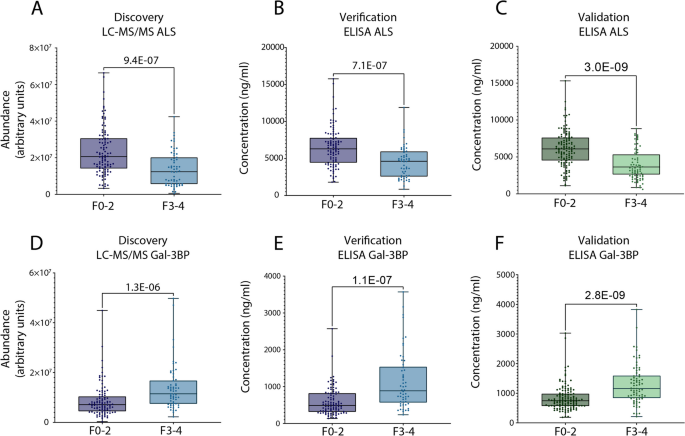
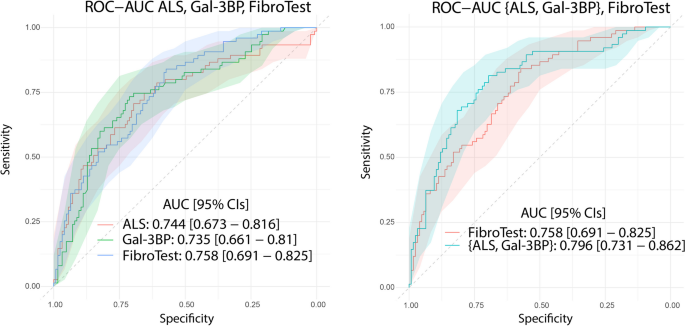
实验目的是验证质谱筛选得到的差异蛋白的诊断性能,并在独立队列中确认其有效性。方法细节为基于差异蛋白的丰度变化幅度和商业化ELISA试剂盒的可用性,选择胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS)和半乳糖凝集素3结合蛋白(Gal-3BP)进行后续验证;首先在Grenoble发现队列的158例样本中,采用ELISA技术检测两种蛋白的血浆浓度,验证其与质谱分析结果的一致性;随后在Angers独立验证队列的200例样本中,重复ELISA检测;采用Mann-Whitney检验比较早期与晚期纤维化患者中两种蛋白的浓度差异,通过受试者工作特征(ROC)曲线计算曲线下面积(AUROC)评估其诊断性能。结果解读显示,ELISA检测结果与质谱分析结果的趋势完全一致,即ALS在晚期纤维化患者血浆中浓度显著降低,Gal-3BP浓度显著升高;在独立验证队列中,ALS区分早期与晚期纤维化的AUROC为0.744(95%CI 0.673-0.816),Gal-3BP的AUROC为0.735(95%CI 0.661-0.81),Mann-Whitney检验显示两种蛋白在不同纤维化分期患者中的浓度差异均具有高度统计学显著性(ALS:P=3.0E-09,n=200;Gal-3BP:P=2.8E-09,n=200)。实验所用关键产品:商业化ALS和Gal-3BP ELISA试剂盒(文献未提及具体品牌及货号)。
3.4 组合生物标志物模型构建与性能比较
实验目的是构建基于ALS和Gal-3BP的组合诊断模型,并与现有非侵入性肝纤维化评估方法比较诊断性能。方法细节为采用逻辑回归模型将ALS和Gal-3BP的血浆浓度进行组合,在Angers验证队列中计算组合模型的AUROC;同时,将单标志物、组合模型的AUROC与现有常用方法(如FibroTest、FIB-4、NFS、FibroQ等)进行比较。结果解读显示,ALS与Gal-3BP的组合模型区分早期与晚期肝纤维化的AUROC为0.796(95%CI 0.731-0.862),显著高于单标志物的诊断性能,且优于FibroTest(AUROC=0.758)、FIB-4、NFS等多数现有方法,仅略低于Fibroscan。这一结果表明,组合模型的诊断性能更优,可为临床提供更准确的肝纤维化分期信息。
4. Biomarker研究及发现成果解析
本研究筛选并验证的核心Biomarker为血浆中的ALS和Gal-3BP,二者均为与MASLD肝纤维化病理生理过程密切相关的分泌蛋白,其筛选与验证遵循“高通量发现-初步验证-独立队列确认”的完整逻辑链条。
Biomarker定位方面,ALS是胰岛素样生长因子(IGF)结合蛋白复合物的组成部分,参与IGF的转运和稳定性调节;Gal-3BP是一种分泌型糖蛋白,参与免疫调节、细胞外基质相互作用等病理生理过程。二者的筛选逻辑为:首先通过质谱蛋白质组学在发现队列中筛选出与肝纤维化分期相关的差异表达蛋白,然后基于丰度变化幅度和检测方法的可及性选择候选标志物,最后通过两个独立队列的ELISA验证确认其诊断价值。研究过程详述:Biomarker的来源为经肝活检确诊的MASLD患者的血浆样本,验证方法为商业化ELISA试剂盒定量检测;特异性与敏感性数据显示,在独立验证队列中,ALS的AUROC为0.744(95%CI 0.673-0.816),Gal-3BP的AUROC为0.735(95%CI 0.661-0.81),组合模型的AUROC为0.796(95%CI 0.731-0.862),Mann-Whitney检验证实两种蛋白在早期与晚期纤维化患者中的浓度差异具有高度统计学显著性(P值均小于1E-08,n=200)。核心成果提炼:本研究首次在两个大样本独立队列中系统验证了ALS和Gal-3BP作为MASLD肝纤维化分期生物标志物的诊断价值,二者的组合模型可有效区分早期与晚期肝纤维化,性能优于现有多数非侵入性诊断方法;此外,两种标志物均有商业化ELISA试剂盒,检测方法简便、成本较低,具备快速临床转化的潜力。从功能关联来看,ALS的降低可能与MASLD患者的胰岛素抵抗和代谢紊乱相关,Gal-3BP的升高可能与肝纤维化过程中的免疫激活和细胞外基质重塑相关,为进一步探索MASLD肝纤维化的发病机制提供了新的线索。
