1. 领域背景与文献引入
文献英文标题:Comprehensive analysis of peroxiredoxins expression profiles and prognostic values in breast cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学-乳腺癌生物标志物研究
乳腺癌是全球女性发病率最高的恶性肿瘤,2019年美国癌症协会预测当年将有41760例患者死于该疾病。乳腺癌是一种高度异质性的疾病,根据雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)和Ki-67的表达状态可分为不同分子亚型,各亚型的治疗响应和预后差异显著。氧化应激在肿瘤的发生、发展中发挥关键作用,过氧化物还原酶(PRDXs)是一类重要的抗氧化酶家族,包含PRDX1至PRDX6六个亚型,能够催化过氧化氢的还原反应,维持细胞内氧化还原稳态。现有研究表明PRDXs在多种肿瘤中表达失调,部分亚型具有促癌或抑癌的双重功能,但在乳腺癌中,PRDX家族各亚型的系统表达谱及预后价值尚未明确,缺乏针对不同分子亚型和化疗方案的亚组分析,因此本研究通过生物信息学方法系统探究PRDXs在乳腺癌中的临床意义,具有重要的学术价值。
2. 文献综述解析
作者对领域内现有研究的分类维度为PRDX各亚型在不同肿瘤中的功能及预后价值,分别梳理了单个亚型在乳腺癌及其他肿瘤中的研究结论。现有研究显示,PRDX1在乳腺癌中与肿瘤分级正相关,靶向PRDX1可抑制乳腺癌细胞生长;PRDX2参与乳腺癌细胞的化疗耐药及肺转移的氧化应激调控;PRDX3在MCF-7细胞中具有抑癌作用,下调PRDX3可增强PP2诱导的细胞凋亡;PRDX4可促进乳腺癌细胞诱导的破骨细胞活化,增强骨转移潜能;PRDX5和PRDX6在卵巢癌、子宫内膜癌等其他肿瘤中具有预后价值,但在乳腺癌中的研究较为匮乏。现有研究的优势在于部分揭示了单个PRDX亚型的功能机制,局限性在于未系统分析整个PRDX家族在乳腺癌中的表达差异,也未明确各亚型在不同分子亚型、不同化疗方案中的预后价值,缺乏对PRDX家族作为乳腺癌生物标志物的系统评估。本研究的创新点在于首次通过多数据库联合分析,系统阐述PRDX家族六个亚型在乳腺癌中的转录表达谱、基因拷贝数变异对表达的调控作用,以及在全人群、不同分子亚型、不同化疗方案中的预后价值,填补了领域内对PRDX家族在乳腺癌中系统研究的空白。
3. 研究思路总结与详细解析
本研究的核心目标是系统分析PRDX家族在乳腺癌中的表达谱及预后价值,核心科学问题是PRDX各亚型在乳腺癌中的表达特征、基因拷贝数变异对表达的调控,以及作为预后生物标志物的潜在价值,技术路线遵循“表达差异分析-基因变异关联分析-预后价值验证-亚组分层分析”的闭环逻辑。
3.1 PRDX家族转录表达谱分析
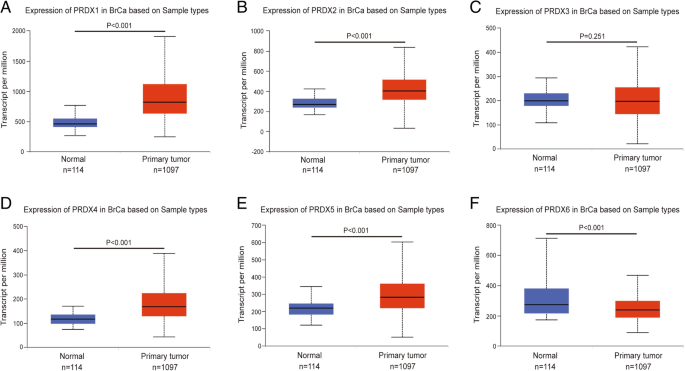
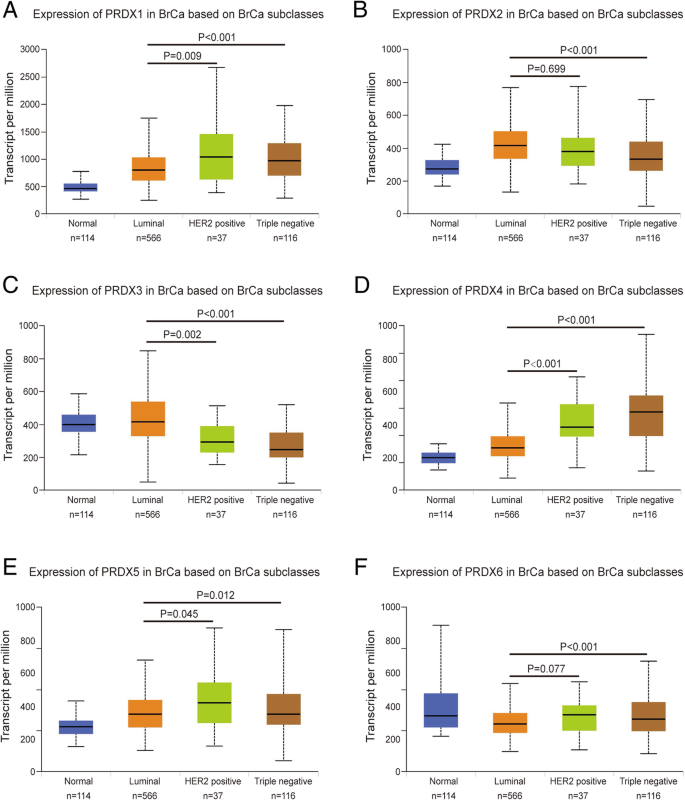
实验目的是明确PRDX各亚型在乳腺癌组织与癌旁正常组织的表达差异,以及与乳腺癌分子亚型的关联。方法细节上,研究采用UALCAN在线数据库,基于癌症基因组图谱(TCGA)的RNA-seq数据,纳入1097例乳腺癌组织和114例癌旁正常组织样本,分析PRDX1至PRDX6的转录水平差异,并进一步探究其在luminal、HER2阳性、三阴性等不同分子亚型中的表达特征,采用Student’s t-test进行统计学分析。结果解读显示,PRDX1、PRDX2、PRDX4、PRDX5的转录水平在乳腺癌组织中显著上调(P<0.001),PRDX6的转录水平显著下调(P<0.001),而PRDX3的表达在乳腺癌与癌旁组织中无显著差异(P=0.251);在分子亚型层面,HER2阳性和三阴性乳腺癌组织中PRDX1、PRDX4、PRDX5、PRDX6的表达显著高于luminal亚型,PRDX2、PRDX3的表达则显著低于luminal亚型。文献未提及具体实验产品,领域常规使用生物信息学分析平台(如UALCAN、TCGA数据库)及统计分析软件(如SPSS)。
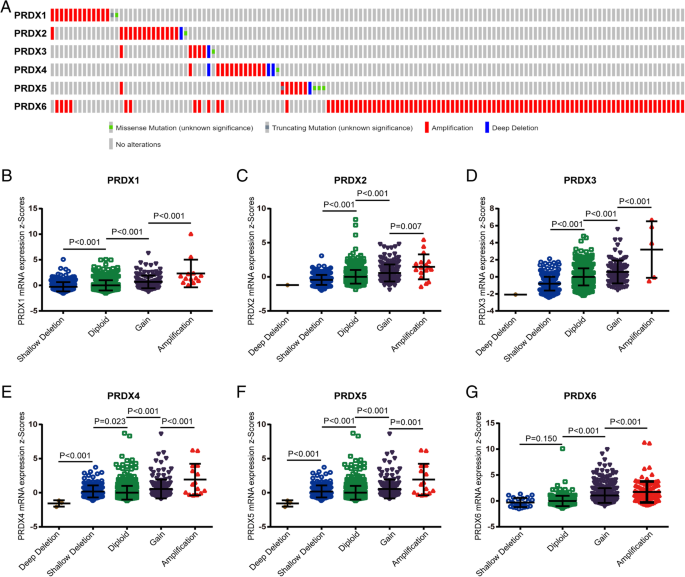
3.2 PRDX家族基因拷贝数变异与表达的关联分析
实验目的是探究基因拷贝数变异(CNA)对PRDXs转录表达的调控作用。方法细节上,研究采用cBioPortal在线数据库,纳入1076例具有RNA-seq和拷贝数变异数据的乳腺癌样本,分析PRDX1至PRDX6的基因拷贝数变异类型(扩增、增益、缺失)及其与mRNA表达水平的关联。结果解读显示,PRDXs的拷贝数增益(扩增和增益)发生率虽不高,但与mRNA表达水平显著正相关,即拷贝数增益样本的PRDXs mRNA表达显著高于拷贝数正常或缺失的样本;其中PRDX6的拷贝数增益比例相对较高,但在乳腺癌组织中表达却显著下调,推测可能是由于TCGA数据库中正常组织样本量有限导致的统计偏差。文献未提及具体实验产品,领域常规使用cBioPortal等癌症基因组数据分析平台。
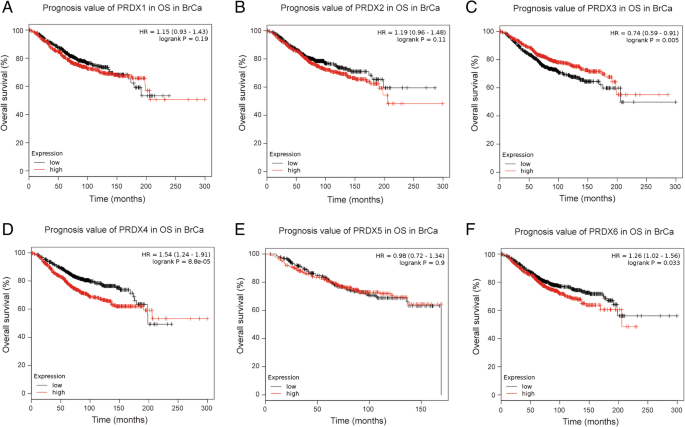
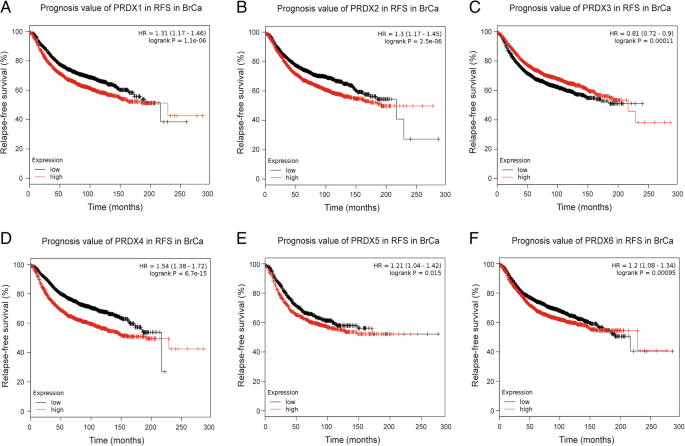
3.3 PRDX家族的预后价值分析
实验目的是明确PRDXs mRNA表达与乳腺癌患者总生存期(OS)和无复发生存期(RFS)的关联,以及在不同分子亚型和化疗方案中的预后差异。方法细节上,研究采用Kaplan-Meier Plotter在线数据库,将患者按各PRDX亚型的mRNA表达中位数分为高表达组和低表达组,绘制生存曲线并采用log-rank检验比较组间差异,计算风险比(HR)及95%置信区间(95% CI);同时进一步进行亚组分析,包括不同分子亚型(luminal A、luminal B、HER2阳性、基底样)和不同化疗方案(辅助化疗、新辅助化疗、无化疗)。结果解读显示,在全人群中,PRDX4(HR=1.54,95% CI:1.24-1.91,P<0.001)和PRDX6(HR=1.26,95% CI:1.02-1.56,P=0.033)高表达与不良OS相关,PRDX3高表达与良好OS相关(HR=0.74,95% CI:0.59-0.91,P=0.005);PRDX1、PRDX2、PRDX4、PRDX5、PRDX6高表达与较短RFS相关(HR分别为1.31、1.30、1.54、1.21、1.20,均P<0.05),PRDX3高表达与较长RFS相关(HR=0.81,95% CI:0.72-0.90,P<0.001)。亚组分析显示,PRDX1、PRDX4、PRDX6高表达在luminal A亚型中与不良OS相关,PRDX4在luminal B亚型中与不良OS相关;PRDX1、PRDX2、PRDX4、PRDX6高表达在luminal亚型中与不良RFS相关,PRDX3低表达和PRDX5高表达在基底样亚型中与不良RFS相关;在辅助化疗患者中,PRDX1、PRDX2、PRDX3、PRDX4高表达与不良OS相关,在无化疗患者中,PRDX1、PRDX4、PRDX6高表达和PRDX3低表达与不良RFS相关,而PRDX5高表达在辅助化疗患者中与良好RFS相关。文献未提及具体实验产品,领域常规使用Kaplan-Meier Plotter等生存分析平台及统计分析软件。
4. Biomarker研究及发现成果解析
本研究筛选的Biomarker为PRDX家族中的PRDX3、PRDX4、PRDX6,属于基因表达类生物标志物,筛选及验证逻辑遵循“转录表达差异分析-基因变异关联分析-全人群预后验证-亚组分层验证”的完整链条,先通过UALCAN数据库明确表达差异,再通过cBioPortal分析基因拷贝数变异对表达的调控,最后通过Kaplan-Meier Plotter验证其预后价值及亚型特异性。
研究过程中,Biomarker的来源为TCGA数据库的乳腺癌组织转录组数据及临床生存数据,验证方法为Kaplan-Meier生存分析,通过比较高低表达组的生存差异评估其预后价值。特异性与敏感性方面,PRDX4高表达预测不良OS的HR为1.54(95% CI:1.24-1.91,P<0.001),PRDX6为1.26(95% CI:1.02-1.56,P=0.033),PRDX3高表达预测良好OS的HR为0.74(95% CI:0.59-0.91,P=0.005);在RFS方面,PRDX4高表达的HR为1.54(95% CI:1.38-1.72,P<0.001),PRDX3高表达的HR为0.81(95% CI:0.72-0.90,P<0.001),显示出较好的预后区分能力。
核心成果方面,PRDX3是潜在的抑癌生物标志物,高表达与乳腺癌患者的良好OS及RFS相关;PRDX4、PRDX6是促癌生物标志物,高表达与不良OS及RFS相关。同时,各Biomarker具有亚型特异性的预后价值,如PRDX1、PRDX4、PRDX6在luminal A亚型中具有不良OS预测价值,PRDX3在基底样亚型中具有不良RFS预测价值,PRDX5在辅助化疗患者中具有良好RFS预测价值。本研究首次系统揭示PRDX家族作为乳腺癌预后生物标志物的潜在价值,为乳腺癌的个体化预后评估及治疗靶点筛选提供了新的依据。
