1. 领域背景与文献引入
文献英文标题:Global mapping of RNA N⁶-methyladenosine (m⁶A) in human subcutaneous and visceral adipose tissue reveals novel targets that correlate with clinical variables of obesity;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肥胖与代谢病表观转录组学。
肥胖是全球重大公共卫生挑战,脂肪组织分布是代谢并发症的关键风险因素,内脏网膜脂肪组织(OVAT)的堆积较皮下脂肪组织(SAT)更易引发胰岛素抵抗、2型糖尿病等代谢紊乱。领域共识:现有研究已明确DNA甲基化、组蛋白修饰等表观遗传机制在脂肪组织调控中的作用,但表观转录组层面的RNA修饰(如m⁶A)在人类脂肪组织中的研究极为有限,仅存在涵盖单个样本的初步报道,缺乏系统的分部特异性m⁶A图谱,且m⁶A修饰与肥胖临床指标的关联尚未明确。本研究旨在填补这一空白,通过配对样本的m⁶A免疫沉淀测序(meRIP-seq)绘制人类皮下与内脏脂肪组织的m⁶A全局图谱,鉴定分部特异性及肥胖相关的m⁶A靶基因,验证其与肥胖临床变量的关联,并探索m⁶A的功能机制,为代谢疾病的Biomarker开发和治疗靶点提供新线索。
2. 文献综述解析
作者从脂肪组织分布与代谢风险、表观遗传调控脂肪组织、m⁶A修饰在代谢与肥胖中的作用三个维度对现有研究进行分类评述,系统梳理了领域进展与空白。
现有研究已证实脂肪组织分部是代谢风险的独立预测因子,内脏脂肪组织通过分泌促炎因子、影响脂质代谢等途径加剧代谢紊乱;表观遗传研究方面,全基因组DNA甲基化、组蛋白乙酰化等研究已鉴定出多个与脂肪分布相关的调控位点,为肥胖的表观治疗提供了潜在靶点;m⁶A修饰作为最丰富的mRNA修饰,已被证实参与脂肪生成、能量代谢等过程,肥胖相关基因FTO作为m⁶A去甲基化酶的功能也已明确,但人类脂肪组织的m⁶A研究仅包含单个死后样本的分析,缺乏系统的分部特异性研究,且未关联临床指标。现有技术方法中,m⁶A免疫沉淀测序已广泛应用于多种组织,但在人类脂肪组织中的应用存在样本量小、缺乏配对设计的局限性,无法揭示分部特异性的m⁶A调控模式。本研究的创新价值在于首次采用配对样本设计绘制人类皮下与内脏脂肪组织的m⁶A全局图谱,在大样本队列中验证分部特异性靶点,关联肥胖临床变量,并解析细胞类型特异性的m⁶A贡献及功能机制,填补了领域内人类脂肪组织表观转录组研究的关键空白。
3. 研究思路总结与详细解析
本研究以“绘制m⁶A图谱→鉴定差异靶点→验证临床关联→解析细胞类型贡献→探索功能机制”为闭环技术路线,核心研究目标是揭示人类脂肪组织分部特异性及肥胖相关的m⁶A调控模式,明确m⁶A与肥胖临床变量的关联,探索m⁶A对RNA代谢的调控作用。
3.1 研究队列构建与样本收集
实验目的:建立具有临床特征的发现队列与验证队列,获取配对的皮下脂肪组织与内脏网膜脂肪组织样本,为后续m⁶A分析提供基础。
方法细节:发现队列纳入10名肥胖女性(BMI≥35 kg/m²,来自减重手术)和3名正常体重女性(BMI≤25 kg/m²,来自胆囊切除术),所有样本为个体内配对的皮下与内脏脂肪组织;验证队列纳入72名肥胖患者(含25名男性、47名女性),同样为配对样本。收集所有受试者的临床指标,包括BMI、腰臀比、空腹血糖、HbA1c、甘油三酯等,样本采集后立即液氮冻存并转移至-80℃冰箱保存。
结果解读:发现队列中肥胖组的BMI、腰臀比、空腹血糖、HbA1c等指标显著高于正常体重组(n=13,P<0.05),验证队列的性别分布为后续分析性别对m⁶A分部差异的影响提供了数据支撑。
产品关联:文献未提及具体实验产品,领域常规使用组织保存液氮罐、临床生化检测试剂盒等。
3.2 m⁶A全局图谱绘制与差异靶点鉴定
实验目的:通过m⁶A免疫沉淀测序(meRIP-seq)绘制人类皮下与内脏脂肪组织的m⁶A全局图谱,鉴定分部特异性及肥胖相关的差异甲基化区域(DMRs)。
方法细节:对发现队列的配对样本进行m⁶A免疫沉淀测序与转录组测序,采用m⁶A抗体富集甲基化RNA片段,构建测序文库后在Illumina HiSeq4000平台进行双端150bp测序;生物信息学分析采用STAR软件将测序reads比对到人类基因组HG38,MeTPeak算法识别m⁶A峰,RADAR软件分析分部间及肥胖与正常体重组间的差异甲基化区域,同时进行基因本体(GO)富集分析。
结果解读:在皮下与内脏脂肪组织中平均鉴定到约12000个m⁶A峰,分布在约6000个蛋白编码基因和250个长非编码RNA中,m⁶A峰主要富集在终止密码子区、编码区和3"UTR区域,且保守的m⁶A修饰基因显著富集在代谢调控与转录调控通路(n=13,P<0.01)。进一步鉴定出339个具有分部特异性m⁶A甲基化的基因,其中内脏网膜脂肪组织中高甲基化的基因富集在细胞黏附、轴突导向等通路;83个基因在肥胖与正常体重组间存在差异甲基化,包括TSC22D1、IL1R1等代谢相关基因。
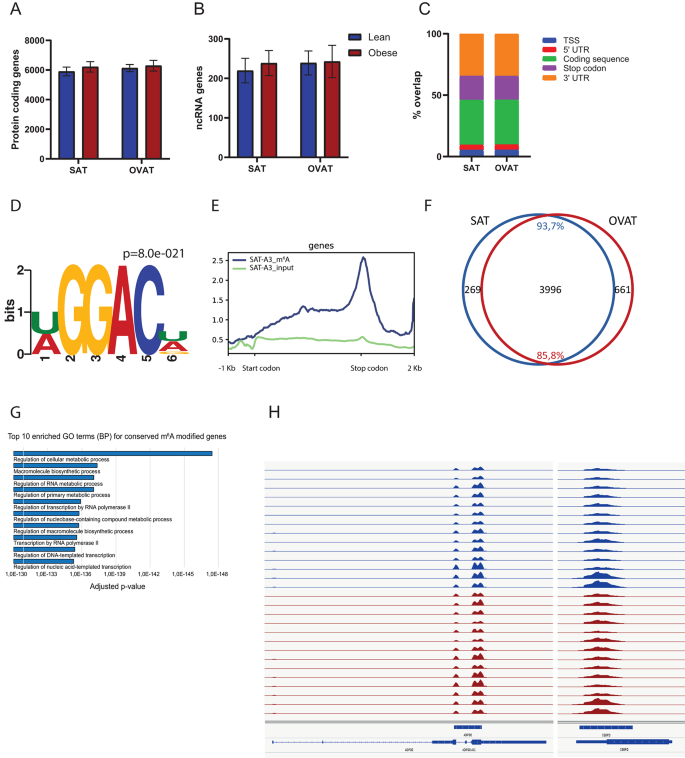
产品关联:实验所用关键产品:Millipore的m⁶A抗体(货号ABE572,发现队列)、Abcam的m⁶A抗体(货号ab286164,验证队列)、Takara的SMARTer® Stranded Total RNA-Seq Kit v2(货号634412)、Illumina HiSeq4000测序平台。
3.3 大样本队列的m⁶A靶点验证
实验目的:在更大样本量的验证队列中验证发现队列鉴定的分部特异性m⁶A靶点,分析性别对m⁶A分部差异的影响。
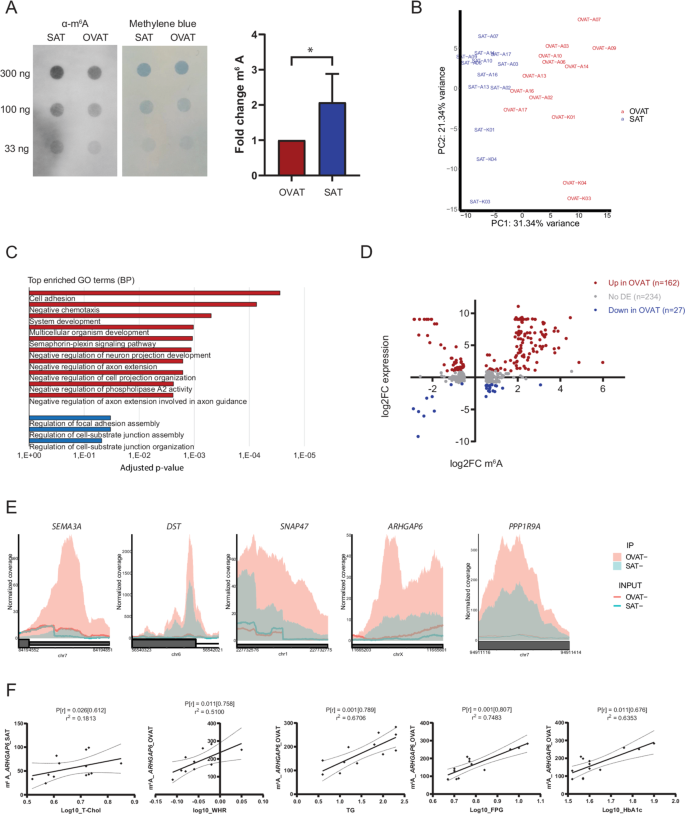
方法细节:对72名肥胖患者的配对皮下与内脏脂肪组织样本进行m⁶A免疫沉淀定量PCR(meRIP-qPCR),检测SEMA3A、SNAP47、PPP1R9A等靶点的m⁶A水平,采用Wilcoxon符号秩检验分析分部间差异,按性别分组后进一步分析效应量差异。
结果解读:SEMA3A、SNAP47、PPP1R9A在内脏网膜脂肪组织中的m⁶A水平显著高于皮下脂肪组织(n=72,P<0.05),其中女性受试者的分部差异效应量大于男性,男性仅SNAP47的m⁶A水平存在显著分部差异(n=25,P<0.05),提示性别可能影响m⁶A的分部特异性调控。
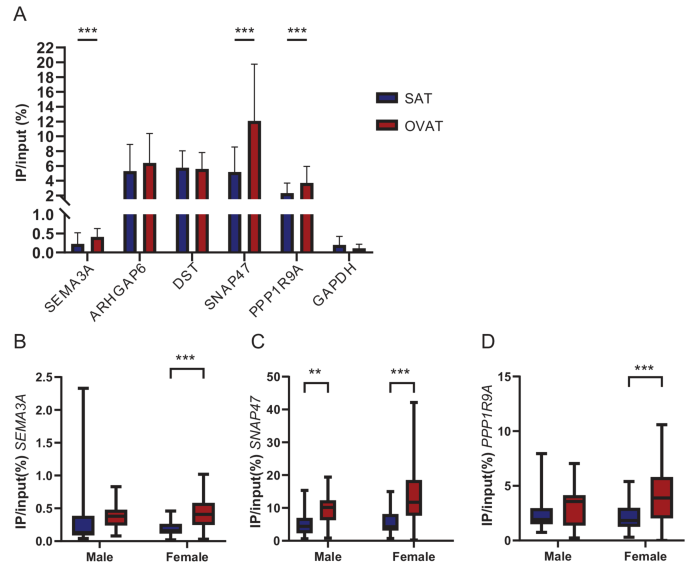
产品关联:实验所用关键产品:Thermo Fisher Scientific的High Capacity Reverse Transcription Kit、PowerUP SYBR green mastermix。
3.4 细胞类型特异性m⁶A贡献解析
实验目的:区分原代脂肪细胞与非脂肪细胞对脂肪组织m⁶A全局图谱的贡献,明确细胞类型特异性的m⁶A调控模式。
方法细节:对发现队列中4名患者的原代脂肪细胞进行m⁶A免疫沉淀测序,将其m⁶A峰数据与对应bulk脂肪组织的m⁶A数据进行比对,分析峰的重叠与差异,采用GO富集分析鉴定非脂肪细胞来源的m⁶A基因的功能通路。
结果解读:原代脂肪细胞的m⁶A修饰基因数量显著少于bulk脂肪组织,且内脏网膜脂肪组织中非脂肪细胞贡献的m⁶A峰数量是皮下脂肪组织的3倍(n=4,P<0.05),提示内脏脂肪组织中的非脂肪细胞(如免疫细胞、基质细胞)对m⁶A图谱的贡献更大;非脂肪细胞来源的m⁶A基因富集在细胞黏附、炎症反应等通路,与内脏脂肪组织的代谢风险特征一致。
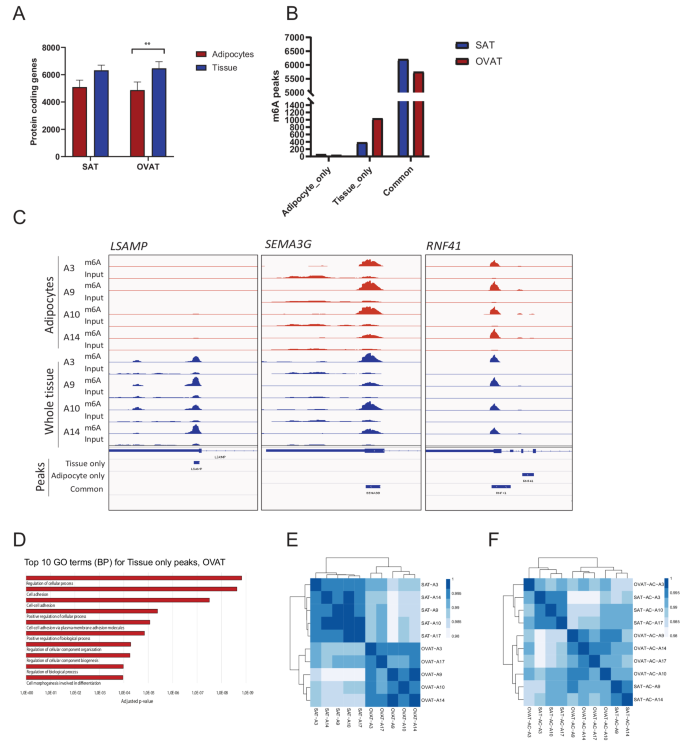
产品关联:文献未提及具体实验产品,领域常规使用Worthington的I型胶原酶分离原代脂肪细胞,Qiagen的RNeasy试剂盒提取RNA。
3.5 m⁶A对RNA稳定性的功能验证
实验目的:探索m⁶A修饰对靶基因RNA稳定性的调控作用,明确分部特异性的m⁶A功能效应。
方法细节:在皮下与内脏网膜脂肪组织来源的前脂肪细胞中,采用siRNA敲低m⁶A甲基转移酶METTL3,通过Click-iT™新生RNA捕获试剂盒检测SEMA3A、DST、IL1R1等靶基因的RNA稳定性,采用蛋白质免疫印迹(Western blot)验证METTL3的敲低效率。
结果解读:在内脏网膜脂肪组织来源的前脂肪细胞中,METTL3敲低后DST、FLRT3的RNA稳定性显著增加(8h时DST的RNA稳定性增加,n=3,P=0.002;4h时FLRT3的RNA稳定性增加,n=3,P=0.045),IL1R1的RNA稳定性也显著增加(4h时P=0.017,8h时P=0.004),提示m⁶A修饰促进这些转录本的降解;而在皮下脂肪组织来源的前脂肪细胞中,未观察到显著的RNA稳定性变化,显示出分部特异性的m⁶A功能效应。
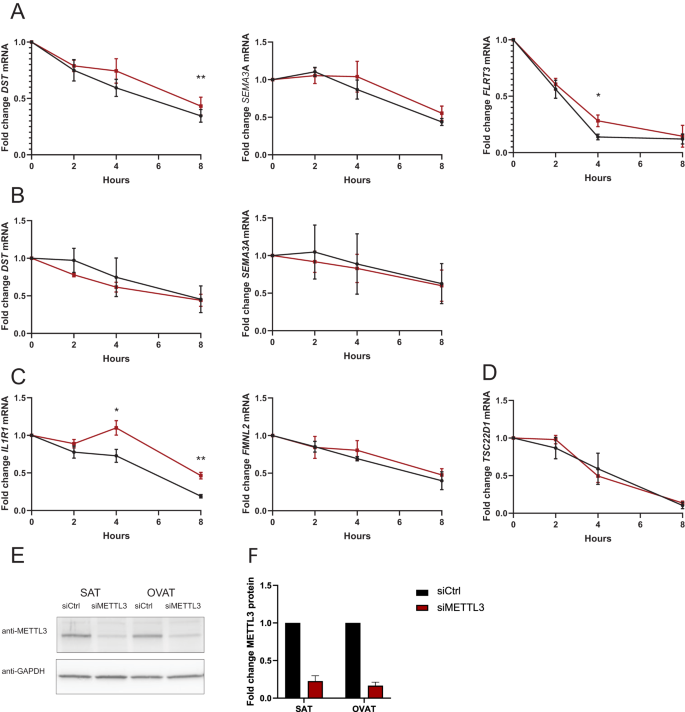
产品关联:实验所用关键产品:Thermo Fisher Scientific的RNAiMax转染试剂、METTL3 siRNA(货号s32142)、Click-iT™ Nascent RNA Capture Kit(货号C10365)、Proteintech的METTL3抗体(货号15073-1-AP)、Cell Signaling Technology的GAPDH抗体(货号2118)。
4. Biomarker研究及发现成果解析
本研究鉴定了一系列具有脂肪组织分部特异性及肥胖相关性的m⁶A修饰靶点,这些靶点可作为代谢疾病的潜在Biomarker,其m⁶A水平与肥胖临床变量显著关联,为代谢疾病的诊断与预后评估提供了新的表观转录组学指标。
Biomarker定位:本研究鉴定的Biomarker为mRNA的m⁶A甲基化修饰位点,筛选逻辑为“发现队列m⁶A免疫沉淀测序鉴定差异甲基化区域→验证队列m⁶A免疫沉淀定量PCR验证→关联肥胖临床变量”,涵盖分部特异性靶点(SEMA3A、SNAP47、PPP1R9A)与肥胖相关靶点(IL1R1、TSC22D1)两类。
研究过程详述:这些Biomarker来源于人类皮下与内脏网膜脂肪组织样本,采用m⁶A免疫沉淀测序进行初筛,在72名肥胖患者的验证队列中通过m⁶A免疫沉淀定量PCR验证,其中SEMA3A、SNAP47、PPP1R9A在内脏网膜脂肪组织中的m⁶A水平显著高于皮下脂肪组织(n=72,P<0.05);临床关联分析显示,ARHGAP6的m⁶A水平与腰臀比、甘油三酯、空腹血糖、HbA1c显著正相关(Spearman相关P<0.05),SEMA3A的m⁶A水平与甘油三酯、腰围、腰臀比显著正相关(P<0.05),IL1R1的m⁶A水平与甘油三酯、HbA1c显著相关(P<0.05)。

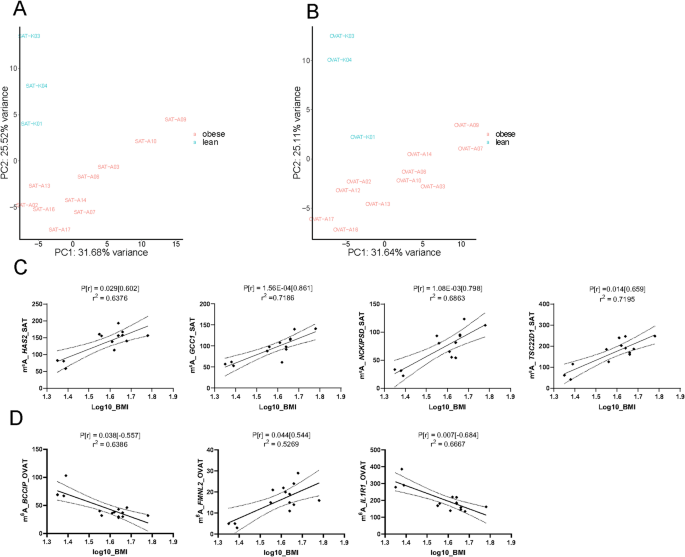
核心成果提炼:本研究首次鉴定了339个脂肪组织分部特异性m⁶A修饰基因,83个肥胖相关m⁶A修饰基因,其中SEMA3A、SNAP47、PPP1R9A可作为代谢疾病的潜在Biomarker,其m⁶A水平可反映脂肪组织分布与代谢风险;功能研究显示m⁶A修饰通过调控RNA稳定性参与脂肪组织的分部特异性调控,为代谢疾病的治疗提供了新的表观转录组学靶点。此外,IL1R1的m⁶A水平与血糖代谢指标显著关联,提示其可作为肥胖相关代谢紊乱的预后Biomarker,文献未明确提供风险比及ROC曲线数据。
