1. 领域背景与文献引入
文献英文标题:Transcriptomic analysis reveals tomato genes whose expression is induced specifically during effector-triggered immunity and identifies the Epk1 protein kinase which is required for the host response to three bacterial effector proteins;发表期刊:Genome Biology;影响因子:10.433;研究领域:植物免疫学(番茄-假单胞菌互作中的效应子触发免疫与模式触发免疫机制)
植物在长期进化中形成两层相互关联的免疫系统,模式触发免疫(PTI)通过模式识别受体识别微生物相关分子模式(MAMPs),快速激活氧化爆发、丝裂原活化蛋白激酶(MAPK)级联等防御反应,但病原菌可通过III型分泌系统递送效应子蛋白抑制模式触发免疫;效应子触发免疫(ETI)则通过植物抗性蛋白识别病原菌效应子,激活更强烈持久的防御反应,常伴随超敏反应(HR)。领域共识:此前研究表明模式触发免疫与效应子触发免疫的转录组变化存在高度重叠,大部分差异表达基因同时受两种免疫途径调控,且两者共享MAPK等核心信号通路;模式触发免疫响应具有协同性,因此更易被病原菌效应子抑制,而效应子触发免疫通过补偿性利用信号网络增强防御稳定性。当前研究空白在于缺乏番茄中效应子触发免疫与模式触发免疫特异性差异基因的系统鉴定,以及参与效应子触发免疫的新型激酶的功能验证。本文通过高通量RNA-seq技术,系统解析番茄中两种免疫途径的特异性转录组变化,筛选并鉴定了新型激酶SlEpk1,为植物免疫的特异性调控机制提供新视角。
2. 文献综述解析
作者对现有研究的分类维度为模式触发免疫与效应子触发免疫的转录组重叠性、信号通路差异及功能基因鉴定方法,重点对比了不同研究体系(拟南芥突变体、番茄早期转录组分析)在免疫响应基因鉴定中的结果与局限性。
现有研究通过微阵列技术和拟南芥突变体分析,发现模式触发免疫与效应子触发免疫的转录组变化存在高度重叠,大部分差异表达基因同时受两种免疫途径调控,且两者共享MAPK等核心信号通路;模式触发免疫响应具有协同性,因此更易被病原菌效应子抑制,而效应子触发免疫通过补偿性利用信号网络增强防御稳定性。早期番茄效应子触发免疫转录组研究采用GeneCalling技术,鉴定了432个效应子触发免疫诱导基因,但受限于当时缺乏番茄基因组注释,无法区分这些基因是否同时参与模式触发免疫;拟南芥中的研究虽揭示了免疫响应的动态变化,但番茄作为茄科模式作物,其免疫特异性基因的鉴定仍存在空白。现有技术方法的优势在于微阵列和突变体可大规模分析基因表达,但局限性在于无法精准区分特异性基因,且缺乏对番茄等作物的针对性研究。
本文针对现有研究未聚焦于免疫响应特异性基因的不足,采用RNA-seq技术在番茄中同步分析效应子触发免疫与模式触发免疫的转录组变化,首次鉴定出占比83%的效应子触发免疫特异性诱导基因,其中包含大量激酶编码基因;通过病毒诱导基因沉默(VIGS)功能筛选,首次发现GmPK6/AtMRK1样激酶家族成员SlEpk1特异性参与细菌效应子触发的效应子触发免疫,填补了该激酶家族在植物免疫中功能研究的空白,为解析效应子触发免疫特异性信号通路提供了新的关键靶点。
3. 研究思路总结与详细解析
本文的研究目标是系统鉴定番茄中效应子触发免疫与模式触发免疫特异性的差异表达基因,筛选并验证参与效应子触发免疫的关键调控基因;核心科学问题是效应子触发免疫特异性基因的功能及其在免疫信号通路中的定位;技术路线遵循“转录组差异分析→特异性基因筛选→功能验证→信号通路定位”的闭环逻辑,通过多组学与功能基因组学结合的方法,深入解析番茄免疫响应的特异性机制。
3.1 转录组差异分析鉴定效应子触发免疫/模式触发免疫特异性基因
实验目的:通过RNA-seq技术比较番茄在效应子触发免疫与模式触发免疫条件下的转录组差异,筛选特异性响应的基因。
方法细节:选用携带功能性Pto/Prf免疫通路的抗性番茄RG-PtoR,以及Prf功能缺失的易感番茄RG-prf3、RG-prf19,真空接种Pst DC3000菌株,分别在接种后4小时、6小时采集叶片样本;同时构建Pst DC3000的ΔfliC(缺失鞭毛蛋白,仅触发效应子触发免疫)、ΔavrPtoΔavrPtoB(缺失AvrPto/AvrPtoB,仅触发模式触发免疫)、ΔavrPtoΔavrPtoBΔfliC(缺失效应子与鞭毛蛋白,无免疫响应)突变体,处理RG-PtoR番茄后6小时取样;采用Illumina HiSeq平台进行RNA-seq,以RPKM≥3为基因表达阈值,≥2倍表达变化且P<0.05为差异基因筛选标准。
结果解读:转录组分析显示,接种后6小时效应子触发免疫特异性诱导基因占总诱导基因的83%,模式触发免疫特异性基因占3%,两者共享14%;GO功能富集分析表明,效应子触发免疫特异性基因显著富集于细胞死亡调控、活性氧响应、囊泡运输等与超敏反应相关的过程,而模式触发免疫特异性基因富集于次生代谢生物合成等过程;激酶编码基因在效应子触发免疫特异性诱导基因中占比高达27%,提示激酶在效应子触发免疫调控中的核心作用。
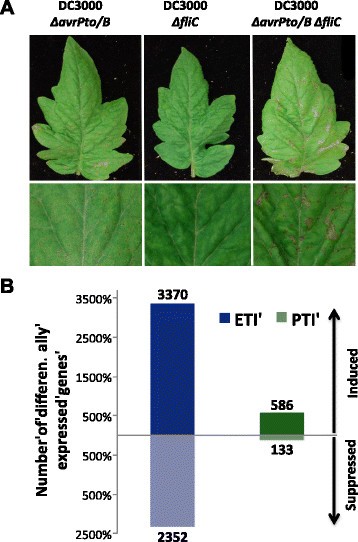
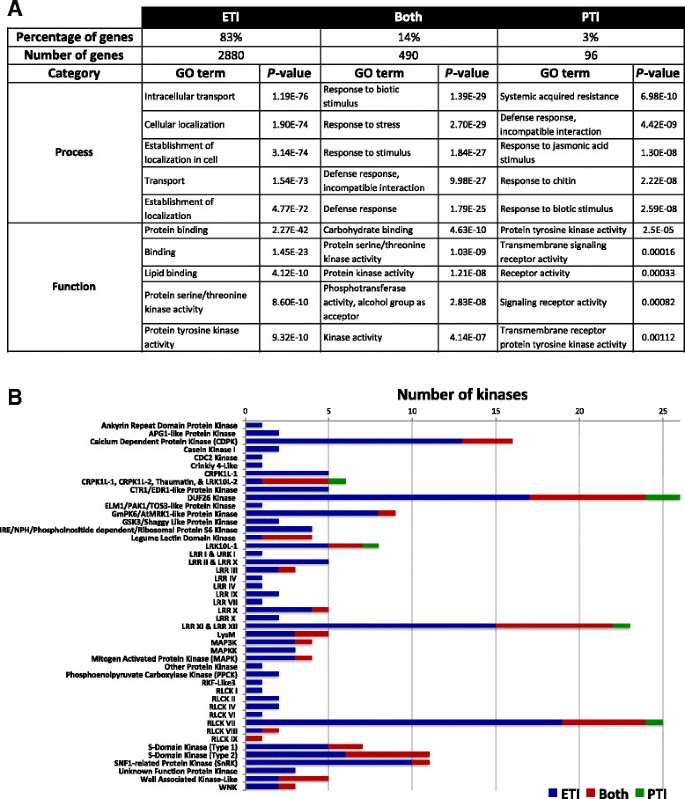
产品关联:文献未提及具体实验产品,领域常规使用Illumina HiSeq系列测序平台、TRIzol或同类RNA提取试剂、qRT-PCR试剂盒等。
3.2 效应子触发免疫/模式触发免疫特异性报告基因的开发与验证
实验目的:从转录组筛选结果中开发可特异性区分效应子触发免疫与模式触发免疫的报告基因,为后续免疫响应研究提供工具。
方法细节:从效应子触发免疫特异性基因中选择UDP-葡萄糖基转移酶(Solyc09g092500、Solyc10g085880)、漆酶(Solyc04g072280),从模式触发免疫特异性基因中选择NAC结构域蛋白(Solyc02g069960)、渗透蛋白样蛋白(Solyc11g044390)、脂颗粒丝氨酸酯酶(Solyc04g077180);用不同Pst DC3000突变体处理RG-PtoR番茄,分别在接种后3、6、9、12小时取样,通过qRT-PCR验证基因表达的特异性。
结果解读:qRT-PCR结果显示,效应子触发免疫特异性基因在接种后6、9、12小时仅在效应子触发免疫条件下显著诱导表达(n=4,P<0.01),而模式触发免疫特异性基因在接种后6小时起仅在模式触发免疫条件下显著诱导表达;接种后3小时所有基因均未呈现特异性表达,推测此时病原菌效应子尚未完成向植物细胞的转运。
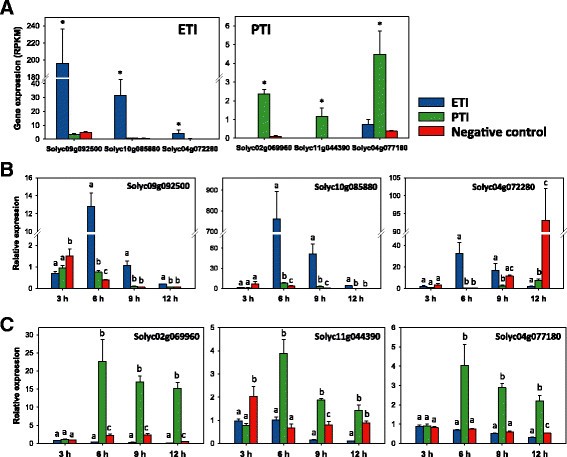
产品关联:文献未提及具体实验产品,领域常规使用qRT-PCR荧光定量试剂盒、反转录试剂盒等。
3.3 VIGS筛选参与效应子触发免疫的关键基因
实验目的:从效应子触发免疫特异性基因中筛选对效应子触发免疫至关重要的功能基因,重点关注激酶编码基因。
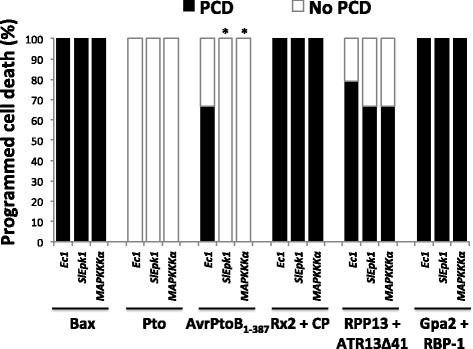
方法细节:选择30个效应子触发免疫特异性的激酶与转录因子编码基因,设计VIGS沉默片段,构建TRV病毒沉默载体,转化农杆菌后侵染本氏烟;沉默后用农杆菌共表达Pto与avrPto,触发效应子触发免疫相关的程序性细胞死亡(PCD),以已知参与效应子触发免疫的SlMAPKKKα、SlMEK2为阳性对照,GFP片段为阴性对照,筛选延迟PCD的基因。
结果解读:筛选到SlEpk1(Solyc12g009340)基因,沉默该基因后Pto/AvrPto触发的PCD显著延迟(n=12,P<0.01);进一步验证发现,SlEpk1沉默不影响flg22诱导的ROS产生,说明其特异性参与效应子触发免疫而非模式触发免疫;RNA-seq结果显示SlEpk1在效应子触发免疫条件下特异性高表达(n=3,P<0.05),属于GmPK6/AtMRK1样激酶家族,此前该家族成员的免疫功能尚未被报道。
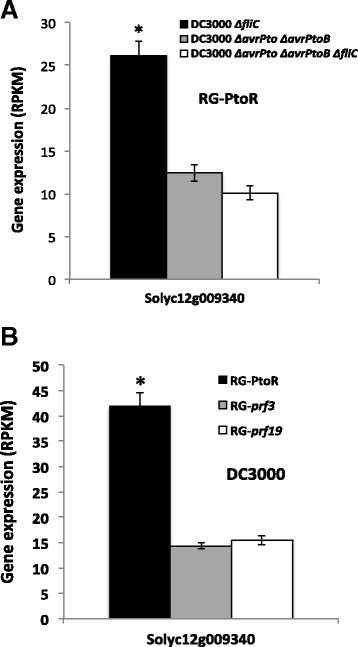
产品关联:文献未提及具体实验产品,领域常规使用TRV病毒诱导基因沉默体系、农杆菌GV2260等菌株。
3.4 SlEpk1在效应子触发免疫中的功能验证
实验目的:验证SlEpk1对不同细菌效应子触发效应子触发免疫的调控作用,并明确其免疫响应的特异性。
方法细节:在稳定表达Pto的本氏烟中沉默SlEpk1,接种表达AvrPto的Pst tabaci菌株,观察病害症状并统计细菌增殖量;同时接种表达HopQ1-1的Pst tabaci菌株,验证SlEpk1对其他细菌效应子的作用;进一步测试非细菌效应子(如PVX外壳蛋白CP、卵菌效应子ATR13、线虫效应子RBP-1等)触发的PCD,分析SlEpk1的响应特异性。
结果解读:沉默SlEpk1后,本氏烟对AvrPto和HopQ1-1触发的效应子触发免疫均显著受损,病害症状加重,细菌增殖量较对照增加2-3倍(n=6,P<0.05);但对非细菌效应子触发的PCD无显著影响,说明SlEpk1特异性参与细菌效应子介导的效应子触发免疫。
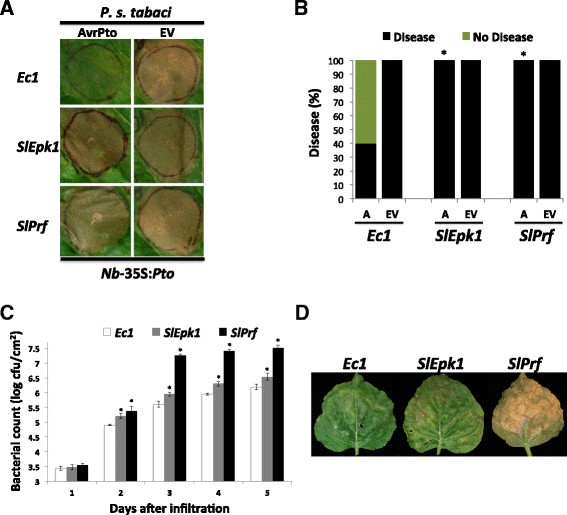
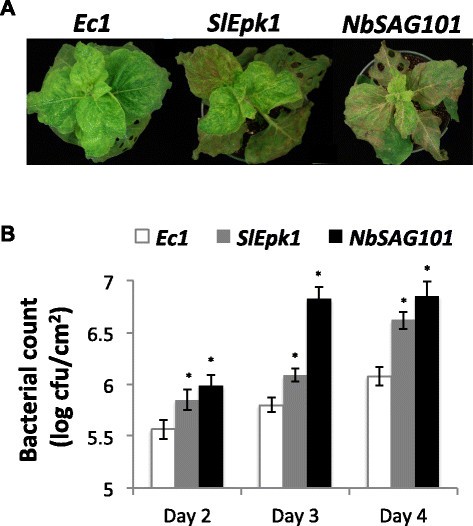
产品关联:文献未提及具体实验产品,领域常规使用King"s B、LB等细菌培养基、病原菌计数相关试剂等。
3.5 SlEpk1的信号通路定位
实验目的:确定SlEpk1在效应子触发免疫信号通路中的上下游位置,明确其与核心MAPK通路的关系。
方法细节:在本氏烟中分别沉默SlEpk1、SlMAPKKKα、SlMEK2、SlPrf,构建estradiol诱导表达SlMAPKKKα或组成型激活的SlMEK2DD的载体,转化农杆菌后侵染沉默后的叶片,诱导表达后观察PCD发生情况。
结果解读:沉默SlEpk1不影响SlMAPKKKα或SlMEK2DD诱导的PCD,而沉默SlMEK2可完全抑制SlMAPKKKα诱导的PCD,说明SlEpk1作用于MAPK通路上游,或独立于该通路参与效应子触发免疫信号调控。
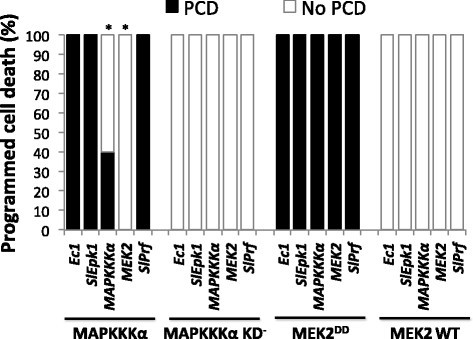
产品关联:文献未提及具体实验产品,领域常规使用诱导型表达载体、estradiol等诱导试剂。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为效应子触发免疫特异性激酶基因SlEpk1,其筛选与验证逻辑为“RNA-seq转录组筛选→VIGS功能验证→多病原菌效应子验证→信号通路定位”,完整覆盖从分子鉴定到功能解析的全链条。
SlEpk1属于GmPK6/AtMRK1样激酶家族,是番茄中效应子触发免疫特异性诱导表达的激酶基因,其筛选逻辑为通过RNA-seq对比效应子触发免疫与模式触发免疫条件下的转录组差异,筛选出仅在效应子触发免疫中显著诱导的基因,再通过VIGS功能筛选确定其对效应子触发免疫的必要性。
SlEpk1的转录本来源于番茄叶片在效应子触发免疫条件下的RNA-seq数据,其表达在抗性番茄RG-PtoR中显著高于易感番茄(n=3,P<0.05);验证方法包括VIGS沉默后观察PCD与细菌增殖、qRT-PCR验证表达特异性、不同效应子触发的免疫响应测试;特异性数据显示,SlEpk1仅参与细菌效应子(AvrPto、HopQ1-1)触发的效应子触发免疫,对模式触发免疫及非细菌效应子触发的免疫响应无影响,其在效应子触发免疫中的功能具有高度特异性。
SlEpk1是首次被鉴定为参与植物效应子触发免疫的GmPK6/AtMRK1样激酶家族成员,其功能为调控细菌效应子触发的效应子触发免疫,作用于MAPK通路上游;该基因的发现填补了番茄效应子触发免疫特异性激酶研究的空白,为解析植物免疫的特异性调控机制提供了新的分子靶点;统计学结果显示,沉默SlEpk1后细菌增殖量较对照显著增加(P<0.05,n=6),PCD发生率显著降低(P<0.01,n=12),证明其对效应子触发免疫的关键调控作用。
